血清转化生长因子β1与白细胞介素6水平对原发性干燥综合征并发神经系统病变的预测价值
唐海,龚向瑶,张婷
(徐州医科大学附属医院,1.神经内科;2.风湿免疫科,江苏 徐州 221000)
原发性干燥综合征(primary Sjögren’s Syndrome,pSS)是一种主要累及外分泌腺体的慢性自身免疫性疾病,临床表现除口干、眼干及伴随的淋巴细胞浸润所致的腺体组织损伤外,还可伴有其他器官系统的损害,部分患者会出现神经系统病变[1]。pSS的神经系统病变可累及周围神经和中枢神经。周围神经系统损害发生率约占30%,以三叉神经损害较多见,表现为一侧或双侧的面部麻木和感觉减退,也可累及面神经,出现周围性面瘫[2]。中枢神经系统的损害约占20%,表现为偏瘫、失语、偏身性感觉障碍、偏盲、癫痫发作以及脑干和小脑的症状,也可表现为意识水平异常、精神障碍及脑炎等,其中以帕金森综合症、癫痫及精神障碍最常见[3]。神经系统病变对pSS患者的生活质量和预后影响较大,且因其起病隐匿,容易被神经内科和风湿科医生误诊,因此早期评估神经系统病变的方法具有重要临床意义。相关研究[4-5]表明,炎症因子在pSS患者的病理过程中发挥着重要的作用。转化生长因子β1(transforming growth factor β1,TGF-β1)和白细胞介素6(Interleukin-6,IL-6)是两种重要的炎症因子,参与了免疫细胞的活化与分化,调控炎症反应的程度和持续时间[6]。此外,TGF-β1和IL-6也被认为参与了自身免疫性疾病的发生和发展过程[7-8]。尽管有关TGF-β1和IL-6在pSS患者中的研究较多,但其与神经系统病变的关系尚不清楚。本研究旨在探讨血清TGF-β1、IL-6水平对原发性干燥综合征(pSS)并发神经系统病变的预测价值。
1 资料与方法
1.1 一般资料
选取2019年1月至2022年12月徐州医科大学附属医院收治的80例pSS住院患者为研究对象,根据是否并发神经系统病变分为观察组(n=26)和对照组(n=54)。本研究经院医学伦理委员会审核批准,患者及其家属知情同意。纳入标准:(1)年龄18~65岁;(2)符合美国风湿病学会(ACR)和欧洲干燥综合征研究小组(EULAR-SS)对pSS的分类标准[9];(3)未接受免疫抑制剂、激素或其他相关治疗;(4)未合并其他系统性自身免疫性疾病。排除标准:(1)存在心、肝、肾等严重器官功能不全;(2)合并感染性疾病、癌症;(3)其他已知的导致神经系统病变的原因,如中枢神经系统感染、颅脑外伤等。
1.2 方法
1.2.1 一般资料 包括患者性别、年龄、病程、神经系统体格检查资料、CT检查、尿常规和尿沉渣镜检等。
1.2.2 干燥综合征活动度评估 采用干燥综合征活动指数(EULAR Sjögren’s Syndrome Disease Activity Index,ESSDAI)[10]评估,涵盖机体12个方面,总分0~36分。
1.2.3 血清学检查 包括血常规、血清TGF-β1、IL-6、免疫球蛋白G(IgG)、类风湿因子(RF)、红细胞沉降率(ESR)、超敏C反应蛋白(hs-CRP)、补体C3和C4。
1.2.4 抗体检测 采用间接免疫荧光检测抗核抗体(ANA);蛋白印迹法检测抗SSA抗体、抗SSB抗体、抗Ro52抗体。
1.3 观察指标
(1)患者一般临床特征;(2)影响pSS并发神经系统病变的因素;(3)TGF-β1和IL-6对pSS并发神经系统病变的预测价值。
1.4 统计学分析

2 结果
2.1 两组患者一般临床特征比较
与对照组相比,观察组患者病程更短、口干症与干眼症发生率更低、ESSDAI评分高、TGF-β1与IL-6水平更高、补体C4水平更低(P<0.05);两组患者其他指标比较,差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
2.2 影响影响pSS并发神经系统病变的因素
将pSS并发神经系统病变作为因变量,将一般临床特征中差异有统计学意义的指标作为自变量,回归分析结果显示,TGF-β1和IL-6是pSS并发神经系统病变的独立危险因素(P<0.05)。见表2。
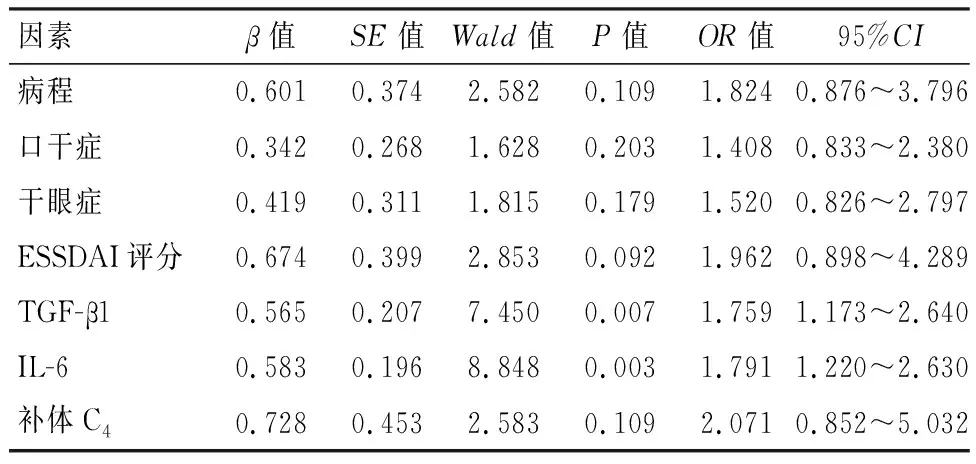
表2 影响影响pSS并发神经系统病变的因素
2.3 TGF-β1和IL-6对pSS并发神经系统病变的预测价值分析
ROC曲线分析显示,TGF-β1、IL-6对pSS并发神经系统病变均有较高价值(P<0.05),二者联合的预测价值更高(P<0.05)。见表3及图1。
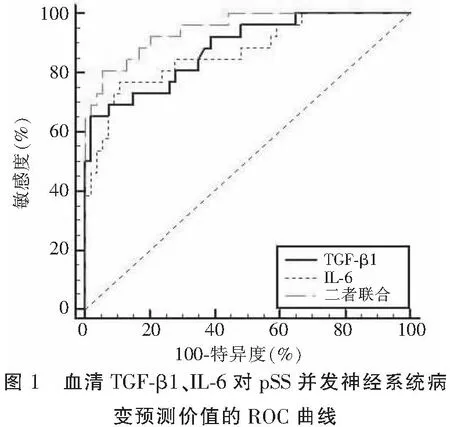
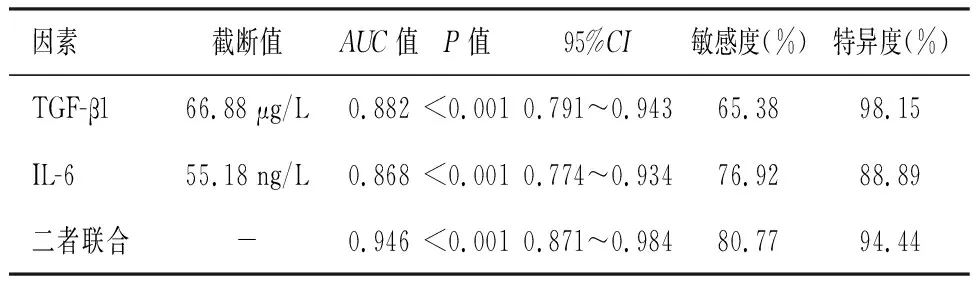
表3 血清TGF-β1、IL-6对pSS并发神经系统病变的预测价值分析
3 讨论
pSS是一种慢性、自身免疫性疾病,以涉及唾液腺和泪腺的淋巴浸润为特征,导致干燥症状,如口干、眼干等。除了明显的干燥症状外,pSS还可累及多个器官系统,包括神经系统[11]。神经系统病变是pSS并发症中的一个重要方面,可导致多种神经系统疾病,如周围神经病变、中枢神经系统病变和自主神经病变等。pSS并发神经系统病变的临床症状复杂多样,且起病隐匿,部分患者发病急,进展快,若未及时治疗容易遗留神经损伤功能障碍后遗症[12]。因此,对pSS患者神经系统病变应及早发现、及早治疗,以控制病情,提高患者生活质量。
有文献[13-14]报道,pSS并发神经系统病变的发生率为8.50%~70.00%,本研究共纳入80例pSS患者,其中26例并发神经系统病变,发生率为32.50%。导致此差异的原因可能与研究样本量大小、地域差异以及参考标准不同等有关。本研究单因素分析显示,与未并发神经系统病变的pSS患者相比,并发神经系统病变的pSS患者口干症与干眼症发生率更低(P<0.05),提示临床诊断神经系统病变时可能会忽视pSS,造成漏诊或误诊;病程更短、ESSDAI评分更高(P<0.05),提示在较短的发病时间内,持续的较高疾病活动可能与神经系统病变有关;而血清TGF-β1与IL-6水平高、补体C4水平低(P<0.05),提示神经系统病变的发生可能与机体炎症反应有关。多因素Logistic回归分析结果显示,TGF-β1和IL-6是pSS并发神经系统病变的独立危险因素(P<0.05)。TGF-β1和IL-6作为两种重要的炎症介质,在许多自身免疫疾病中发挥着重要的作用。TGF-β1具有多种生物学功能,包括细胞增殖、分化、凋亡等,同时也参与了免疫调节、炎症反应和纤维化过程[15]。研究[16]发现,在pSS患者中,TGF-β1水平升高可能与免疫调节的失衡和自身免疫炎症反应有关。研究[17]表明,TGF-β1可能在pSS的病理过程中发挥重要作用,促进炎症细胞浸润和组织纤维化。同时,TGF-β1的升高也可能与神经系统病变的发生和发展相关,有研究[18]报道,TGF-β1可影响神经元的存活和突触可塑性,并参与神经损伤的修复过程。因此,血清TGF-β1水平可能与pSS并发神经系统病变的评估具有一定的关联性。本研究ROC曲线分析显示,TGF-β1预测pSS并发神经系统病变的AUC为0.882,敏感度为65.38%,而特异度高达98.15%,提示TGF-β1可能是预测pSS患者神经系统病变发生的一个潜在生物学指标。IL-6是一种免疫调节因子,广泛参与免疫调节、炎症反应和组织修复等生理过程,IL-6的升高可能与炎症介质的释放、自身抗体的产生和免疫细胞的异常活化有关。研究[19]显示,IL-6在中枢神经系统中的表达增加可能参与了神经炎症的发生和发展。此外,IL-6还可以影响神经元的功能和突触传递,对神经系统的正常功能产生影响[20]。因此,血清IL-6水平对pSS并发神经系统病变的评估也具有一定的临床意义。本研究ROC曲线分析显示,IL-6预测pSS并发神经系统病变的AUC为0.868,敏感度为76.92%,特异度为88.89%,提示IL-6可能参与了pSS患者神经系统病变的发生发展,并可能成为评估疾病进展和预后的一个重要指标。二者联合检测对pSS并发神经系统病变的预测价值的AUC为0.946,敏感度为80.77%,特异度为94.44%,TGF-β1和IL-6联合将更有助于评估pSS患者神经系统病变的发生发展和预后。
综上,血清TGF-β1和IL-6可以作为PSS并发神经系统病变的潜在生物标志物,为早期诊断和治疗提供重要依据。进一步的研究还有助于揭示TGF-β1和IL-6在pSS并发神经系统病变机制中的作用,为该疾病的治疗和预防提供新的靶点。

