药物临床试验机构质量管理现状调查分析*
谭琴,邱攀博,李高扬,李庆娜,陆芳
(1.中国中医科学院西苑医院临床药理研究所,国家药品监督管理局中药临床研究与评价重点实验室,国家中医心血管病临床医学研究中心,北京 100091;2.天津开心生活科技有限公司,天津 301818 )
在药物临床试验数据核查工作开展后,医药企业的药品注册申请因存在真实性、完整性、规范性等问题而不予通过,更有因涉嫌数据造假而被立案调查的机构与合同研究组织,这反映出机构在临床试验质量管理建设、实施中存在一定问题。临床试验质量一直是各国监管部门关注的重点,为提升临床试验质量,2013年美国食品药品管理局(Food and Drug Administration,FDA)与欧洲药品管理局(European Medicines Agency,EMA)相继发布了开展基于风险的质量管理的指导文件[1-2],并逐渐在各国得到推广应用,近年来我国也开始提倡对临床试验进行基于风险的管理。质量管理贯穿试验始终,既是保障临床试验顺利实施,获得真实、准确、完整数据的重要手段,也是保证受试者安全的措施,因此为了解机构目前的质量管理现状及机构对基于风险的质量管理的认知及运用情况,通过问卷对全国各省市临床试验机构进行调查,以期发现机构质量管理中的不足之处,并给予相应对策,为机构提升自身能力建设提供参考。
1 资料与方法
1.1资料来源 2022年7月1-31日通过微信群和邮件发送给全国各省市临床试验机构人员,建议由机构办公室秘书、质量控制人员或机构办公室主任进行填写。
1.2研究方法 通过问卷星电子问卷设计、搜集,共包含18个问题,均为必答题,不涉及个人姓名、电话等隐私信息。①预调查:通过前期文献查阅、专家研讨形成纸质问卷;数据管理员制作电子版问卷,核对后发布预调查问卷;研究人员将预调查问卷链接发送给7名GCP机构工作人员进行试填写,根据预调查结果和调查人员反馈情况对问卷进行优化。②正式调查:使用问卷星制作正式调研问卷,问卷内容涉及:被调查人员和临床试验机构基本信息、机构质量管理模式、人员培训、信息化系统应用、机构开展基于风险的质量管理情况以及机构与申办方质量管理协同配合等。(完整问卷内容见附件)研究人员将电子问卷二维码和链接通过微信群和邮件发送至临床试验机构;机构人员识别二维码或点击链接后阅读知情同意书,点击“同意并继续”则可进行问卷填写,填写结束点击“提交”完成调查。
1.3数据处理 将问卷星原始数据导入Excel 2019进行数据整理,对重复提交、数据类型不符合要求,如应填写为数字但填写为字母的异常数据进行删除处理。
以SPSS 26.0版进行统计描述或统计分析,计量资料正态分布采用均值±标准差进行统计描述,非正态分布采用中位数、极大极小值、四分位数进行统计描述;计数资料采用频数(构成比)进行统计描述。比较西医医院、中医医院、中西医结合医院三类机构以及新老机构(2019年及之前获批的机构设定为老机构,2020年及之后通过备案的机构设定为新机构)在质量管理建设上是否存在差异,计量资料符合正态分布组间比较采用t检验或方差分析,不符合正态分布采用非参数检验;计数资料根据资料理论频数情况采用卡方检验、校正卡方或Fisher精确概率法检验,以P<0.05为差异有统计学意义。
2 结果
在调查期限内共回收124家药物临床试验机构填写的问卷130份,剔除1家机构重复填写且存在矛盾的2份问卷,5家机构重复提交的问卷各删除1份、最终纳入123家机构123份问卷进行分析。
2.1问卷填写者基本情况 此次填写问卷的人员包括办公室秘书65人(52.8%),机构办公室主任34人(27.6%),质量控制员19人(15.4%),机构主任2人(1.6%),药品管理员2人(1.6%),伦理秘书1人(0.8%);其中正高级11人(8.9%),副高级41人(33.3%),中级53人(41.5%),初级16人(13.0%),其他2人(1.6%)。
2.2被调查临床试验机构基本情况
2.2.1机构性质与地域分布情况 123家机构包括西医医院86家(69.9%),中医医院19家(15.4%)、中西医结合医院18家(14.6%)。本次调查的机构来自全国25个省份,地域分布与药物临床试验机构备案管理信息平台的机构地域分布构成差异无统计学意义(P=0.59)。见表1。
2.2.2机构获批或通过GCP资格备案时间 在2000年以前获批的13家(10.6%),2000-2009年获批的共有17家(13.8%),2010-2019年获批的共有61家(49.6%),2020-2022年4月通过备案监督检查的共有32家(26.0%)。
2.3机构质量管理现状
2.3.1机构质量管理模式与质量管理人员情况 104家(84.6%)机构采取GCP内部质控;7家(5.7%)采用外部质控管理模式,要求申办方或合同研究组织(contract research organization,CRO)达到机构质控标准;4家(3.3%)机构委托第三方质控,8家(6.5%)选择其他质量管理模式,如前述3种管理模式的组合。
对机构内部质量管理人员构成情况进行调查,结果显示:122家(99.2%)由机构人员参与质量管理,1家(0.8%)家只有临床科室人员参与;另有62家(50.4%)同时有临床科室人员参与,19家(15.4%)同时会组织院内专家参与质量管理,16家(13.0%)同时会按需邀请外部专家指导开展质量管理。
对机构参与临床试验管理的专职人员数量进行调查,123家机构共有专职管理人员421人,最少0人,最多20人,中位数为3人,平均数为3.4人。对各机构专职人员管理试验项目(调查中机构填写的2021年承担及完成项目数)、专业的数量进行分析,在试验项目管理情况中,除去9家在2021年没有开展临床试验项目(包括药物、器械临床试验)与1家未配备专职人员的机构,余下的113家机构中,1名专职人员最少管理0.3项,最多管理166.7项,中位数为8.3项,平均数为16.8项。在临床试验专业管理情况中,去除2家临床专业数为0个与1家未配备专职人员的机构,以及1家器械专业数目异常的机构,余下的119家机构中,1名专职人员管理的临床专业(涵盖药物和医疗器械所有专业)数量最少0.5个,最多77个,中位数为6.8个,平均数为10.9个,机构专职人员与专业数目配比情况见图1。
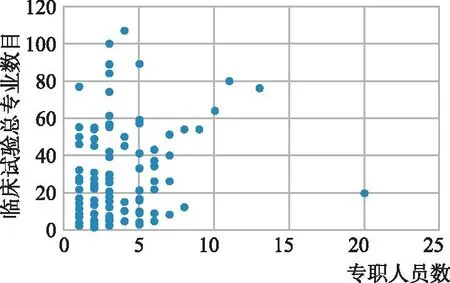
图1 机构专职管理人员与临床试验专业数目Fig.1 Number of full-time quality management personnel and clinical trial specialties
2.3.2机构人员培训情况 机构近3年内平均每年对研究人员开展GCP培训的次数:每年1次24家(19.5%),每年2或3次65家(52.8%),每年4或5次18家(14.6%),每年≥6次16家(13.0%)。调查机构3年内开展院内培训、省级、国家级3种级别的培训情况,结果如下:同时开展过3种级别培训的共67家(54.5%),开展过其中两种级别培训的共31家(25.2%),只开展过一种级别培训的共25家(20.3%),包括开展国家级培训的有9家(7.3%),省级培训10家(8.1%),院级培训6家(4.9%)。
2.3.3经费分配制度 调查了“针对参与临床试验的研究团队成员是否有明确、合理的经费分配制度”,指按照临床试验项目实施中人员的贡献、技术难度和工作量等方面,明确不同岗位人员和具体工作的劳务分配比例、分配的时限等。调查结果显示95家(77.2%)机构已具备,28家(22.8%)机构尚未建立。
2.3.4信息化系统应用 对“是否已建立GCP信息化管理系统”进行调查,结果显示:已建立49家(39.8%)(包括正式运行与试运行的机构),建立中41家(33.3%),未建立33家(26.8%)。
对已建立GCP信息化管理系统的49家机构系统功能模块进行调查,超过一半的系统具备项目的立项审查(93.9%)、项目的伦理审查(79.6%)、试验药物管理(71.4%)、受试者的管理(55.1%)功能,部分系统建立了人员培训管理、人员履历与资质管理、数据资源管理、远程监查、安全性事件管理、经费管理、合同管理、遗传资源等功能模块。
2.3.5机构开展基于风险的质量管理的情况 对“机构是否建立并运行基于风险的质量管理标准流程/操作指南?”进行调查,结果显示:42家(34.1%)(包括已运行及建立但尚未运行)已建立;20家(16.3%)在建立中;44家(35.8%)未建立,但已有建立的计划;17家(13.8%)未建立且目前尚无建立计划。
已建立基于风险的质量管理流程的42家机构中,1家机构在2010年就已建立,是调查机构中建立时间最早的一家。2013-2018年建立的共8家机构,2019-2022年共有33家机构建立,此外,有17家机构会对风险进行分级,其中4家机构将风险分为有、无两级,另外13家机构风险等级分为高、中、低、无4级。
2.3.6机构与申办方质量管理协同配合的情况 对“机构2021年在研和完成的临床试验中,申办者/CRO制定基于风险的质量管理计划的项目大致占比”进行调查,结果如下:除去9家在2021年没有开展临床试验项目(包括药物、器械临床试验)的机构,余下的114家机构中29家(25.4%)机构选择只有不足5%的项目申办者/CRO制定了基于风险的质量管理计划,17家(14.9%)机构选择5%~20%的项目有基于风险的质量管理计划,21家(18.4%)机构选择超过20%的项目有基于风险的质量管理计划,47家(41.2%)机构选择不了解申办者/CRO的质量管理计划。
调查“机构2021年在研和完成的试验中,申办者/CRO开展稽查(监查除外)的项目大致占比”,具体情况如下:除去9家在2021年没有开展临床试验项目(包括药物、器械临床试验)的机构,余下的114家机构中7家(6.1%)机构2021年申办者/CRO未进行项目稽查,41家(36.0%)机构只有不足20%的项目申办者/CRO开展了稽查工作,33家(28.9%)机构有20%~50%的项目申办者/CRO开展了稽查,33家(28.9%)机构有超过50%的项目申办方/CRO开展了稽查。
2.4质量管理现状分类分析 依据调查机构的类别,对调查结果进行了分类分析。西医医院、中医医院、中西医结合医院之间在承接临床试验项目数、质量管理模式上差异有统计学意义(P<0.05),在专职管理人员人均负责临床试验项目数、培训次数、经费分配制度、信息化系统、基于风险的质量管理开展、申办方风险管理计划了解情况方面差异无统计学意义(表2)。新老机构在承接临床试验项目数、专职管理人员人均负责临床试验项目数、信息化系统方面差异有统计学意义(P<0.05),在质量管理模式、培训次数、经费分配制度、基于风险的质量管理开展、申办方风险管理计划了解情况方面差异无统计学意义(表3)。
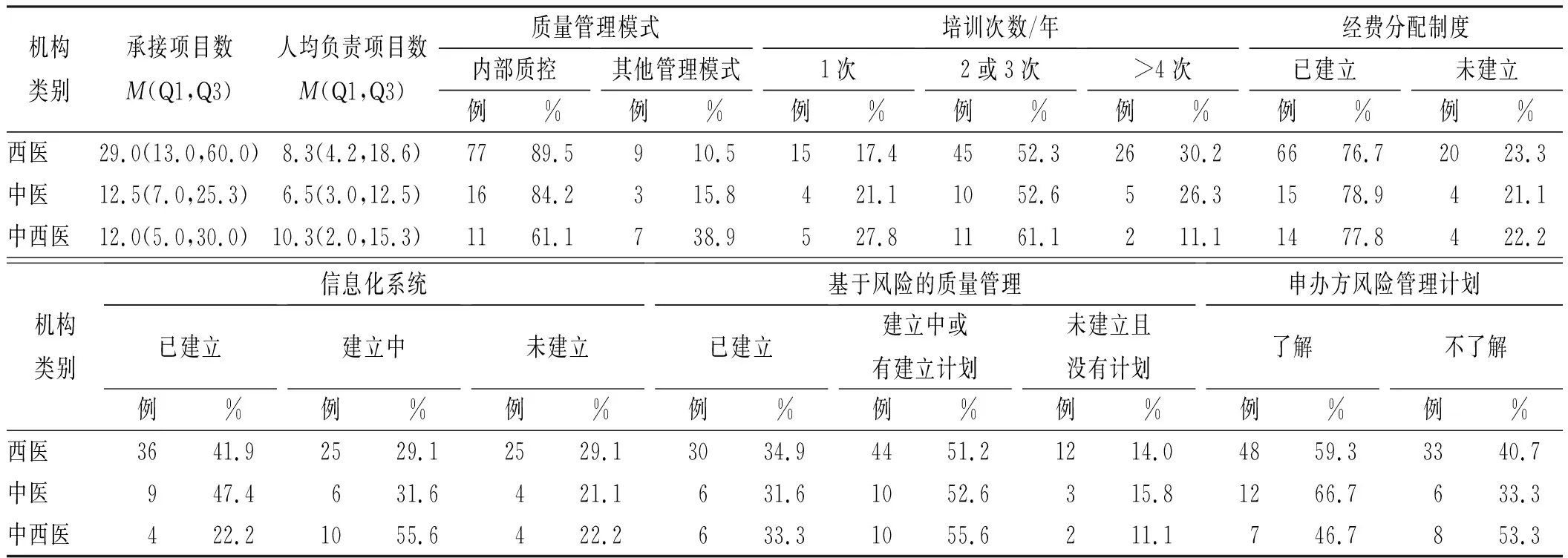
表2 西医、中医、中西医机构质量管理现状分析Tab.2 Analysis of the current situation of quality management in Western medicine,Chinese medicine,and Chinese and Western medicine institutions n(%)
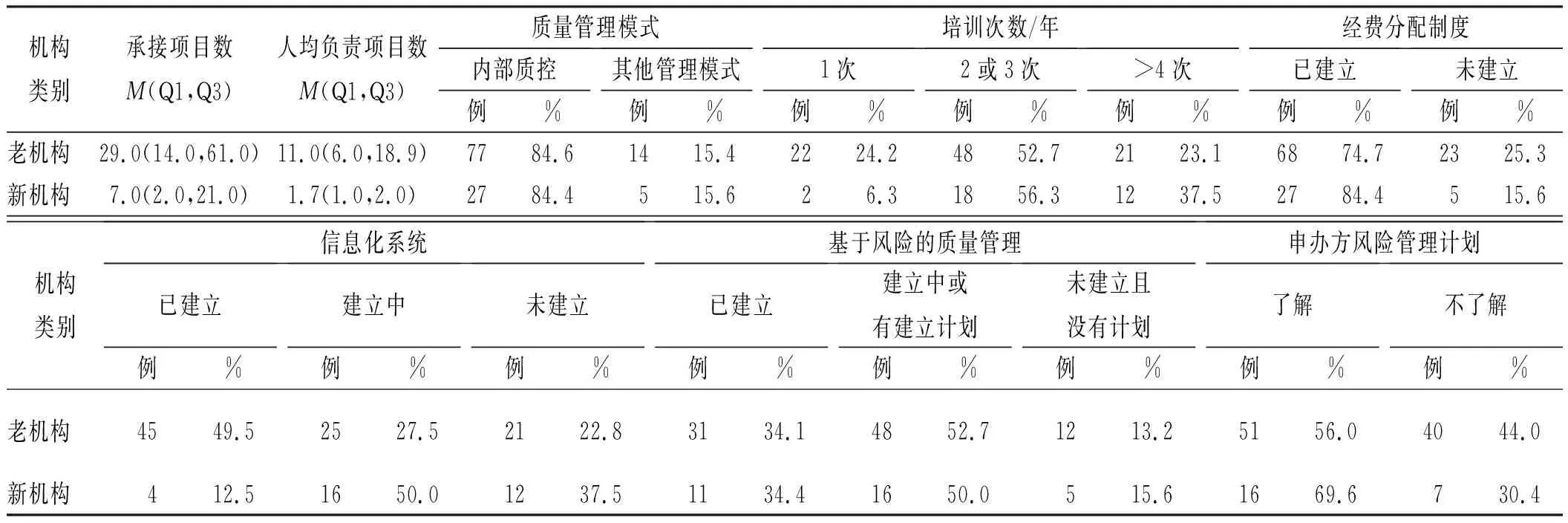
表3 新老机构质量管理现状分析Tab.3 Analysis of the current situation of quality management in new and old institutions n(%)
3 讨论
机构备案制实施后越来越多的机构加入到临床试验中,机构如何履行好自身责任、提升质量管理能力、缩小与其他机构的差距是值得思考的重要问题。此次问卷调查结果表明被调查机构已意识到开展GCP培训和建立薪酬分配制度对研究人员参与积极性和实施质量的重要性,但机构间建设水平参差不齐,临床试验项目集中在少数机构,部分机构在质量管理中存在薄弱环节:①质量管理专职人员配备不足;②GCP信息化系统应用率不高;③机构与申办方协同配合能力有待增强;④基于风险的质量管理开展率不高;针对以上问题提出以下思考。
3.1增强质量管理专职人员配备 王荣环等[3]分析其所在医院两年内药物临床试验项目的质量控制/检查情况,发现有无专职人员管理对临床试验质量有显著影响,通过实行专人管理可以提高试验质量。本次调查中机构质量管理专职人员集中在1~3名,部分机构一名专职人员需管理几十甚至上百的项目及专业,要全面、无误完成对开展项目的检查、跟踪、整改,专职人员面临较大压力。机构应根据需求增加质量管理专职岗位,明确质控员的配置要求与工作内容,使质控专职人员充分发挥在临床试验质量中的作用。
3.2建设信息化平台,协助质控 随着临床试验数量与复杂性的增加,传统手工、纸质的记录模式将不能满足临床试验的要求,在2020年发布的《药物临床试验质量管理规范》[4]中多次提到电子文件,并推荐使用信息化的系统,建立信息化系统是大势所趋。信息化系统不仅可以缩短项目立项时间、保障药品安全发放,还可以实现项目管理、试验实施过程管理,提升质控人员工作效率。中国医科大学附属盛京医院基于医院信息化系统建立了包含多个功能模块、满足从项目立项到项目结束归档全过程的信息化系统,其中搭载的质量管理模块可设置质控时间间隔并发送质控提醒短信,研究者可在线查看质控报告,质控人员也可根据研究者回复进行更有针对性的复核[5]。各机构应根据自身情况与政策指导加快建立信息化平台,逐步实现包括机构管理、项目管理的全方面、全流程电子化、信息化,这也是为能今后采取数字化、智能化手段辅助质量控制打下基础。
3.3机构与申办方建立通畅的沟通渠道 临床试验质量与试验各方息息相关,机构作为负有监管责任的一方与申办者作为主要责任方在临床试验过程中所承担的任务虽有差异,但是都有保护受试者安全和保证试验数据真实、可靠的共同目标。机构的质控与申办方的监查、稽查都是临床试验质量控制的重要手段,作为质量管理中联系紧密的两方应清楚在试验过程中自身的定位,各司其职的同时相互配合,建立质量管理的沟通反馈机制,对于彼此间开展的质量管理活动及发现的质量问题需要建立沟通渠道,两方能有负责人及时对接,打破两者间存在的壁垒,对质量监管达成一致,将两者间的资源整合发挥最大作用。
3.4建立机构区域联盟 通过构建药物临床试验机构区域联盟实现“由强带弱”,缓解机构间承接数量差异大、建设水平参差不齐的问题。如经济圈以特大或辐射带动能力强的大城市为核心的多个城市集合一样,机构区域联盟可以承接体量大、开展时间长、制度体系完善的机构为中心,整合区域内的临床研究力量,增加机构间的交流,带动各机构探索解决临床试验各环节问题,最终实现临床试验质量、效率的提升。郭薇等[6]通过调研重庆市机构现状,也提出搭建区域化药物临床试验机构体系,以期提升机构能力。
3.5推进基于风险的质量管理建设,接轨国际质量管理标准 基于风险的质量管理可以整合有限的管理资源集中与受试者安全、数据质量、GCP合规性相关的关键环节,而不是进行无差别的质量管理,防止质控人员时间浪费在不必要的活动上,且不能提高受试者的安全性或者数据质量[7]。基于风险的质量管理作为近年来临床试验质量管理的研究方向之一,申办方通过实践已表明其可以提高质量管理效率、提升试验关键数据质量[8-9]。虽然目前法规只对申办方要求进行基于风险的质量管理,但这种方法依然适用于机构。目前,程晓华等[7]、黄一玲等[10]、夏侠等[11]均在所在机构质量管理体系中融入风险管理,对机构管理临床试验中的风险点进行识别、分析、评价并设置预防控制措施以减少风险的发生。程晓华等[7]还将风险管理环节与信息化系统结合,在信息化系统中设置基于风险的质控计划、风险提醒,提高了质量管理效率。基于风险的质量管理有别于如今的事后审查、弥补的质量管理方式,注重事前预防、事中监管。因此,从机构视角出发,参考申办方经验、国内外文献再结合自身管理经验,建立与机构运行管理适配的风险管理可助力高效、高质的质量管理。
国际人用药品注册技术协调会在2016年发布的ICH E6 R2中推荐质量管理应采用基于风险的方法[12],且这一理念自提出后已经在美国、欧洲、韩国等国家及地区得到推广与应用,国外的监管机构、CRO、软件供应商开发出了多种可用于申办方开展基于风险的质量管理工具[13]。我国是ICH的成员国之一,国内的药监部门、制药产业和研究机构也应逐步转化和实施国际最高规则体系。因此,借鉴国际基于风险的质量管理理念和方法,建立药物临床试验机构临床试验风险评估与控制管理体系,接轨国际质量标准,是增强中国医药的竞争力,是提高机构能参与全球多中心临床试验能力的有效途径。
4 结论
质量管理是机构工作的重点,通过此次调查分析发现了参与机构在质量管理建设中存在质量管理专职人员配备不足、GCP信息化系统应用率不高、机构与申办方协同配合能力不强、风险管理开展率不高等问题并提出了相应的改进措施,但参与调查的机构数量有限,结果存在一定的局限性,希望本项调查能为药物临床试验机构质量管理的建设和发展提供一些基本数据和思路。

