外膜蛋白OmpA在蛙源米尔伊丽莎白菌致病性中的功能


摘要 为探究外膜蛋白A(outer membrane protein A,OmpA)对米尔伊丽莎白菌致病作用的影响,以蛙源米尔伊丽莎白菌FL160902 为研究对象,通过同源重组法构建OmpA 缺失株△ompA,比较缺失株和野生株的生长特性、生物膜形成能力、抗血清杀伤能力、对细胞的黏附能力以及对蛙的致病性差异。结果显示:△ompA的生长能力和抗血清杀伤能力与野生株无显著差异;但与野生株相比,△ompA 的生物膜形成能力增加了66%,△ompA 对bEnd.3 细胞的黏附能力降低了61%;黑斑蛙感染试验显示,△ompA 在黑斑蛙血液、脾和脑组织中的载菌量分别为(3.15×108±0.09×108)、(2.11×108±0.07×108)和(6.61×108±0.16×108) copies/g,均显著低于野生株,且△ompA 对黑斑蛙的致死率为37%,显著低于野生株的致死率(75%)。上述结果表明,ompA 基因缺失不改变米尔伊丽莎白菌的抗血清杀伤能力,但增加了菌株的生物膜形成能力,减弱了菌株的黏附能力,从而降低了该菌对蛙的致病性。
关键词 米尔伊丽莎白菌; 基因缺失; 外膜蛋白A; 致病性
中图分类号 S941.42 文献标识码 A 文章编号 1000-2421(2024)01-0203-07
牛蛙(Rana catesbeiana)、棘胸蛙(Quasipaa spi⁃nosa)、黑斑蛙(Pelophylax nigromaculata)等蛙类在我国分布比较广泛,因其肉质鲜美、营养丰富、经济价值高,我国于20 世纪80 年代开始了人工养殖[1-2]。经过40 多年的发展,蛙类的养殖模式和养殖技术逐渐成熟,蛙类饲料已经专业化[3]。近年来,牛蛙和黑斑蛙养殖在我国长江以南地区呈现集约化、规划化、智慧化,养殖密度和产量均较高。据不完全统计,2021 年,我国蛙类年产量为17.5 万t,总产值超过千亿,不仅为人们提供了优质蛋白,还有力促进了农村经济发展[4]。然而,蛙类养殖业在快速发展的过程中,其病害问题十分严重,尤其在成蛙养殖时,“歪头病”已经成为制约产业健康发展的瓶颈因素[5-6]。“歪头病”是蛙类脑膜炎败血症的俗称,其病原是米尔伊丽莎白菌(Elizabethkingia miricola)[7]。
米尔伊丽莎白菌是一种革兰氏阴性短杆菌,隶属于黄杆菌目(Flavobacteriales)、威克斯氏菌科(Weeksellaceae)、伊丽莎白菌属(Elizabethkingia)[8],该菌可感染蛙的脑组织,造成神经损伤[9-10]。目前,米尔伊丽莎白菌对蛙的致病机制尚不清楚,挖掘该菌重要的毒力因子,解析其关键致病功能,对蛙类“歪头病”的防控及健康养殖具有重要意义。有学者从该菌的基因组序列中预测到了一些毒力因子,包括外膜蛋白、荚膜多糖、分泌系统蛋白和调控相关因子等[11],但这些毒力因子在该菌中的功能尚未得到验证。外膜蛋白A(outer membrane protein A, OmpA)是革兰氏阴性菌外膜蛋白的重要组成成分,参与维持细菌结构的完整性[12],在细菌致病性方面发挥着重要的作用[13]。研究发现,禽致病性大肠杆菌(avain pathogenic Escherichia coli)的OmpA 缺失后,菌株对脑微血管内皮细胞的黏附和侵袭能力分别下降了约37% 和43%,且在宿主脑组织中的定殖能力下降了67%,由此可见,OmpA 影响细菌对宿主的黏附和侵袭能力,进而影响其致病力[14]。鲍曼不动杆菌(Acinetobacter baumannii)的OmpA 能与宿主的补体调节因子H 结合,阻断宿主补体系统的旁路途径,细菌逃避宿主的免疫杀伤并在体内大量繁殖,进而引发感染[15]。目前,OmpA 在米尔伊丽莎白菌致病过程中的功能尚不清楚。本研究以蛙源米尔伊丽莎白菌FL160902 为研究对象,利用同源重组法构建OmpA 缺失株△ompA,分析△ompA 的生物学特性及致病性,以期明确OmpA 在米尔伊丽莎白菌致病性中的功能,为解析米尔伊丽莎白菌的致病机制奠定基础,也为蛙类“歪头病”防控药物和弱毒疫苗的研发提供理论依据。
1 材料与方法
1.1 菌株、质粒及细胞系
米尔伊丽莎白菌FL160902 株为本研究所用野生型菌株(wild type strain,WT)[9],由笔者所在实验室保存。大肠杆菌S17-1 λpir 感受态细胞购自唯地生物公司。自杀质粒pRE112 由中国科学院水生生物研究所谢海侠研究员惠赠,质粒pSAM-Spc-Amp-RpsLpro 由华中农业大学周祖涛副教授惠赠。小鼠脑微血管内皮细胞bEnd.3 细胞系由笔者所在实验室保存并传代。
1.2 试剂和引物
细菌基因组DNA 提取试剂盒、质粒中提试剂盒购自康为世纪生物科技有限公司;PCR 产物回收试剂盒购自美国Omage 公司;2×A8 FastHiFi PCRMasterMix 购自北京艾德莱生物科技有限公司;限制性内切酶SacⅠ、XbaⅠ和DNA marker 均购自宝生物工程(大连)有限公司;Uniclone One Step SeamlessCloning Kit 购自北京金沙生物科技有限公司;胎牛血清(FBS)和DMEM 培养基购自Gibco 公司;氨苄青霉素(Amp)、壮观霉素(Spc)、氯霉素(Cm),均购自Biosharp 公司;脑心浸液培养基(BHI)购自美国OXOID 公司;琼脂粉购自德国Biofroxx 公司。引物(表1)由武汉擎科生物科技有限公司合成。
1.3 米尔伊丽莎白菌缺失株△ompA的构建
参照文献[16]描述的方法,参考GenBank 中米尔伊丽莎白菌FL160902 株全基因组(NZ_CP040516.1)序列,以米尔伊丽莎白菌FL160902 株基因组DNA 为模板,扩增ompA(gene-3180)基因左右同源臂,以质粒pSAM-Spc-Amp-RpsLpro 为模板,扩增壮观霉素基因(Spc)片段,扩增引物如表1。将ompA 基因左右同源臂和壮观霉素基因片段连接到自杀质粒pRE112,转化到大肠杆菌S17-1 λpir。将含有重组质粒的大肠杆菌S17-1 λpir 作为供体菌,米尔伊丽莎白菌FL160902 作为受体菌,进行接合转移。具体操作如下:将供体菌和受体菌分别培养至对数生长期,两者混合后用10 mmol/L MgSO4洗涤3次,将混合菌液滴于贴有硝酸纤维素膜的BHI 平板,37 ℃培养18~24 h 后,用BHI 液体培养基洗下膜上的菌苔,涂布于100 μg/mL Spc、100 μg/mL Amp 和34 μg/mL Cm 的BHI 平板,37 ℃培养36~48 h。挑取平板上的单菌落于BHI 液体培养基传代后,涂布于10% 蔗糖的BHI 平板上,37 ℃培养36~48 h,对平板上的菌落进行PCR 验证。
1.4 野生株与△ompA生长能力的测定
将野生株和△ompA 接种于BHI 液体培养基中,37 ℃ 200 r/min 震荡培养过夜,调整各菌液OD600 为0.8 左右,菌液以1∶100 接种至BHI 液体培养基,涡旋混匀细菌悬浮液,取200 μL 细菌悬浮液加入到灭菌的96 孔板中,用微生物生长曲线全自动检测系统FLUOstar Omega 测定,设置程序:温度37 ℃,连续振荡,每1 h 测定1 次OD600,连续培养24 h。每个样品3个平行,试验独立重复3 次。
1.5 野生株与△ompA生物被膜形成能力的测定
参照文献[17]描述的方法,将野生株和△ompA分别接种于BHI 液体培养基中,37 ℃ 200 r/min 震荡培养过夜,调整各菌液OD600 为1.0 左右。菌液分别按1∶100 接种于BHI 液体培养基,吸取200 μL 细菌悬浮液加入96 孔细胞培养板,置于37 ℃恒温培养箱中培养48 h。将孔内菌液吸弃,用无菌PBS 洗涤3次,0.5% 结晶紫溶液常温染色30 min,再用无菌PBS洗涤3 次,常温下风干,最后每孔加入100 μL 95% 乙醇,用多功能酶标仪测定OD590。每个样品5 个平行,重复3 次。
1.6 野生株与△ompA抗血清杀伤能力的测定
参照文献[18]描述的方法,从健康蛙心脏处采血,血液在4 ℃条件下静置过夜后离心取血清,过0.22 μm 滤膜除菌,即为正常血清(nornal serum,NS)。取NS 置于56 ℃水浴30 min 以灭活补体,即为灭活血清(heat-inactived serum,HS)。调整野生株和△ ompA 菌液浓度为1×108 CFU/mL,分别取100μL NS 和HS 加入到1.5 mL 离心管中,加入100 μL菌液后混匀,使血清体积分数为50%,将混合物置于37 ℃培养箱静置培养1 h 后置于冰上10 min 终止反应,用无菌PBS 倍比稀释混合物,将稀释液涂布于BHI 平板,37 ℃培养过夜后记录菌落数。存活率=NS 中存活的菌落数/HS 中存活的菌落数×100%,试验重复3 次。
1.7 野生株与△ompA对细胞的黏附试验
参照文献[19]描述的方法,将小鼠脑微血管内皮细胞bEnd.3 于37 ℃、5% CO2 的细胞培养箱中培养至细胞长势良好且大致铺满6 孔细胞培养板,用无抗生素的DMEM 洗涤bEnd.3 细胞3 次后待用。调节野生株和△ompA 浓度为1×108 CFU/mL,取100μL 各菌液和PBS(作为阴性对照)分别加入6 孔细胞培养板中,37 ℃条件下孵育1.5 h,用无菌的PBS 清洗3~4 次,每孔加入1 mL 1% Triton X-100 裂解细胞,裂解30 min 后,将细胞裂解物10 倍倍比稀释后涂平板,37 ℃培养24~36 h,之后进行菌落计数。每个样品设置2 个平行孔,试验重复3 次。
1.8 黑斑蛙人工感染试验
试验所用黑斑蛙购自湖北省潜江市黑斑蛙养殖基地,黑斑蛙个体质量为(30±0.5) g,暂养于华中农业大学淡水水产健康养殖湖北省协同创新中心。暂养1 周后开始人工感染试验,用野生株和△ompA 感染黑斑蛙后,分别测定黑斑蛙的组织载菌量和存活率。组织载菌量测定试验共3 组,分别为野生株组、△ompA 组和对照组PBS 组,每组15 只蛙,攻毒途径为下肢肌肉注射,攻毒所用各菌液浓度均为1×108CFU/mL,剂量为200 μL。攻毒5 d 后,每组随机抽取3 只发病蛙,在无菌条件下进行解剖,从心脏处抽取血液,并称量相同质量的脾脏和脑组织,将血液和各组织按照试剂盒进行组织基因组DNA 提取,以提取的各组织基因组DNA 为模板,按照笔者所在实验室前期建立的米尔伊丽莎白菌RT-qPCR 定量检测方法进行计数[20],所有样本进行3 次重复。黑斑蛙存活率测定试验同样分为3 组(野生株组、△ompA组、PBS 组),感染方法同上,感染后持续观察14 d,记录每天蛙死亡的数据。
1.9 数据分析
试验数据均表示为平均值± 标准差(mean±SD),采用GraphPad Prism 软件对数据进行处理,利用t 检验进行统计学分析,Plt;0.05 表示有显著差异。
2 结果与分析
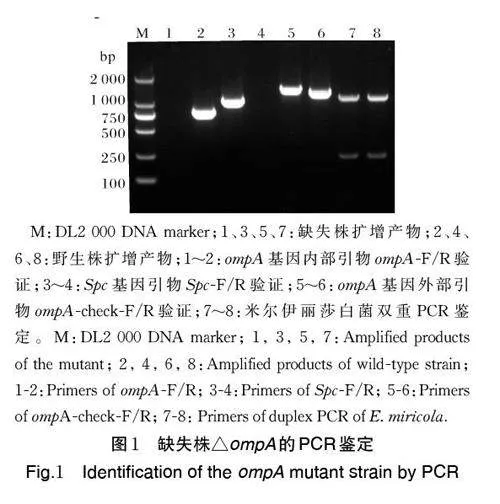
2.1 米尔伊丽莎白菌缺失株△ompA的构建与验证
如图1 所示,对△ompA 进行PCR 鉴定,用ompA基因内部引物(ompA-F/R)进行PCR 扩增,△ompA无法获得扩增产物,野生株获得约800 bp 产物;用Spc 基因引物(Spc-F/R)进行PCR 扩增,△ompA 获得约1 200 bp 产物,野生株无法获得扩增产物;用ompA 基因外部引物(ompA-check-F/R)进行PCR 扩增,△ompA 获得的扩增产物与野生株相差约300bp;用双重PCR 引物ureG-F/R、PNGase F-F/R 进行扩增,△ompA 获得约250 和1 200 bp 产物,野生株为阳性对照,证明△ompA 为米尔伊丽莎白菌,上述PCR 产物测序结果正确。将△ompA 在BHI 平板上连续传10 代,用上述引物对每代缺失株进行PCR鉴定,未发现回复突变。上述结果表明,缺失株△ompA 构建成功。
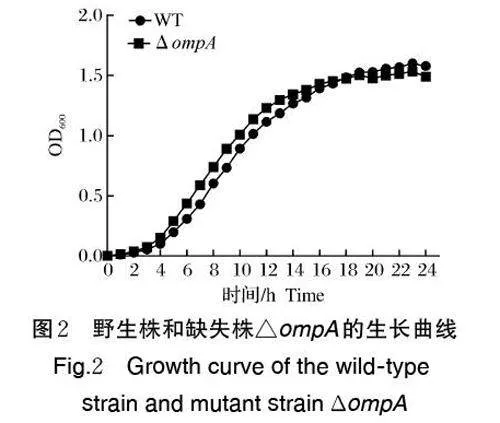
2.2 ompA基因缺失对菌株生长能力的影响
如图2 所示,在37 ℃条件下,野生株和△ompA均在6 h 左右进入对数生长期,17 h 左右进入生长稳定期,△ompA 的生长速度与野生株相比无显著差异(Pgt;0.05),表明ompA 基因缺失不改变米尔伊丽莎白菌的生长能力。
2.3 ompA 基因缺失对菌株生物膜形成能力的影响
通过结晶紫染色法测定米尔伊丽莎白菌生物膜的形成量,OD 值代表乙醇脱色液的吸光值,OD 值越高,表明被结晶紫染色的生物膜含量越高。由图3 可见,在48 h 时,野生株组的OD590 值为0.215±0.001,△ompA 组的OD590值为0.638±0.038,△ompA 的生物膜形成能力较野生株增加了66%,表明OmpA 参与负调控米尔伊丽莎白菌生物膜的形成。
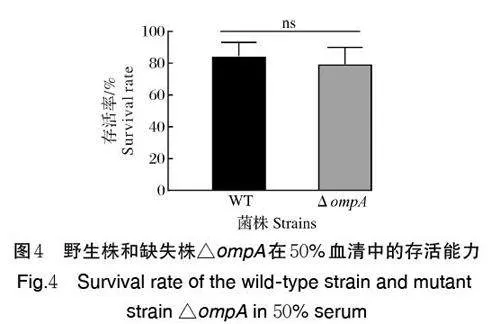
2.4 ompA 基因缺失对菌株抗血清杀伤能力的影响
如图4 所示,在50% 的血清中作用后,野生株的存活率为(84.52±4.95)% ,△ ompA 的存活率为(79.55±6.01)%,△ompA 的存活率略低于与野生株,但无显著差异(Pgt;0.05),表明ompA 基因缺失不改变米尔伊丽莎白菌的抗血清杀伤能力。
2.5 ompA基因缺失对菌株细胞黏附作用的影响
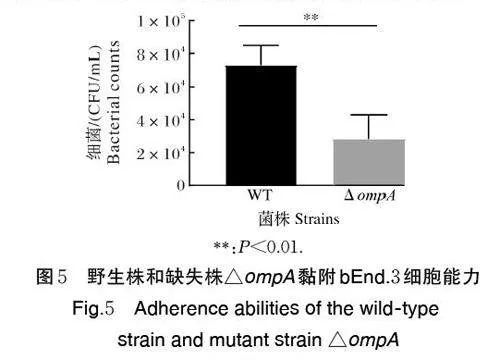
如图5 所示,黏附bEnd.3 细胞的野生株和△om⁃pA 的浓度分别为(7.33×104±0.67×104)、(2.83×104±0.60×104) CFU/mL,△ ompA 黏附bEnd.3 细胞能力较野生株下降了61%,表明ompA 基因缺失导致米尔伊丽莎白菌对细胞的黏附能力显著下降。
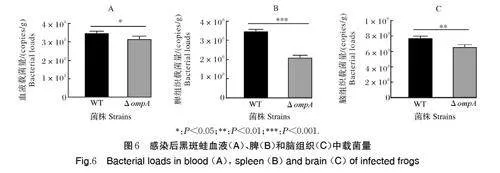
2.6 ompA基因缺失对菌株致病力的影响
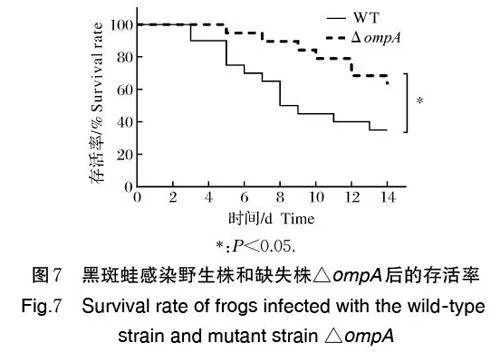
用野生株和△ompA 感染黑斑蛙,检测黑斑蛙的组织载菌量和存活率。结果如图6 所示,感染5 d 后,野生株在黑斑蛙血液、脾和脑组织中的载菌量分别为(3.47×108±0.06×108)、(3.47×108±0.06×108)和(7.72×108±0.14×108) copies/g,△ompA 在黑斑蛙血液、脾和脑组织中的载菌量分别为(3.15×108±0.09×108)、(2.11×108±0.07×108)和(6.61×108±0.16×108) copies/g,△ompA 在黑斑蛙上述各组织中的载菌量较野生株显著下降(Plt;0.05)。如图7 所示,感染14 d 后,野生株和△ompA 对黑斑蛙的致死率分别为75% 和37%。上述结果表明ompA 基因缺失降低了米尔伊丽莎白菌在黑斑蛙组织中的定殖能力,且△ompA 对黑斑蛙的致病力显著减弱。
3 讨论
本研究成功构建了蛙源米尔伊丽莎白菌OmpA缺失株△ompA,并基于此初步探究了OmpA 在米尔伊丽莎白菌致病性中的功能。我们发现OmpA 不影响米尔伊丽莎白菌的生长特性,排除菌株生长特性差异对后续OmpA 致病功能研究结果的影响。
米尔伊丽莎白菌能形成生物膜,附着在基质的表面,帮助细菌抵抗抗菌药物和宿主免疫杀伤,是该菌存活力和致病性的重要体现[21-22]。然而,目前调控该菌生物膜形成的机制尚不清楚。本研究中,我们发现ompA 基因缺失导致米尔伊丽莎白菌生物膜形成能力增加了66%,这表明OmpA 负调控该菌的生物膜形成,这与大肠杆菌中OmpA 增加菌株生物膜形成能力的结果相反[23]。我们推测米尔伊丽莎白菌的OmpA 可能直接调控该菌生物膜形成相关基因,也有可能通过某种调控系统间接调控该菌生物膜的形成,其具体的调控机制有待进一步研究。
米尔伊丽莎白菌黏附宿主细胞是引发感染的第一步,也是该菌定殖机体,从而发挥其致病作用的前提[24]。研究证实,在细菌感染早期,OmpA 能协助细菌通过不同的受体黏附于宿主细胞[13],如大肠杆菌的OmpA 通过结合宿主脑微血管内皮细胞的受体Ecgp,介导细菌的黏附作用[25]。本研究中,我们利用小鼠脑微血管内皮细胞bEnd.3 评价OmpA 对于米尔伊丽莎白菌黏附能力的影响,结果显示,ompA 基因缺失导致菌株对细胞的黏附能力下降了61%。目前,OmpA 参与调控米尔伊丽莎白菌黏附能力的机制还未知,我们推测,该菌的OmpA 可能作为一种潜在的黏附因子,靶向宿主细胞特定的受体蛋白,协助细菌黏附宿主细胞,进而引发感染。
我们通过黑斑蛙感染模型进一步评估了OmpA对米尔伊丽莎白菌致病力的影响。结果显示,野生株和△ompA 感染黑斑蛙后,△ompA 在黑斑蛙血液、脾、脑组织中的载菌量较野生株显著下降,且△ompA 对黑斑蛙的致死率显著低于野生株,这表明在米尔伊丽莎白菌致病过程中,ompA 基因缺失降低了该菌在宿主体内的定殖能力,导致该菌致病性减弱。本研究结果与副溶血弧菌中OmpA 的研究结果类似,在副溶血弧菌中,ompA 基因缺失株在小鼠各脏器中的定殖能力下降,且对小鼠的致死率显著降低[26]。然而,目前尚无稳定的伊丽莎白菌基因回补体系,无法验证OmpA 的致病调控作用,对OmpA 致病调控机制的研究还需进一步挖掘和验证。
综上,本研究初步探究了OmpA 在米尔伊丽莎白菌致病性中的功能,发现OmpA 负调控米尔伊丽莎白菌的生物膜形成,不改变细菌的抗血清杀伤能力,但是参与调控了细菌的黏附能力,影响了其致病性,表明OmpA 为米尔伊丽莎白菌重要的毒力因子,这是目前该菌中首个被验证的毒力因子,本研究结果可为米尔伊丽莎白菌致病机制的研究及“歪头病”防控策略的制定提供新的思路。
参考文献References
[1] 蓝蔚青,杜金涛,刘大勇,等.3 种养殖蛙类肌肉基本营养成分
分析[J]. 广东海洋大学学报,2022,42(2):142-147.LAN W
Q,DU J T,LIU D Y,et al.Analysis of the basic nutrient composition
of muscle in three species of cultured frogs[J].Journal
of Guangdong Ocean University,2022,42(2):142-147 (in
Chinese with English abstract).
[2] 刘焕亮. 中国养殖的两栖动物生物学研究进展[J]. 大连水产
学院学报,2004,19(2):120-125.LIU H L.The advancement
of biological research in amphibian culture in China[J].Journal
of Dalian Fisheries University,2004,19(2):120-125 (in Chinese
with English abstract).
[3] 李兴华,涂军明,陈展鹏,等. 稻蛙绿色种养模式研究及其可
持续发展策略[J]. 农学学报,2020,10(12):98-103.LI X H,
TU J M,CHEN Z P,et al.Rice-frog planting and raising mode
and its sustainable development strategy[J].Journal of agriculture,
2020,10(12):98-103( in Chinese with English abstract).
[4] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水
产学会.中国渔业统计年鉴-2022[M].北京:中国农业出版社,
2022. Bureau of Fisheries, Ministry of Agriculture and Rural
Affairs, National Fisheries Technology Extension Center,
China Society of Fisheries. China fishery statistical yearbook
[M].Beijing:China Agriculture Press,2022( in Chinese).
[5] 李巧玲,吴新仪,姜维,等. 蛙类病害与防治研究进展[J]. 丽
水学院学报,2018,40(5):7-11.LI Q L,WU X Y,JIANG W,
et al. Research progress of frog diseases and their control[J].
Journal of Lishui University,2018,40(5):7-11 (in Chinese
with English abstract).
[6] TRIMPERT J,EICHHORN I,VLADIMIROVA D,et al.
Elizabethkingia miricola infection in multiple anuran species
[J]. Transboundary and emerging diseases,2021,68(2):
931-940.
[7] 胡瑞雪. 蛙源伊丽莎白菌的鉴定、分子流行病学及其碳青霉
烯酶多样性研究 [D]. 武汉:华中农业大学,2020.HU R X.
Identification, molecular epidemiology and diversity of carbapenemases
in Elizabethkingia sp. from frog[D]. Wuhan:Huazhong
Agricultural University,2020 (in Chinese with English
abstract).
[8] NICHOLSON A C,GULVIK C A,WHITNEY A M,et al.
Revisiting the taxonomy of the genus Elizabethkingia using
whole-genome sequencing,optical mapping,and MALDITOF,
along with proposal of three novel Elizabethkingia species:
Elizabethkingia bruuniana sp.nov,Elizabethkingia ursin⁃
gii sp. nov,and Elizabethkingia occulta sp. nov.[J]. Antonie
van leeuwenhoek,2018,111(1):55-72.
[9] HU R X,YUAN J F,MENG Y,et al.Pathogenic Elizabeth⁃
kingia miricola infection in cultured black-spotted frogs,China,
2016[J]. Emerging infectious diseases,2017,23(12):
2055-2059.
[10] HUANG X L,FENG Y,TANG H,et al. Candidate animal
disease model of Elizabethkingia spp. infection in humans,
based on the systematic pathology and oxidative damage
caused by E. miricola in Pelophylax nigromaculatus[J/OL].
Oxidative medicine and cellular longevity,2019,2019:
6407524[2022-11-22]. https://pubmed. ncbi. nlm. nih. gov/
31641424/.DOI: 10.1155/2019/6407524.
[11] LIANG C Y,YANG C H,LAI C H, et al.Comparative genomics
of 86 whole-genome sequences in the six species of the
Elizabethkingia genus reveals intraspecific and interspecific divergence
[J/OL].Scientific reports,2019,9:19167[2022-11-
22].https://doi.org/10.1038/s41598-019-55795-3.
[12] SMITH S G J,MAHON V,LAMBERT M A,et al.A molecular
Swiss army knife:OmpA structure,function and expression
[J].FEMS microbiology letters,2007,273(1):1-11.
[13] CONFER A W,AYALEW S.The OmpA family of proteins:
roles in bacterial pathogenesis and immunity[J].Veterinary microbiology,
2013,163(3/4):207-222.
[14] 许姝. 禽致脑膜炎型大肠杆菌外膜蛋白OmpA 突破血脑屏障
致病机制的研究[D]. 扬州:扬州大学,2020.XU S.Pathogenic
mechanism of OmpA from avian pathogenic Escherichia co⁃
li for blood-brain barrier breakthrough[D]. Yangzhou:Yangzhou
University,2020( in Chinese with English abstract).
[15] KIM S W,CHOI C H,MOON D C,et al.Serum resistance of
Acinetobacter baumannii through the binding of factor H to
outer membrane proteins[J]. FEMS microbiology letters,
2009,301(2):224-231.
[16] 周小进. 鸭疫里默氏杆菌特异性单克隆抗体的研制以及生物
被膜和OmpA 缺失株的研究[D]. 扬州:扬州大学,2010.
ZHOU X J.Preparation of monoclonal antibody against Rieme⁃
rella anatipestifer and the study of bacterial biofilm and OmpA
gene deletion[D]. Yangzhou:Yangzhou University,2010 (in
Chinese with English abstract).
[17] PUAH S M,FONG S P,KEE B P,et al.Molecular identification
and biofilm-forming ability of Elizabethkingia species[J/
OL]. Microbial pathogenesis,2022,162:105345[2022-11-
22] .https://doi.org/10.1016/j.micpath.2021.105345.
[18] 王湘如. 副猪嗜血杆菌毒力因子筛选和capD 基因功能研究
及致脑膜炎大肠杆菌突破血脑屏障的分子机制研究[D]. 武
汉:华中农业大学,2014.WANG X R.Identification of the putative
virulence factors and functional study of the capD gene
in Haemophilus parasuis,and the molecular mechanism study
of meningitis-causing Escherichia coli penetration of the blood
brain barrier[D]. Wuhan:Huazhong Agricultural University,
2014( in Chinese with English abstract).
[19] HU Q H,HAN X G,ZHOU X J,et al.OmpA is a virulence
factor of Riemerella anatipestifer[J].Veterinary microbiology,
2011,150(3/4):278-283.
[20] 张琦. 米尔伊丽莎白菌快速分子检测方法的建立与应用[D].
武汉:华中农业大学,2020.ZHANG Q.Establishment and application
of rapid molecular diagnostic method for detecting
Elizabethkingia miricola[D]. Wuhan:Huazhong Agricultural
University,2020( in Chinese with English abstract).
[21] BELAS R. Biofilms,flagella,and mechanosensing of surfaces
by bacteria[J].Trends in microbiology,2014,22(9):517-527.
[22] HU S H,LÜ Y,XU H,et al.Biofilm formation and antibiotic
sensitivity in Elizabethkingia anophelis[J/OL]. Frontiers in
cellular and infection microbiology,2022,12:953780[2022-
11-22].https://doi.org/10.3389/fcimb.2022.953780.
[23] MA Q,WOOD T K. OmpA influences Escherichia coli biofilm
formation by repressing cellulose production through the
CpxRA two-component system[J].Environmental microbiology,
2009,11(10):2735-2746.
[24] RIBET D,COSSART P. How bacterial pathogens colonize
their hosts and invade deeper tissues[J]. Microbes and infection,
2015,17(3):173-183.
[25] PRASADARAO N V.Identification of Escherichia coli outer
membrane protein A receptor on human brain microvascular
endothelial cells[J]. Infection and immunity,2002,70(8):
4556-4563.
[26] 白雪瑞,王权,陈永军,等. 副溶血弧菌ompA 基因缺失株的
生物学特性及致病性分析[J]. 南京农业大学学报,2018,41
(5):902-910.BAI X R,WANG Q,CHEN Y J,et al.Biological
characteristics and pathogenicity of an ompA mutant of
Vibrio parahaemolyticus[J]. Journal of Nanjing Agricultural
University,2018,41(5):902-910( in Chinese with English abstract).
(责任编辑:边书京)

