核酸酶基因LoENDONUCLEASE 1 在东方百合花朵衰老过程中的功能分析



摘要 为明确百合(Lilium spp.)花朵衰老发生的分子机制,在东方百合‘西伯利亚’(Lilium oriental hybrid‘Siberia’)花被片中克隆了一个衰老相关基因LoENDONUCLEASE 1(SAG10),利用qRT-PCR 进行基因表达分析,并通过农杆菌介导的拟南芥稳定表达系统和百合花被片瞬时表达体系验证LoENDONUCLEASE 1 基因功能。结果显示,LoENDONUCLEASE 1 基因开放阅读框(ORF)为921 bp,编码306 个氨基酸;LoENDONU⁃CLEASE 1 在百合花朵和叶片的衰老过程中特异表达,且受到脱落酸和水杨酸的诱导;拟南芥过表达LoENDO⁃NUCLEASE 1 株系中叶片叶绿素含量显著低于对照株系,百合花被片中瞬时过表达LoENDONUCLEASE 1基因加速了百合花被片的衰老,且过表达花被片中丙二醛和离子渗透率含量显著高于对照。结果表明,LoEN⁃DONUCLEASE 1 具有促进花朵和叶片衰老的功能。
关键词 百合; 鲜切花; 花朵衰老; 衰老相关基因; 核酸酶; 过表达
中图分类号 S682.2 文献标识码 A 文章编号 1000-2421(2024)01-0157-09
百合(Lilium spp.)为百合科(Liliaceae)百合属(Lilium)球根花卉,具有很高的观赏价值和商业价值,在全球鲜切花市场中占有非常重要的地位[1]。鲜切花是中国重要的特色园艺产品,其中云南省鲜切花种植面积全球第一,交易量全球第二,占全国70%以上的市场份额,而大部分的鲜切花销售主要集中在沿海发达城市[2]。目前产销两地分离的现状导致鲜切花贸易面临长时间、远距离运输的难题[3]。在我国鲜切花卉生产中,百合切花所占比例越来越高,每年以20% 的增长幅度快速发展[4]。但百合切花不耐贮运,受现有保鲜技术的制约,百合切花采收后衰老进程快速发生,严重影响了百合的瓶插寿命与切花观赏品质,据统计百合切花采后流通、储藏环节造成的经济损失高达40%[5-6]。因此,延缓鲜切花的衰老,延长观赏期,对于提高鲜切花观赏品质和经济价值具有重要意义。
花朵的衰老主要表现为花瓣的萎蔫、脱落和褪色,是一个不可逆但可以调节的过程[7-9]。花瓣衰老通常被归类为程序性细胞死亡(programmed celldeath, PCD),这一过程中,植物细胞逐渐走向解体,大分子物质被降解成小分子,并运输到其他部位维持种子和幼叶等其他器官的正常生长。研究表明,花朵衰老进程受到自身发育信号、授粉、激素和环境信号等多方面的影响[9-10],衰老信号进一步向下游传递,最终引起核酸酶、脂肪酶和蛋白酶等介导的生物大分子降解[11]。
在衰老过程中,有一类和衰老过程密切相关的基因,统称为衰老相关基因(senescence-associatedgenes, SAGs)[12],这一概念最早由华人学者甘苏生提出[13]。SAG 是一类基因的统称,包括NAC、WRKY、MYB 等转录因子、PP2C 磷酸酶、蛋白酶、核酸酶等。其中,核酸酶是一类可分解核酸的蛋白,根据核酸酶作用的位置不同,可将核酸酶分为核酸外切酶(exonuclease)和核酸内切酶(endonuclease),外切酶从5′或3′末端切割核酸序列,而内切酶从中间将链断开,部分核酸酶同时具有外切酶和内切酶活性[14]。核酸酶作用的底物包括双链DNA(dsDNA)、单链DNA(ssDNA)和RNA 等不同类型,部分核酸酶具有底物专一性,也有部分核酸酶可以同时作用于ssDNA 和RNA[15]。已有研究表明,核酸酶在植物衰老过程中发挥了重要作用。在模式植物拟南芥(Arabidopsis thaliana)中,随着衰老的进行,BI⁃FUNCTIONAL NUCLEASE1(BFN1)、RIBONU⁃CLEASE3 (RNS3) 和CALCIUM-DEPENDENTNUCLEASE1(CAN1)等核酸酶基因的表达被显著诱导[16]。在观赏植物中,萱草(Hemerocallis hyb⁃rida)核酸酶基因DSA6 和香石竹(Dianthus caryo⁃phyllus)核酸酶基因DcNUC1 的表达也都随着花朵的衰老而上调[17-18]。矮牵牛(Petunia hybrida)的研究发现核酸酶PhNUC1 的活性和花朵衰老过程中核酸的降解具有较高的相关性[19]。然而控制百合花朵衰老的关键核酸酶基因及其作用机制尚不明确。
笔者所在课题组前期研究发现3 个核酸酶基因SAG3、SAG10(LoENDONUCLEASE 1)和SAG11在百合花朵和叶片衰老过程中表达水平显著上升,其中LoENDONUCLEASE 1 的差异表达变化最为显著[20]。在此基础上,本研究检测了ABA 和SA 处理下LoENDONUCLEASE 1 基因的表达情况,构建了过表达载体转化拟南芥和百合花被片,以期为明确该基因的功能,了解百合花朵衰老发生机制、开发延缓百合切花衰老的保鲜技术、培育抗衰老的百合新品种提供一定的理论依据。
1 材料与方法
1.1 试验材料
本试验所用新鲜的切花百合品种东方百合‘西伯利亚’购于武汉南湖花木城切花批发市场,1 h 内运至实验室,于水下修剪花枝茎秆至30 cm,去除茎基部的叶子,插入盛有蒸馏水的瓶中,使切花适应实验室内的温、湿度以及气压等环境条件,拟南芥野生型为实验室保存的哥伦比亚生态型Columbia-0。
1.2 脱落酸(ABA)和水杨酸(SA)处理
为明确ABA 和SA 在百合花朵衰老过程中的功能,使用100 mg/L 的ABA 和200 mg/L 的SA 对百合盛开期开放程度一致的百合花朵进行瓶插24 h 处理,清水处理为对照,每个样品3 次生物学重复。取处理后的花被片,液氮速冻后保存于−80 ℃超低温冰箱备用。
1.3 RNA提取和实时荧光定量PCR(qRT-PCR)
使用RNA 提取试剂盒(CW0581M,康为世纪生物科技股份有限公司)提取百合不同开放时期花朵和拟南芥叶片的RNA,使用反转录试剂盒(AE311,北京全式金生物技术有限公司)合成cDNA。以百合LoActin 和拟南芥AtActin 作为内参基因[20],使用荧光定量试剂盒(AQ601,北京全式金生物技术有限公司)和LightCycler 96 荧光定量PCR 仪(Roche, Switzerland)进行LoENDONUCLEASE 1 基因的表达分析。利用2−△△Ct 法进行基因相对表达量的分析计算[21]。
1.4 目的基因ORF扩增和过表达载体构建
参考笔者所在课题组前期已发表的百合转录组数据[20],设计LoENDONUCLEASE 1 ORF 区扩增引物(试验中用到的引物见表1),使用高保真Mix(TSE101,北京擎科生物科技股份有限公司)扩增序列,选取酶切位点SalⅠ和KpnⅠ,通过双酶切和同源重组法构建过表达载体Super1300-LoENDONU⁃CLEASE 1。
1.5 LoENDONUCLEASE 1 系统进化树构建
利用NCBI中的BLASTP在线工具对LoENDONUCLEASE1 的蛋白序列与其他物种进行比对分析,使用MEGA X 软件中的邻接法比对LoENDONUCLEASE1 及其同源蛋白序列,并构建系统进化树。
1.6 拟南芥遗传转化和转基因阳性苗筛选
采用花序浸润法进行拟南芥遗传转化[22-23],抗性筛选获得转基因阳性苗,对T4代转基因植株进行表型观测和生理指标的测定。
1.7 叶绿素含量测定
叶绿素含量测定参照Chen 等[24]的方法。称取拟南芥新鲜叶片约0.2 g,加入2 mL 80% 丙酮萃取,60 ℃恒温水浴加热2 h;以80% 丙酮为空白对照,测定波长663、646 nm 下的吸光值,每个样品3 次生物学重复。
1.8 百合花被片中的瞬时过表达
将Super1300-LoENDONUCLEASE 1 转入农杆菌GV3101,取阳性菌过夜培养后离心集菌,重悬于侵染液中(10 mmol/L 2-吗啉乙磺酸,10 mmol/LMgCl2,20 μmol/L 乙酰丁香酮,pH=5.6),调OD600值至0.8。取盛花期的花被片,使用打孔器制备直径为12 mm 的百合花被片,浸泡在去离子水里备用。采用真空抽吸法侵染‘西伯利亚’百合花朵圆片,强度为0.07 MPa。侵染后将圆片用去离子水洗涤3 次后置于湿润滤纸上,8 ℃暗培养3 d 后取出正常培养(此时记为0 d)。培养条件为:光照强度5 000 lx;光照/黑暗时间10 h/14 h;温度白天23 ℃/夜间20 ℃;相对空气湿度60 %,每隔2 d 拍照记录取样。
1.9 离子渗透率测定
取处理后的花被片0.2 g,浸没于装有20 mL 蒸馏水中,200 r/min,25 ℃摇床培养30 min。在23 ~25 ℃恒温条件下用电导仪(DDSJ-308A)测定浸泡液初始电导率,煮沸冷却后测定总电导率,每个样品3次生物学重复。
计算公式[25]:离子渗透率=初始电导率/总电导率×100%。
1.10 丙二醛(MDA)测定
参考王学奎的硫代巴比妥酸(TBA)法[25],并作适当修改:称取0.2 g(m)新鲜样品研磨至粉末,加入2mL 5% 三氯乙酸(TCA),震荡混匀,用TCA 定容至5 mL,5 000 r/min,4 ℃离心10 min,测量上清提取液体积(V);吸取2 mL(V1)上清提取液,加入3 mL0.5% TBA,混合后煮沸冷却,5 000 r/min,4 ℃离心10 min,测量上清液体积(V2),分别在450、532、600nm 波长下测定吸光值,每个处理3 次生物学重复。
计算公式:CMDA=[(6.45×(A532−A600)−0.56×A450)×V2×V]/(V1×m)。
1.11 数据分析
用Excel 处理数据,GraphPad Prism 8.3.0 绘制图表,应用IBM SPSS Statistics 26 对数据进行差异显著性分析。
2 结果与分析
2.1 百合花朵衰老相关基因SAG的筛选
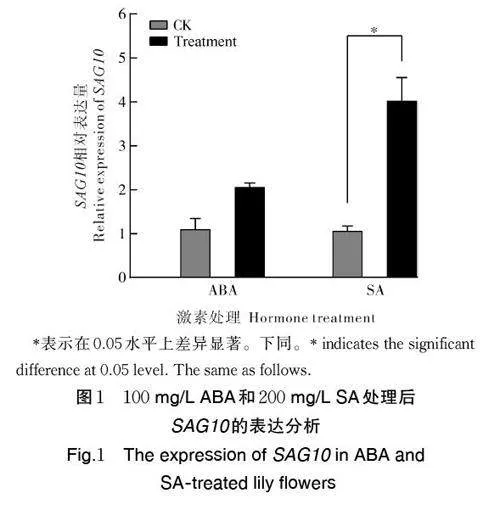
笔者所在课题组前期分析了11 个SAG 基因在百合花朵开放不同时期、根茎叶花不同器官中的表达模式,结果表明SAG10 基因在百合花朵和叶片衰老过程中表达量急剧上升[20]。本研究进一步检测了SAG10 分别在100 mg/L ABA 和200 mg/L SA 处理后的百合花朵中的表达水平变化,结果显示,ABA 和SA 处理均能诱导SAG10 的表达,且SA 处理后SAG10 的表达量显著高于未处理样本(图1)。
2.2 SAG10 基因扩增和进化分析
基于课题组三代转录组测序结果,设计SAG10 ORF 区引物(表1),从百合花被片cDNA中扩增得到SAG10 基因921 bp 的编码区序列。同源蛋白序列的系统进化分析结果如图2 所示,SAG10 蛋白与郁金香(Tulipa gesneriana)衰老相关蛋白6(QGT40635.1)同源性最高,但其他大部分同源蛋白均注释为ENDONUCLEASE 1,因而将SAG10 正式命名为LoENDONUCLEASE 1(WGJ83495.1)。
2.3 LoENDONUCLEASE 1 在拟南芥中过表达分析
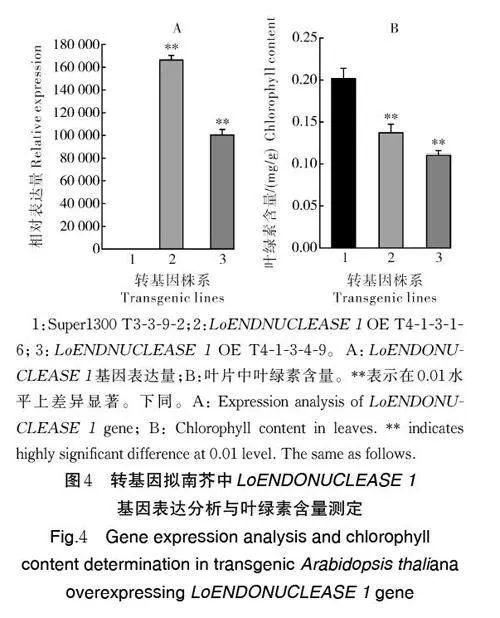
利用同源重组法构建LoENDONUCLEASE 1基因过表达载体,转化农杆菌GV3101,使用花序浸润法将Super1300-LoENDONUCLEASE 1 载体转化拟南芥野生型,经过卡那霉素筛选,获得8 个T1代LoENDONUCLEASE 1 转基因阳性株系(图3A)。进一步自交纯合后,得到T4 代LoENDONUCLE⁃ASE 1 转基因纯系。表型观测结果显示,转基因株系拟南芥的抽薹和开花时间较Super1300 空载株系明显提前,并且叶片呈现明显的黄化(图3B),表明过表达LoENDONUCLEASE 1 基因在一定程度上促进植株的衰老。
利用qRT-PCR 检测异源过表达拟南芥中Lo⁃ENDONUCLEASE 1 基因的表达情况,结果显示,过表达转基因株系中LoENDONUCLEASE 1 基因的表达水平极显著高于对照(图4A)。叶绿素含量测定结果表明,过表达转基因株系中LoENDONU⁃CLEASE 1 的叶绿素含量均极显著低于对照(图4B)。
2.4 LoENDONUCLEASE 1 在百合花被片中的过表达分析
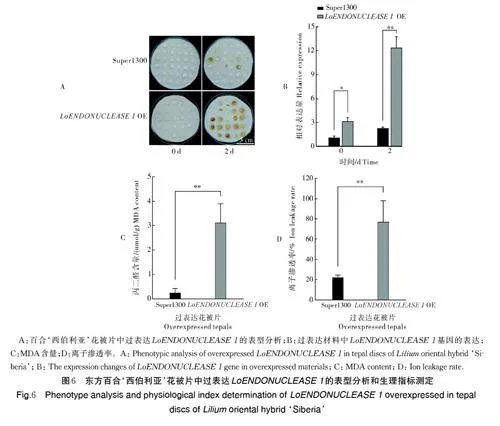
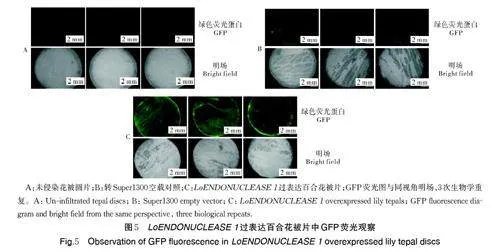
将携带有绿色荧光蛋白(GFP)的LoENDONU⁃CLEASE 1 基因过表达载体瞬时转化百合花被圆片,检测LoENDONUCLEASE 1 基因的表达情况。结果显示(图5),LoENDONUCLEASE 1 过表达的百合花被片中均能观测到明显的荧光点,表明Lo⁃ENDONUCLEASE 1 基因在百合花被片中的瞬时表达效率较高。
百合花被片中瞬时过表达LoENDONUCLE⁃ASE 1 基因的表型结果显示,过表达0 d 时,百合花被片均未出现明显表型变化,2 d 后LoENDONUCLE⁃ASE 1 过表达花被片衰老程度明显加快(图6A)。qRT-PCR 分析结果显示,过表达2 d 时花被片中Lo⁃ENDONUCLEASE 1 的表达量明显高于Super1300对照(图6B)。同时过表达百合花被片中MDA 含量(图6C)和离子渗透率(图6D)极显著高于对照,说明LoENDONUCLEASE 1 过表达花被片中细胞膜系统损伤程度较为严重。
3 讨论
植物衰老是植物细胞受内外因素影响使其植物器官失去细胞分裂能力并逐渐死亡的一个自然过程,通常伴随着营养物质的循环再利用。目前大部分研究集中在叶片的衰老上。例如,植物营养生长期间,在营养缺乏或中度胁迫下,老叶开始衰老,使植物能够利用有限的营养维持幼嫩组织的生长或抵抗环境胁迫[26]。花在被子植物的繁殖中起着至关重要的作用,在生殖生长阶段,授粉完成后,花朵完成其使命,花瓣开始萎蔫或脱落,在衰老前也会将大部分营养物质分解后运输到发育中的组织,维持植株的正常生长[27]。同时,激素信号在花朵衰老过程中发挥了重要作用。乙烯敏感型花卉受乙烯调控后明显促进花朵的衰老,香石竹花朵衰老过程中涉及到乙烯和ABA 的信号交叉[28]。乙烯不敏感花卉中,脱落酸和水杨酸等激素的作用较为显著[9-10],郁金香受SA 诱导的TgNAP 基因双重调节SA 生物合成和ROS 水平,从而加速花朵的衰老[29]。课题组前期研究发现,ABA 和SA 在百合花朵衰老后期大量合成,外源ABA 和SA 处理显著加速百合花朵的衰老(未发表),相关调节机制有待进一步研究。
百合切花的衰老表现为花被片的萎蔫和脱落,以及叶片的黄化和脱落。花和叶在植物生长发育过程中发挥不同功能,但其衰老机制具有一定的相似性,例如乙烯、脱落酸等激素信号的调节、活性氧类的积累以及生物大分子的降解等生物学过程在花朵和叶片的衰老过程中均有发生[10, 30]。研究表明,拟南芥花衰老过程中与核酸降解相关的双功能核酸酶基因BFN1 在花瓣和花蕊中表达量极高[31],然而BFN1 在植物衰老过程中的生物学功能尚不明确。在其他物种中,核酸酶基因的功能有一些报道,但其在不同物种中的功能不完全相同。例如,在芹菜(Petroselinum crispum Mill.)中,2 个核酸酶基因Pc⁃NUC1 和PcNUC2 与自然状态及黑暗诱导下叶片衰老密切相关[32],而矮牵牛PhNUC1 在花朵衰老过程中和核酸的降解具有一定相关性[19]。然而以上报道中基因的功能研究尚缺乏明确的表型和分子证据。
本研究中筛选到响应脱落酸和水杨酸,并在百合花朵和叶片衰老过程中高表达的衰老相关基因LoENDONUCLEASE 1,该基因与拟南芥BFN1(At1G11190)同源,是百合中鉴定到的首个核酸酶基因。进一步通过对LoENDONUCLEASE 1 的功能研究发现,过表达LoENDONUCLEASE 1 促进了转基因拟南芥叶片的衰老和百合花被片的衰老,表明百合LoENDONUCLEASE 1 具有促进植株花朵和叶片衰老的功能。本研究将为进一步了解百合花朵衰老发生的相关分子机制和延缓百合切花衰老奠定理论基础。但LoENDONUCLEASE 1 作为重要的核酸酶,其具体作用于哪些核酸的降解,目前还不明确,有待进一步研究。
参考文献References
[1] HU Z H,TANG B,WU Q,et al. Transcriptome sequencing
analysis reveals a difference in monoterpene biosynthesis between
scented Lilium‘ Siberia’ and unscented Lilium‘ Novano’
[J/OL]. Frontiers in plant science,2017,8:1351 [2022-
10-11].https://doi.org/10.3389/fpls.2017.01351.
[2] 陆继亮,何燕红. 中国鲜切花行情运行规律及展望[J]. 湖北
农业科学,2021,60(20):196-200.LU J L,HE Y H.Operation
rules and prospects of cut flower market in China[J].Hubei
agricultural sciences,2021,60(20):196-200 (in Chinese
with English abstract).
[3] 沈颖鸣,周正,孙吉红,等. 云南省鲜切花产业问题及对策研
究[J]. 经济师,2022(4):151-152. SHEN Y M,ZHOU Z,
SUN J H,et al.Study on the problems and countermeasures of
fresh cut flowers industry in Yunnan Province[J].China economist,
2022(4):151-152( in Chinese).
[4] 熊翼,张义云. 百合鲜切花的开发前景和优质高产栽培技术
初探[J]. 农业科技与信息,2016(32):89-90. XIONG Y,
ZHANG Y Y.Preliminary study on the development prospect
and high quality and high yield cultivation techniques of fresh
cut lily flowers[J]. Agricultural science-technology and information,
2016(32):89-90( in Chinese).
[5] 吴中军,郑书虹,夏晶晖. 切花百合采后衰老研究进展[J]. 重
庆文理学院学报,2013,32(5):80-84.WU Z J,ZHENG S H,
XIA J H. Research progress in postharvest senescence of cut
lily flowers[J]. Journal of Chongqing University of Arts and
Sciences,2013,32(5):80-84 (in Chinese with English abstract).
[6] TAKAHASHI S,YOSHIDA C,TAKAHASHI H,et al.Isolation
and functional analysis of EPHEMERAL1-LIKE
(EPH1L) genes involved in flower senescence in cultivated
Japanese gentians[J/OL]. International journal of molecular
sciences,2022,23(10):5608 [2022-10-11].https://doi.org/
10.3390/ijms23105608.
[7] VAN DOORN W G,WOLTERING E J.Physiology and molecular
biology of petal senescence[J].Journal of experimental
botany,2008,59(3):453-480.
[8] TSANAKAS G F,MANIOUDAKI M E,ECONOMOU A
S,et al.De novo transcriptome analysis of petal senescence in
Gardenia jasminoides Ellis[J/OL].BMC genomics,2014,15
(1):554 [2022-10-11].https://doi.org/10.1186/1471-2164-
15-554.
[9] LUO J,CHEN S J,CAO S H,et al.Rose( Rosa hybrida) eth‑
ylene responsive factor 3 promotes rose flower senescence via
direct activation of the abscisic acid synthesis-related 9-CISEPOXYCAROTENOID
DIOXYGENASE gene[J]. Plant
and cell physiology,2021,62(6):1030-1043.
[10] MA N,MA C,LIU Y,et al.Petal senescence:a hormone view
[J].Journal of experimental botany,2018,69(4):719-732.
[11] JONES M L.Mineral nutrient remobilization during corolla senescence
in ethylene-sensitive and -insensitive flowers[J/OL].
AoB plants,2013,5:plt023 [2022-10-11]. https://doi. org/
10.1093/aobpla/plt023.
[12] VAN DER GRAAFF E,SCHWACKE R,SCHNEIDER A,
et al. Transcription analysis of Arabidopsis membrane transporters
and hormone pathways during developmental and induced
leaf senescence[J]. Plant physiology,2006,141(2):
776-792.
[13] GAN S S,AMASINO R M.Making sense of senescence( molecular
genetic regulation and manipulation of leaf senescence)
[J].Plant physiology,1997,113(2):313-319.
[14] MI R J,ABOLE A K,CAO W G. Dissecting endonuclease
and exonuclease activities in endonuclease V from Thermoto⁃
ga maritima[J].Nucleic acids research,2011,39(2):536-544.
[15] SAMEJIMA K,EARNSHAW W C. Trashing the genome:
the role of nucleases during apoptosis[J].Nature reviews molecular
cell biology,2005,6(9):677-688.
[16] YE H,REN F,GUO H Y,et al. Identification of key genes
and transcription factors in ageing Arabidopsis papilla cells by
transcriptome analysis[J].Plant physiology and biochemistry,
2020,147:1-9.
[17] PANAVAS T,PIKULA A,REID P D,et al.Identification of
senescence-associated genes from daylily petals[J].Plant molecular
biology,1999,40(2):237-248.
[18] NARUMI T,SUDO R,SATOH S.Cloning and characterization
of a cDNA encoding a putative nuclease related to petal
senescence in carnation (Dianthus caryophyllus L.) flowers
[J].Journal of the Japanese Society for Horticultural Science,
2006,75(4):323-327.
[19] LANGSTON B J,BAI S Y,JONES M L.Increases in DNA
fragmentation and induction of a senescence-specific nuclease
are delayed during corolla senescence in ethylene-insensitive
(etr1-1) transgenic petunias[J].Journal of experimental botany,
2005,56(409):15-23.
[20] LUO J,LI R R,XU X T,et al.SMRT and illumina RNA sequencing
and characterization of a key NAC gene LoNAC29
during the flower senescence in Lilium oriental‘ Siberia’[J/
OL].Genes,2021,12(6):869[ 2022-10-11].https://doi.org/
10.3390/genes12060869.
[21] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene
expression data using real-time quantitative PCR and the
2−ΔΔCt method[J].Methods,2001,25(4):402-408.
[22] ZHANG X R,HENRIQUES R,LIN S S,et al.Agrobacteri⁃
um-mediated transformation of Arabidopsis thaliana using the
floral dip method[J].Nature protocols,2006,1(2):641-646.
[23] 张强,黄卓然,胡康龙,等. 过表达大豆类受体蛋白激酶基因
RLPK2 促进转基因拟南芥叶片的衰老[J]. 广西植物,2022,
42(5):729-737. ZHANG Q,HUANG Z R,HU K L,et al.
Over expressionn of soybean receptor-like protein kinase
RLPK2 gene from Glycine max promotes transgenic Arabi⁃
dopsis thaliana leaf senescence[J].Guihaia,2022,42(5):729-
737( in Chinese with English abstract).
[24] CHEN S J,WANG H,LI R R,et al.Characterization of Cm⁃
MYC2 in formation of green color in ray florets of Chrysanthe⁃
mum[J].Acta horticulturae sinica,2022,49(11):2377-2387.
[25] 王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育
出版社,2006.WANG X K.Principles and techniques of plant
physiological biochemical experiment[M].Beijing:Higher Education
Press,2006( in Chinese).
[26] ZHANG N N,ZOU H,LIN X Y,et al.Hydrogen sulfide and
rhizobia synergistically regulate nitrogen (N) assimilation and
remobilization during N deficiency-induced senescence in soybean
[J].Plant,cell amp; environment,2020,43(5):1130-1147.
[27] BATTELLI R,LOMBARDI L,ROGERS H J,et al.Changes
in ultrastructure,protease and caspase-like activities during
flower senescence in Lilium longiflorum[J]. Plant science,
2011,180(5):716-725.
[28] WANG T,SUN Z,WANG S Q,et al.DcWRKY33 promotes
petal senescence in carnation (Dianthus caryophyllus L.) by
activating genes involved in the biosynthesis of ethylene and
abscisic acid and accumulation of reactive oxygen species[J].
The plant journal,2023,113(4):698-715.
[29] MENG L,YANG H P,XIANG L,et al. NAC transcription
factor TgNAP promotes tulip petal senescence[J].Plant physiology,
2022,190(3):1960-1977.
[30] WOO H R,KIM H J,LIM P O,et al.Leaf senescence:systems
and dynamics aspects[J].Annual review of plant biology,
2019,70:347-376.
[31] FARAGE-BARHOM S,BURD S,SONEGO L,et al. Expression
analysis of the BFN1 nuclease gene promoter during
senescence,abscission,and programmed cell death-related processes
[J].Journal of experimental botany,2008,59(12):3247-
3258.
[32] CANETTI L,LOMANIEC E,ELKIND Y,et al.Nuclease activities
associated with dark-induced and natural leaf senescence
in parsley[J].Plant science,2002,163(4):873-880.
(责任编辑:葛晓霞)

