高温胁迫对‘索邦’百合花色合成的影响



摘要 为精准探究高温胁迫对百合开花品质的影响,以东方百合‘索邦’为试验材料,研究了不同发育阶段的花苞经过不同温度和不同时间处理后,盛花期花径、花色和矢车菊素含量的变化,以及温度处理过程中矢车菊素合成通路的3 个关键基因LhCHS、LhF3H 和LhANS 的表达量变化。结果显示:S5-S6 时期是‘索邦’百合花苞显色的关键时期;花苞在高于30 ℃温度培养4 d 后,盛花期花径显著变小,矢车菊含量显著降低,花被片颜色变浅; qRT-PCR 结果显示,花苞显色的关键时期,遇到30 ℃以上的高温处理导致LhCHS、LhF3H、LhANS 等花青素合成基因表达量显著下调,从而影响盛花期花色的合成。
关键词 百合; 花色; 花青素; 矢车菊素; 开花品质; 基因表达; 高温胁迫
中图分类号 S682.2+65 文献标识码 A 文章编号 1000-2421(2024)01-0149-08
百合(Lilium spp.)是百合科百合属所有种及品种的总称,种类繁多、花色丰富、姿态优美,是世界五大切花之一。形成百合花色的物质主要有类黄酮和类胡萝卜素,其中粉红色、红色、紫色等花色的主要呈色物质为类黄酮物质中的花青素苷,黄色和橙色等花色的主要呈色物质是类胡萝卜素[1]。花青素苷按结构和种类可分为天竺葵素、矢车菊素、飞燕草素、芍药花素、矮牵牛素、锦葵素和报春花素等7种[2]。红色系百合花青素苷主要存在形式为矢车菊素3-O-β-芸香糖苷,同时也有少部分的矢车菊素3-O-β-芸香糖苷-7-O-β-葡萄糖苷[3]。目前,参与百合矢车菊素合成通路的基因LhPAL、LhCHS、LhCHI、LhF3H、LhF3'H、LhDFR、LhANS、Lh3GT 和Lh3RT已经陆续被分离克隆出来[4]。此外,部分百合矢车菊素合成转录调控因子,如R2R3-MYB、bHLH、WD40等的功能和调控作用也相继得到验证[5],为研究百合花青素苷生物合成调控机理提供了重要基础。
花青素的生物合成由自身基因决定的同时,还受到光照、温度、激素和营养供给条件等外界环境因素的调控[6],其中最主要的是光照和温度,两者能通过调控花青素生物合成通路中相关基因的表达水平进而控制花青素积累[7]。杨捷等[8]和Nakatsuka 等[9]发现光照可以诱导百合中LhMYB12 以及Lhb⁃HLH1、LhbHLH2 基因的表达,从而调控百合花青素苷合成。Yamagishi 等[10]发现光照是岷江百合花被片显色的决定因素。温度也是影响花色合成的重要因素,Lai 等[11]发现温度可以调控花青素代谢通路中关键酶的活性从而影响花青素的合成,高温导致百合‘Marrero’花被片颜色变浅。
‘ 索邦’百合(Lilium oriental hybrids ‘Sorbonne’)是东方百合杂种系最重要的一个品种,也是当前最流行的切花品种之一[12],其花被片为粉红色,花青素苷主要成分为矢车菊3-O-β-芸香糖苷[13]。然而,该品种在设施栽培和采后运输过程中,高温会严重影响花被片显色,导致切花品质下降。‘索邦’百合耐受的高温临界值和临界期尚不明确,导致其切花花色品质不稳定,严重降低了商品价值。本研究以东方百合‘索邦’为试验材料,探讨不同发育阶段的花苞经过不同温度和不同时间处理后,盛花期花径、花色和矢车菊素含量的变化,以及温度处理过程中矢车菊素合成通路的3 个关键基因LhCHS、LhF3H和LhANS 的表达量变化,以期为‘索邦’百合切花的生产以及采后等过程的温度控制提供理论依据和技术指导。
1 材料与方法
1.1 试验材料
切花百合‘索邦’由南京懋园农业科技有限公司提供。剪取植株生长健壮、无病虫害、具有3 个花苞、长度为65 cm 的百合花枝,保留花枝上部的8 片叶,茎秆底部剪成45°的斜面,置于百合专用保鲜液中培养直至开花,保鲜液配方为:蒸馏水中加入20 g 蔗糖(国药集团化学试剂有限公司)、100 mg 赤霉素、50mg 二氯异氰尿酸钠(上海麦克林生化科技有限公司),加蒸馏水至1 L。每个花枝从基部起向上的第1个花苞为试验材料。
所有温度处理均在RDN-400C-4 人工气候箱(宁波东南仪器有限公司)中进行,16 h 光照/8 h 黑暗,光照强度为12 000 lx,湿度为70%。
1.2 百合花苞发育过程显色观测
参考刘雅莉[14]、Lai 等[11]的分级方法,并根据‘索邦’百合花苞发育和显色的特点,将百合花苞发育分为8 个时期(图1):S1 期和S2 期,花苞长度分别为(5.0,6.0] cm 和(6.0,7.0] cm,花被片绿色;S3 期,花苞长度为(7.0,8.0] cm,外轮花被片的边缘呈黄绿色,内侧基部出现少量深红色的乳突;S4 期,花苞长度为(8.0,9.0] cm,花苞膨大,花被片逐渐向黄绿色转变,基部乳突细胞进一步增多;S5 期,花苞长度为(9.0,10.5] cm,花被片中脉部分开始显粉色;S6 期,花苞长度为(10.5,12.0] cm,花被片外侧为黄绿色,花被片内部沿主脉两侧呈粉红色;S7 期,花苞长度为(12.0,13.0] cm,花被片外侧为浅粉色,内侧为粉红色,边缘具有白色边;S8 期,即初开期,花苞长度为(13.0,14.0] cm,花苞顶部微微打开,花被片外侧为粉色,内侧为粉红色,边缘具有白色边,花被片完全展开时为盛开期(SK),花被片顶部向外翻卷,颜色加深。每个时期选取形态一致的3 个花苞,采集外轮花被片中上部的样品(不含中脉和深红色的乳突),混合后液氮速冻,保存于-80 ℃超低温冰箱,用来测定花被片中矢车菊素含量。每个时期3 次重复。
1.3 高温对不同发育阶段百合花苞着色的影响
2021 年12 月13 日,根据花苞发育和显色的特点,分别选取第1 个花苞处于S2、S3、S4、S5、S6 时期的百合花枝,3 枝1 束,用花枝包装袋包裹花束,瓶插后分别置于25 和35 ℃处理2 和4 d 后,转入到25 ℃条件下继续瓶插培养直至开花。观察百合开放进程并测定盛花期花朵直径,分别采集25 ℃与35 ℃处理2、4 d 和盛花期外轮花被片中上部的组织样品,样品用液氮速冻后保存于-80 ℃超低温冰箱,每个处理3次重复。
1.4 不同温度对百合花苞着色的影响
2022 年1 月28 日,选取第1 个花苞处于S3 时期的百合花枝,3 枝1 束,用花枝包装袋包裹花束,瓶插后分别放置于25、28、30、33 ℃条件下处理2、4、6 d后,转入到25 ℃条件下继续瓶插培养直至开花。观察百合开放进程并测定盛花期花朵直径,采集不同温度处理2、4、6 d 和盛花期外轮花被片中上部的组织样品,样品用液氮速冻后保存于-80 ℃超低温冰箱,每个处理3 次重复。
1.5 矢车菊素含量的测定
测量S1-S9 时期和温度处理后盛花期样品的矢车菊素含量。将0.2 g 样品用液氮研磨至粉末,用2 mL 含有2% 甲酸的甲醇避光浸提24 h 后,4 ℃条件下12 000 r/min 离心10 min,取上清液,经0.22 μm滤膜过滤,使用酶标仪(Victor NivoTM, PerkinElmer)在530、657 nm 波长测量其光密度D530、D657。以矢车菊-3-O-β-芸香糖苷氯化物为标准品制作标准曲线。矢车菊素含量=465.24×D530-116.31×D657-16.218。
1.6 LhCHS、LhF3H、LhANS基因表达量分析
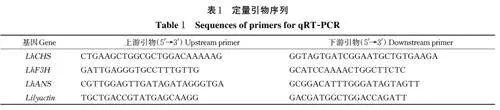
采用RNA 提取试剂盒RN33-PLANTpure(Aidlab,北京,中国)提取温度处理2、4 和6 d 的样品的总RNA。利用 Nanodrop 2000 Spetctrophotometer(Thero Fisher Scientific, 威尔明,美国)检测 RNA 浓度,并利用 1% 的琼脂糖凝胶检测 RNA 的完整性。利用反转录试剂盒 TRUEscript RT MasterMix(Aidlab,北京,中国)将总 RNA 反转录成cDNA,反转录产物保存于-20 ℃冰箱中备用。选取‘索邦’百合矢车菊素合成途径的3 个重要基因LhCHS、LhF3H、LhANS(GenBank 登录号分别为:AB058639、AB201532、AB699166),利用 Primer Premier 5.0 软件在3个基因的非保守区设计定量引物(表1),以百合LilyActin(GenBank 登录号:JX826390)基因作为内参基因。使用Hieff qPCR SYBR Green MasterMix (Low Rox Plus)( 翌圣生物)试剂盒,于ABI7500 Real-Time PCR System(Applied Biosystems,美国)荧光定量PCR 仪上进行反应。反应体系为:Hieff qPCR SYBR Green Master Mix 5 μL 、上下游引物各0.2 μL、 cDNA(10 μmol/L)1 μL、 ddH2O补足至10 μL。反应程序为:预变性95 ℃ 5 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,共40 个循环。每个样品3 次重复,采用2-ΔΔCt法分析结果[15]。
2 结果与分析
2.1 花苞发育过程中花色和矢车菊素含量变化
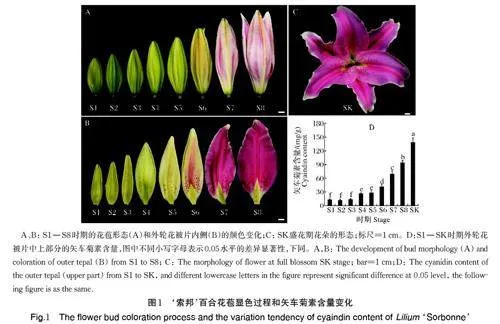
随着‘索邦’百合花苞逐渐膨大,花被片外侧的颜色由绿色(S1-S2)逐渐转变为黄绿色(S3-S5),直至粉红色(S6-S8)(图1A);花被片内侧花色变化早于外侧,S1、S2 时期为绿色,S3 时期基部出现少量紫红色的乳突,随着花苞的发育,乳突逐渐增加,S5-S6 时期花被片内侧中脉区域开始显色,从中间主脉向两侧形成粉红色斑,S7-S8 时期整个花被片呈粉红色,边缘具有白色边(图1B),可见S5-S6 时期是关键的着色期。
测定不同发育阶段花苞和盛花期(图1C)外轮花被片中上部矢车菊素含量,如图1D 所示,S1-S3 时期矢车菊素含量最低,S4-S6 时期矢车菊素含量显著增加,S7 时期急剧增加直到盛花期(SK,图1D)达到最高。
2.2 温度对不同发育阶段百合花苞开花品质的影响
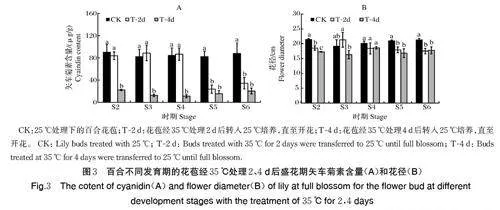
由图2 可见, 35 ℃高温处理2 d 后转到25 ℃培养,S2、S3 和S4 盛花期的花色正常,S5 和S6 盛花期的花被片颜色变浅,矢车菊素含量亦显著降低(图3A),分别为对照(25 ℃)的28.77% 和38.97%;35 ℃高温处理4 d 后转到25 ℃培养,S2、S3、S4、S5 和S6盛花期的花被片颜色均变浅,矢车菊素含量分别下降75.28%、84.73%、86.78%、81.26% 和76.79%(图3A)。可见,在百合花苞显色过程中,35 ℃高温逆境处理会抑制花被片着色,并且随着花苞成熟度的增加,高温处理时间的延长,抑制效果愈加明显;但是S6 时期花苞的花被片内侧中脉部分已经显色,高温处理对已经显色区域的影响较小。
高温处理后,百合盛花期花径较对照均变小,随着处理时间延长,花径缩短程度增加,高温处理4 d 后,S2、S3、S4、S5、S6 盛花期的花径分别较对照缩短了19.38%、14.87%、7.38%、19.67%、16.53%(图3B)。
2.3 不同温度处理对S3 时期百合花苞开花品质的影响
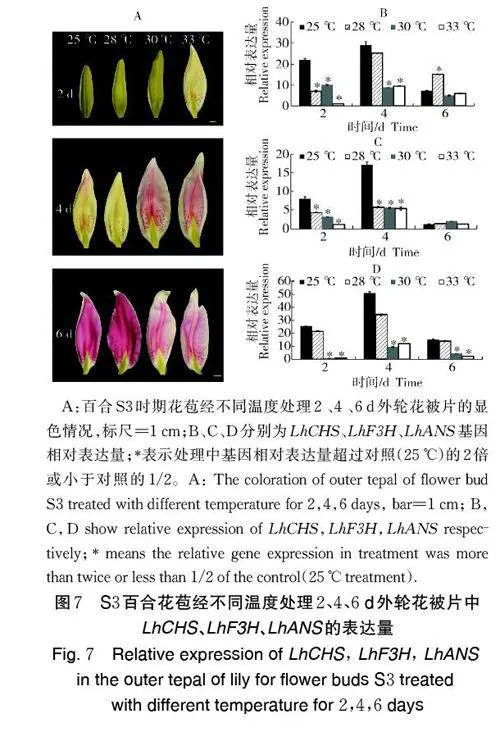
如图4 和图5 所示,S3 时期的花苞在25、28 ℃处理2、4、6 d 后转入25 ℃培养,盛花期花色、矢车菊素含量和花径均无显著差异。30、33 ℃处理2 d 后转入25 ℃培养,盛花期品质与25 ℃相比无显著差异,但是处理4 和6 d 后转入25 ℃培养,盛花期花色变浅,矢车菊素含量显著降低,花径亦显著减小。30、33 ℃处理4 d,百合外轮花被片中矢车菊素含量仅为25 ℃处理的36.59%、28.80%,花径较25 ℃处理减少了8%和4%;处理6 d,外轮花被片中矢车菊素含量仅为25 ℃ 的6.09%、19.54%,花径较25 ℃ 降低了30%和24%。
2.4 LhCHS、LhF3H和LhANS基因表达量分析
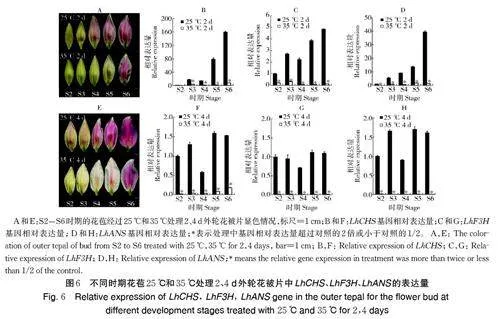
1)35 ℃高温处理2 d 和4 d 花被片中花色合成基因的表达量差异。由图6 可见,35 ℃处理2、4 d,百合花苞外轮花被片的显色被显著抑制,外轮花被片中LhCHS、LhF3H、LhANS 基因的相对表达量较25 ℃显著降低。35 ℃处理2 d,花被片中LhCHS 基因在S2 中较25 ℃处理下调了46.3%,S3-S6 中下调均超过75%;LhF3H、LhANS 基因也分别下调超过了75%、80%;35 ℃处理4 d,LhCHS、LhF3H 和LhANS的表达量较25 ℃处理均下调超过了90%,花青素合成被显著抑制。
2)不同温度处理2、4、6 d 花被片中花色合成基因的表达量差异。由图7 可见,S3 时期的百合花苞经30 ℃、33 ℃处理2、4 d,外轮花被片显色早于25、28 ℃,但花被片显色不均匀,处理时间延长至6 d,30、33 ℃处理的花被片颜色变浅。LhCHS、LhF3H、LhANS 等基因的相对表达量随着花苞的发育呈现先上升后下降的趋势,但是30、33 ℃处理下这3 个基因的相对表达量显著低于25、28 ℃处理下的相对表达量。
3 讨论
S5-S6 时期是‘索邦’百合花被片着色的关键时期(图1),该时期的高温处理会影响盛花期花被片的着色。不同发育时期的花苞经35 ℃高温处理的结果表明,S2-S4 时期的花苞经35 ℃高温处理2 d 后,花被片内侧为黄绿色,色素合成基因表达被抑制,但是未完全进入或者度过显色敏感期,解除高温,花色合成恢复正常;S5-S6 时期的花苞经35 ℃高温处理2 d,花被片已度过显色关键期,解除高温,花色合成未能得到有效恢复,花被片颜色变浅(图2 和图6)。此外,不同温度处理的结果亦表明S3时期的花苞经过30 ℃以上高温处理2 d,花被片亦未完全进入显色敏感期,解除高温后,花色合成恢复正常;高温处理4 d,花被片已经过了敏感期,解除高温后,花被片颜色未能得到有效恢复。S5-S6 时期花苞受到30 ℃以上高温胁迫,花色素合成会显著受抑制,导致盛花期花被片的颜色变浅。生产上一般在百合花苞处于S3 时期进行采收,采收后长距离运输温度不能超过30 ℃,或者30 ℃以上的高温时间不能超过2 d。
温度是影响植物花色合成的重要环境因子。高温胁迫抑制百合花色合成相关基因的表达,导致花青素含量降低、花被片的颜色变浅。韩笑盈[16]发现高温条件下, 菊花花青素含量会降低。Sullivan 等[17]研究了1 900 多份植物标本的花卉颜色,发现在温度升高幅度较大的区域物种的花色会变浅。高温不仅抑制花瓣中花青素的合成,也会抑制果实中花青素的含量。热胁迫也会导致李[18]、苹果[19]和茄子[20]等果肉中的花青素生物合成基因表达量显著下调,花青素苷浓度显著降低。
花青素苷是影响植物花瓣呈色的主要色素物质之一[21],而花青素苷积累主要受MYB、bHLH 和WD40 等转录因子调控,这3 类转录因子组成蛋白复合体MBW 调控关键酶基因的表达[22-23]。在百合有色品种中也先后发现了部分调控花青素合成的转录因子。Yamagishi 等[24]从亚洲百合和东方百合品种中克隆到转录因子LhMYB12,并且发现LhMYB12可以控制百合花瓣中花青素的合成。2016 年,Yamagishi[10]研究发现转录因子LrMYB15 能够响应光照条件,从而提高花青素合成通路基因在岷江百合花被片外侧的高表达。本研究中高温导致‘索邦’百合花被片中花青素合成相关基因LhCHS、LhF3H 和LhANS 的表达量显著下调,这些基因的下调是否受到LhMYB12 或者其他转录因子的调控,仍有待研究。除此之外,miRNA[25]、DNA 甲基化[26]、组蛋白修饰[27]等也参与花青素苷的合成调控,高温胁迫导致百合花色变浅是否也与这些途径有关,亦有待于进一步深入研究。
参考文献References
[1] YAMAGISHI M,KISHIMOTO S,NAKAYAMA M.Carotenoid
composition and changes in expression of carotenoid biosynthetic
genes in tepals of Asiatic hybrid lily[J].Plant breeding,
2010,129(1):100-107.
[2] VEBERIC R,SLATNAR A,BIZJAK J,et al. Anthocyanin
composition of different wild and cultivated berry species[J].
LWT - food science and technology,2015,60(1):509-517.
[3] YAMAGISHI M,YOSHIDA Y,NAKAYAMA M.The transcription
factor LhMYB12 determines anthocyanin pigmentation
in the tepals of Asiatic hybrid lilies (Lilium spp.) and regulates
pigment quantity[J].Molecular breeding,2012,30(2):
913-925.
[4] 毕蒙蒙,曹雨薇,宋蒙,等. 百合花色研究进展[J]. 园艺学报,
2021,48(10):2073-2086.BI M M,CAO Y W,SONG M,et
al.Advances in flower color research of Lilium[J].Acta horticulturae
sinica,2021,48(10):2073-2086 (in Chinese with
English abstract).
[5] 肖伟,张铭芳,张秀海,等. 百合花青素合成调控的研究进展
[J]. 北方园艺,2018(20):154-162.XIAO W,ZHANG M F,
ZHANG X H,et al.Research progress of anthocyanin synthesis
regulation of lily[J].Northern horticulture,2018(20):154-
162( in Chinese with English abstract).
[6] AN J P,ZHANG X W,YOU C X,et al. MdWRKY40 promotes
wounding-induced anthocyanin biosynthesis in association
with MdMYB1 and undergoes MdBT2-mediated degradation
[J].New phytologist,2019,224(1):380-395.
[7] 胡可,韩科厅,戴思兰. 环境因子调控植物花青素苷合成及呈
色的机理[J]. 植物学报,2010,45(3):307-317.HU K,HAN
K T,DAI S L.Regulation of plant anthocyanin synthesis and
pigmentation by environmental factors[J]. Chinese bulletin of
botany,2010,45(3):307-317 (in Chinese with English abstract).
[8] 杨捷,张星,彭梦笛,等. 百合转录因子MYB12 的克隆与表达
分析[J]. 植物科学学报,2018,36(6):812-816,818.YANG J,
ZHANG X,PENG M D,et al.Cloning and expression analysis
of MYB12 in Lilium oriental hybrid’Sorbonne’[J].Plant science
journal,2018,36(6):812-816,818( in Chinese with English
abstract).
[9] NAKATSUKA A,YAMAGISHI M,NAKANO M,et al.
Light-induced expression of basic helix-loop-helix genes involved
in anthocyanin biosynthesis in flowers and leaves of
Asiatic hybrid lily[J]. Scientia horticulturae,2009,121(1):
84-91.
[10] YAMAGISHI M. A novel R2R3-MYB transcription factor
regulates light-mediated floral and vegetative anthocyanin pigmentation
patterns in Lilium regale[J/OL].Molecular breeding,
2016,36(1):3[2022-11-29]. https://doi. org/10.1007/
s11032-015-0426-y.
[11] LAI Y S,YAMAGISHI M,SUZUKI T. Elevated temperature
inhibits anthocyanin biosynthesis in the tepals of an oriental
hybrid lily via the suppression of LhMYB12 transcription
[J].Scientia horticulturae,2011,132:59-65.
[12] 张旭红,孙美玉,李靖锐,等. 东方百合‘索邦’GA20ox 的克隆
及表达分析[J]. 园艺学报,2019,46(1):74-86.ZHANG X H,
SUN M Y,LI J R,et al. Cloning and expression analysis of
GA20ox gene in Lilium oriental hybrids‘ sorbonne’[J].Acta
horticulturae sinica,2019,46(1):74-86( in Chinese with English
abstract).
[13] YAMAGISHI M.Oriental hybrid lily Sorbonne homologue of
LhMYB12 regulates anthocyanin biosyntheses in flower tepals
and tepal spots[J].Molecular breeding,2011,28(3):381-389.
[14] 刘雅莉. 百合乙烯生成与衰老的关系及ACC 氧化酶基因cDNA
的克隆[D]. 杨凌:西北农林科技大学,2004.LIU Y L.
The relation ethylene production to senescence and cloning of
the ACC oxidase genes from lily[D].Yangling:Northwest A
amp; F University,2004( in Chinese with English abstract).
[15] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene
expression data using real-time quantitative PCR and the 2
(-Delta Delta C(T)) method[J]. Methods,2001,25(4):
402-408.
[16] 韩笑盈. 菊花高温下花色褪色差异表达基因分析及CmHY5
的功能研究[D]. 南京:南京农业大学,2020.HAN X Y.Analysis
of differentially expressed genes in color fading under heat
stress and functional analysis of CmHY5 in Chrysanthemum
[D]. Nanjing:Nanjing Agricultural University,2020 (in Chinese
with English abstract).
[17] SULLIVAN C N,KOSKI M H.The effects of climate change
on floral anthocyanin polymorphisms[J/OL].Proceedings biological
sciences,2021,288(1946):2020.2693[2022-11-29 ].
https://doi.org/10.1098/rspb.2020.2693.
[18] NIU J P,ZHANG G J,ZHANG W T,et al.Anthocyanin concentration
depends on the counterbalance between its synthesis
and degradation in plum fruit at high temperature[J/OL].Scientific
reports,2017,7:7684[2022-11-29 ].https://doi.org/
10.1038/s41598-017-07896-0.
[19] KUI L W,MICHELETTI D,PALMER J,et al.High temperature
reduces apple fruit colour via modulation of the anthocyanin
regulatory complex[J].Plant,cell amp; environment,2011,
34(7):1176-1190.
[20] 张圣美. 高温胁迫对茄子果皮花青素生物合成的影响[D]. 南
京:南京农业大学,2020.ZHANG S M.Effects of high temperature
stress on anthocyanin biosynthesis in eggplant peel[D].
Nanjing:Nanjing Agricultural University,2020 (in Chinese
with English abstract).
[21] 洪燕红,叶清华,李泽坤,等. 红花草莓‘莓红’花瓣花色苷积
累及其MYB 基因的表达分析[J]. 园艺学报,2021,48(8):
1470-1484.HONG Y H,YE Q H,LI Z K,et al.Accumulation
of anthocyanins in red-flowered strawberry‘Meihong’petals
and expression analysis of MYB gene[J].Acta horticulturae sinica,
2021,48(8):1470-1484 (in Chinese with English abstract).
[22] FU Z Z,SHANG H Q,JIANG H,et al.Systematic identification
of the light-quality responding anthocyanin synthesis-related
transcripts in Petunia petals[J].Horticultural plant journal,
2020,6(6):428-438.
[23] MENG J X,GAO Y,HAN M L,et al.In vitro anthocyanin induction
and metabolite analysis in Malus spectabilis leaves under
low nitrogen conditions[J]. Horticultural plant journal,
2020,6(5):284-292.
[24] YAMAGISHI M,SHIMOYAMADA Y,NAKATSUKA T,
et al.Two R2R3-MYB genes,homologs of Petunia AN2,regulate
anthocyanin biosyntheses in flower tepals,tepal spots and
leaves of Asiatic hybrid lily[J]. Plant and cell physiology,
2010,51(3):463-474.
[25] TIRUMALAI V,SWETHA C,NAIR A,et al. miR828 and
miR858 regulate VvMYB114 to promote anthocyanin and flavonol
accumulation in grapes[J].Journal of experimental botany,
2019,70(18):4775-4792.
[26] JIANG S H,WANG N,CHEN M,et al.Methylation of Md‑
MYB1 locus mediated by RdDM pathway regulates anthocyanin
biosynthesis in apple[J]. Plant biotechnology journal,
2020,18(8):1736-1748.
[27] CAI H Y,ZHANG M,CHAI M N,et al. Epigenetic regulation
of anthocyanin biosynthesis by an antagonistic interaction
between H2A.Z and H3K4me3[J].New phytologist,2019,221
(1):295-308.
(责任编辑:张志钰)

