木薯MePP2CAa 基因克隆、表达及蛋白互作分析



摘要 为探究2C 型蛋白磷酸酶(protein phosphatase 2C, PP2C)在木薯响应非生物胁迫过程中的作用,利用木薯Arg7 叶片cDNA 扩增MePP2CAa 基因,分析该基因序列、启动子活性、不同逆境和激素处理下的表达模式以及与ABA 受体PYLs 之间的互作关系。序列分析结果显示,MePP2CAa 基因全长1 311 bp,编码436 个氨基酸,具有PP2C 家族的结构域特征,与橡胶树和麻风树的PP2C 序列同源性最高,分别为78.95% 和74.09%,在C 端保守;qRT-PCR 分析结果显示,MePP2CAa 基因在木薯储藏根中的表达显著高于茎、叶中的表达量;不同逆境和激素处理结果显示,甘露醇、NaCl、ABA、MeJA、低温和SA 处理可以显著诱导MePP2CAa 基因的表达;MePP2CAa 基因启动子序列分析显示,启动子包含ABA 应答元件(abscisic acid responsive element,ABRE)、MeJA 响应元件、干旱诱导元件等;酵母双杂交结果显示MePP2CAa 能够与MePYL1 互作。以上结果表明,MePP2CAa 基因可能响应木薯的非生物胁迫。
关键词 木薯; 脱落酸; 2C 型蛋白磷酸酶; 非生物胁迫
中图分类号 S533 文献标识码 A 文章编号 1000-2421(2024)01-0141-08
脱落酸(abscisic acid, ABA)在植物的生长发育中扮演着重要角色,涉及种子发芽、幼苗发育、植物生长、开花、性别分化和果实成熟等多个过程[1-3],同时也参与植物对干旱、高盐、寒冷和病原体侵染等非生物和生物胁迫反应[4-5]。然而,ABA 信号通路相对复杂,直到2009 年,学者们才在拟南芥中阐明了ABA 信号转导的核心通路,该通路包括ABA 受体PYR/PYL/RCARs(ABA 信号的正向调节)、蛋白磷酸酶A(PP2CAs)亚家族(ABA 信号的负向调节)和蛋白激酶SnRK2s(ABA 信号的正向调节)[6]。
农业生产受干旱的影响,会导致作物生长受阻,作物产量显著降低[7-8]。激素是植物对非生物胁迫做出响应的重要调节因子,其中ABA 是对干旱胁迫做出反应的关键激素[9]。研究表明,当植物面临干旱胁迫时,会增加ABA 含量,同时也会改变许多基因的表达,这种反应既有ABA 依赖的反应,也有非ABA 依赖的调节系统,而ABREs 则是ABA 依赖反应途径中的主要反应元件[10-12]。PP2C A 亚家族通常在ABA 信号转导中发挥负调节作用[6, 13],目前已经在水稻[14-15]、玉米[16]、二穗短柄草[17]、棉花[18]等物种中鉴定出PP2C A 亚家族成员。研究表明,拟南芥中的abi1/abi2/hab1/ahg3/pp2ca 基因突变体可以通过负调节ABA 信号来影响植物的生长发育[19-20]和应激反应[21-22]。异源过表达ZmPP2C 和ZmPP2CA10基因可以负调节ABA 信号传递,使转基因拟南芥对外源ABA 处理不敏感,而对盐分和干旱胁迫的敏感性增加[23-24];另外,过表达杨树PP2C 基因也会负调节ABA 信号转导,进而使转基因植株对干旱胁迫更加敏感[25]。
木薯(Manihot esculenta Crantz)是热带和亚热带地区一种重要的粮食作物,是全球第六大粮食作物,为7 亿人提供碳水化合物[26-27]。木薯具有典型的抗旱特性,可以作为作物抗旱机制研究的理想材料[28]。目前关于木薯中PP2C 基因家族的研究相对有限[29],该基因在非生物胁迫下的功能和调控机制仍不清楚。因此,为了深入研究PP2C 基因在木薯抗逆过程中的功能,本研究克隆了MePP2CAa 基因,并对其编码蛋白序列进行生物信息学分析,分析MePP2CAa 基因的自激活和启动子活性,不同逆境胁迫和激素处理下的表达模式,以及与ABA 受体PYLs 之间的互作关系,旨在为深入研究MePP2CAa基因的功能提供有价值的参考。
1 材料与方法
1.1 试验材料和处理
试验品种为木薯Arg7,由中国热带农业科学院热带生物技术研究所提供。采集大田种植环境下木薯叶片(90 d)、茎(90 d)和储藏根(R1 90 d、R2 150 d、R3 210 d、R4 270 d)材料;选取扦插后60 d 长势一致的木薯Arg7 幼苗进行不同激素和胁迫处理试验,① 100 μmol/L MeJA、100 μmol/L SA、100 μmol/LABA 处理后分别在0、2、6、12、24 h 采集叶片;② 300mmol/L NaCl和200 mmol/L 甘露醇处理后分别在0h、2 h、6 h、3 d和14 d采集叶片;③ 4 ℃处理后分别在0、2、6、12、48 h 采集叶片。采样后迅速放入液氮速冻,于−80 ℃超低温冰箱中保存,用于RNA 提取和实时荧光定量分析。
1.2 基因克隆与生物信息学分析
根据Phytozome 数据库中的木薯序列(Manes.02G128000),设计引物MePP2CAa-F/MePP2CAa-R(表1),以叶片cDNA 为模板进行扩增。利用Ex‑PASy ProtParam (http://web. expasy. org/protparam/)对MePP2CAa 基因编码蛋白的理化性质进行分析,运用SOPMA 和SWISS-MODEL(https://swissmodel. expasy. org/)进行结构预测,利用BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源序列的搜索,利用MEGA-X 中的MUSCLE方法进行序列比对,采用Neighbor-joining 法构建系统发育树。
1.3 启动子克隆和序列分析
从Phytozome(https://phytozome-next. jgi. doe.gov/)中获取木薯MePP2CAa 基因上游1 500 bp 启动子序列,设计MePP2CAaP-F/MePP2CAaP-R 引物扩增启动子区域(表1),利用PlantCARE(https://bioinformatics. psb. ugent. be/webtools/plantcare/html/)对MePP2CAa 基因启动子进行顺式作用元件分析。
1.4 启动子活性分析
将pGreenⅡ 0800-LUC-MePP2CAaP 载体转入农杆菌GV3101 感受态细胞,挑选阳性转化子,将菌体用注射烟草的重悬液调整至OD600 为1.0,25 ℃恒的烟草嫩叶下表皮,培养3 d 后进行双荧光素酶含量的测定,计算LUC/REN 值,每个样品6 次生物学重复。
1.5 基因表达分析
根据MePP2CAa 序列设计实时荧光定量PCR引物qMePP2CAa-F 和qMePP2CAa-R(表1),分析MePP2CAa 基因在不同激素和胁迫处理中的表达情况,MeTUB 为内参基因,使用2-△△Ct法[26]计算基因的相对表达量。
1.6 转录激活和互作分析
将载体pGBKT7-MePP2CAa 转化到酵母中,取200 μL 涂板至一缺培养基(SD/‒Trp),29℃培养48~96 h,挑取长势较好的单菌落验证阳性转化子,用液体SD/‒ Trp 培养基活化阳性转化子菌落,用ddH2O 稀释至合适浓度,取2 μL 菌落水溶液分别点于SD/‒Trp、SD/‒His 和SD/‒His/X-α-gal 培养基,29 ℃培养观察菌落生长状况。
构建MePYLs 和MePP2CAa 基因的酵母表达载体。以pGADT7-T 和pGBKT7-53 作为阳性对照、pGADT7-T 和pGBKT7-Lam 作为阴性对照,将阳性对照质粒组合、阴性对照质粒组合以及构建的重组质粒组合(引物见表1)两两转化到AH109 酵母感受态中培养观察蛋白的互作情况。挑取SD/‒Trp/‒Leu培养基上的长势较好的单菌落验证阳性转化子,挑取原始菌落进行10 倍稀释,吸取稀释后菌落水溶液2 μL,点于SD/‒Trp/‒Leu和SD/‒Trp/‒Leu/‒Ade/‒His 培养基,29 ℃培养观察菌落生长状况。
2 结果与分析
2.1 MePP2CAa 基因克隆
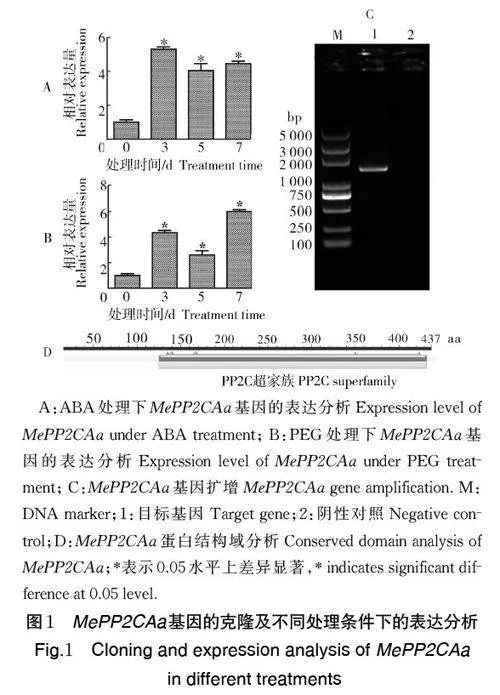
前期试验结果表明,木薯PP2C 基因(Manes.02G128000)可以受到ABA 和PEG 的诱导表达(图1A、B)。根据Manes.02G128000 序列设计引物进行基因扩增,得到长度1 311 bp 的片段(图1C),经测序分析发现,该片段编码436 个氨基酸,保守结构域预测显示该蛋白含有PP2C 家族结构域(图1D),因此命名为MePP2CAa 基因。MePP2CAa 蛋白的分子式为C2030H3298N602O647S31,理化性质分析结果显示,MePP2CAa 蛋白的分子质量为47.48 ku,理论等电点为6.08,不稳定系数为54.24,属不稳定蛋白。序列分析发现MePP2CAa 基因序列包含4 个外显子和3 个内含子。
2.2 MePP2CAa 氨基酸序列同源性比对和系统发育分析
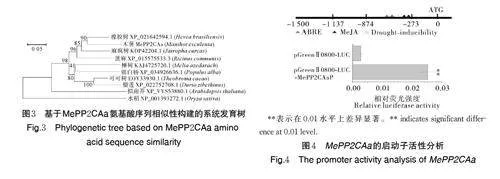
利用NCBI 数据库序列查找与MePP2CAa 蛋白序列相似性较高(gt;65%)的蛋白序列,序列比对结果显示,MePP2CAa 蛋白序列与橡胶树PP2C(XP_021649290.1)和麻风树PP2C(KDP42204.1)一致性最高,分别为78.95% 和74.09%(图2),表明不同物种间PP2C 蛋白序列具有较高的保守性。系统进化树分析显示,大戟科植物木薯MePP2CAa 和橡胶树HbPP2C24 亲缘关系较近,位于同一分支(图3)。
2.3 MePP2CAa 基因启动子的活性分析
通过PCR 获得MePP2CAa 基因1 500 bp 的启动子序列,利用PlantCARE 数据库对MePP2CAa 基因的启动子序列进行分析,结果如图4 所示,该基因的启动子除了包含基本的核心启动子元件,还包括2 个ABRE 顺式调控元件、2 个MeJA 响应元件及1 个干旱诱导元件。为了验证克隆得到的MePP2CAa 基因启动子是否具有活性,进行了瞬时转化烟草叶片的实验。结果显示,克隆得到的MePP2CAa 基因启动子具有较高的活性,能够有效启动下游结构基因的表达。
2.4 MePP2CAa 基因的表达分析
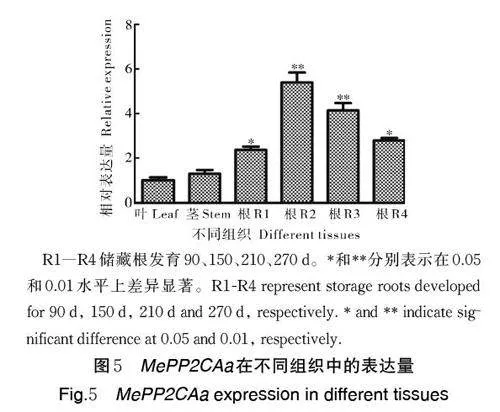
木薯储藏根、茎、叶3 种组织中MePP2CAa 基因的表达模式分析结果显示(图5),MePP2CAa 基因在储藏根中的表达明显高于叶和茎。MePP2CAa 基因在储藏根中的表达随着发育时间的增加而上升,在R2(150 d)阶段达到最高水平,随后呈下降趋势。为了探究MePP2CAa 基因的表达是否受胁迫诱导,检测了不同胁迫和激素处理条件下叶片中MePP2CAa基因的表达水平,结果显示,NaCl 处理和甘露醇处理条件下,MePP2CAa 基因的表达量随着处理时间的延长而增加,在14 d 时达到最高(图6A、B);冷处理下,MePP2CAa 基因的表达量在48 h 达到最高(图6C)。MeJA 和ABA 处理下,MePP2CAa 基因的表达量随着处理时间的延长呈现先增加后降低的趋势,分别在6 h 和10 h 达到最高(图6D、E);而在SA处理下,MePP2CAa 基因的表达量随着处理时间的延长先降低后增加,在24 h 达到最高(图6F)。以上结果表明MePP2CAa 基因可受到不同逆境和激素处理的诱导表达。
2.5 MePP2CAa 与PYLs 基因的互作验证
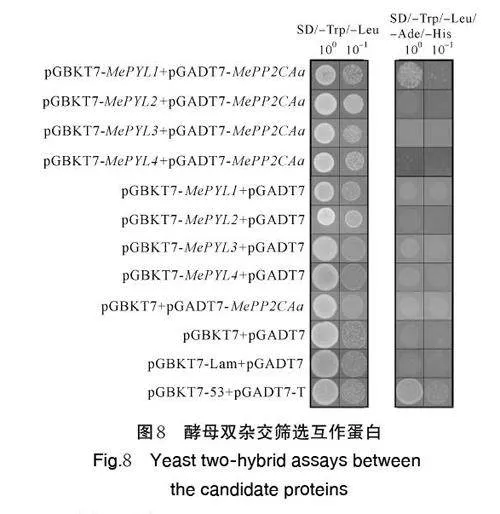
MePP2CAa 基因自激活检测结果如图7 所示,pGBKT7-MePP2CAa 能够在SD/‒Trp 和SD/‒His培养基上生长,并且在SD/‒His/X-α-gal 培养基上呈现出蓝色,表明MePP2CAa 具有一定的自激活活性。因此,构建pGADT7-MePP2CAa 载体用于酵母双杂交试验。
前人研究发现,ABA 信号转导途径中PP2CA 亚家族成员可以与PYLs 家族成员互作。为证明MePP2CAa 参与了ABA 信号通路的调控,本研究构建了MePYL1-MePYL4 基因酵母表达载体,分析了MePP2CAa 与MePYL1-MePYL4 的互作关系,结果如图8 所示,所有组合在SD/‒Trp/‒Leu 培养基上都表现出正常的生长。在SD/‒Trp/‒Leu/‒Ade/‒His培养基上,pGADT7-MePP2CAa+pGBKT7-Me⁃PYL1 和pGADT7-T+pGBKT7-53 阳性对照有菌落形成;而pGADT7-MePP2CAa+pGBKT7-Me⁃PYL2/MePYL3/MePYL4 组合及pGADT7-T+pGBKT7-Lam 阴性对照则没有菌落产生,表明MePP2CAa 与MePYL1 存在相互作用。
3 讨论
ABA 在植物中发挥着重要的作用,帮助植物适应不同的环境变化和应对胁迫。Umezawa 等[6]在拟南芥中鉴定了ABA 受体及其核心信号转导通路(ABA 受体PYR/PYL/RCARs、蛋白磷酸酶PP2CAs 和蛋白激酶SnRK2s)。在没有ABA 存在的情况下,PP2CAs 会抑制SnRK2s 对下游靶蛋白的磷酸化,而一旦ABA 出现,PYL 和PP2CAs 会相互结合,SnRK2s 被释放,磷酸化其他靶标蛋白,并进一步激活ABA 信号传导通路[6]。PP2CAs 在ABA 信号传导通路中扮演着关键的角色,深入研究其功能显得尤为重要。本研究成功克隆了1 个PP2CA 亚家族成员MePP2CAa。通过表达分析发现,MePP2CAa基因在木薯Agr7 的不同组织中呈现差异表达。在储藏根、茎和叶中均表现出较高的表达水平,尤其是在储藏根中的表达水平最为显著。这一结果表明MePP2CAa 基因可能在木薯储藏根的生长和发育中发挥着重要的功能。相关研究发现,PP2C 基因在其他作物的不同组织中也存在不同的表达模式,比如小麦TaPP2C-a10 基因在叶片和种子的不同发育阶段均有表达,但在种子开花后20 d 的表达水平最高[30]。同样,二穗短柄草BdPP2CA6 基因在根、茎、叶和芽中也有表达,但以茎中的表达水平最高[31]。这些结果表明PP2C 基因的表达水平与植物不同组织的生长和发育过程之间存在密切关系。
植物中的A 类PP2C 基因通常对各种逆境胁迫表现出响应。拟南芥的研究发现,A 类PP2C 基因在对ABA 信号的负调控方面表现出相似的功能,参与拟南芥的氧化胁迫反应[32-33]和抗冷胁迫的响应[34]。对于重要作物水稻和玉米,A 类PP2C 基因在应对如高盐、干旱和低温等非生物逆境也呈现出不同程度的响应[14, 23-24]。本研究的结果显示,MePP2CAa 基因可以被低温、甘露醇、NaCl、ABA、MeJA 和SA 诱导,这与笔者所在课题组前期RNA-seq 试验结果[35]相符。然而,与此相反,FsPP2C2 基因的超表达在增强植物对逆境胁迫的抵抗力的同时,也提高了对ABA 信号的敏感性[36];AtPP2CG1 基因的超表达也被证明能够提高植株对高盐胁迫的抵抗力和对ABA信号的敏感性[37]。本研究中,酵母双杂交实验明确了MePP2CAa 和MePYL1 蛋白存在相互作用,这进一步证实了MePP2CAa 属于PP2C A 亚家族,并可能参与ABA 信号转导。根据以上结果推测,MePP2CAa 基因可能通过ABA 信号通路来响应非生物胁迫,但MePP2CAa 在ABA 信号转导中发挥正调控还是负调控作用尚不明确。这些结果可为进一步解析MePP2CAa 基因在ABA 信号通路中的功能提供参考。
参考文献 References
[1] FENG C Z,CHEN Y,WANG C,et al. Arabidopsis RAV1
transcription factor,phosphorylated by SnRK2 kinases,regulates
the expression of ABI3,ABI4,and ABI5 during seed germination
and early seedling development[J]. The plant journal,
2014,80(4):654-668.
[2] TIJERO V,TERIBIA N,MUÑOZ P,et al.Implication of abscisic
acid on ripening and quality in sweet cherries:differential
effects during pre- and post-harvest[J/OL].Frontiers in plant
science,2016,7:602[2023-07-06].https://doi.org/10.3389/
fpls.2016.00602.
[3] WASILEWSKA A,VLAD F,SIRICHANDRA C,et al.An
update on abscisic acid signaling in plants and more[J].Molecular
plant,2008,1(2):198-217.
[4] BEN-ARI G. The ABA signal transduction mechanism in
commercial crops:learning from Arabidopsis[J].Plant cell reports,
2012,31(8):1357-1369.
[5] CHEN K,LI G J,BRESSAN R A,et al.Abscisic acid dynamics,
signaling,and functions in plants[J].Journal of integrative
plant biology,2020,62(1):25-54.
[6] UMEZAWA T,NAKASHIMA K,MIYAKAWA T,et al.
Molecular basis of the core regulatory network in ABA responses:
sensing,signaling and transport[J]. Plant and cell
physiology,2010,51(11):1821-1839.
[7] HLAVINKA P,TRNKA M,SEMERÁDOVÁ D,et al. Effect
of drought on yield variability of key crops in Czech Republic
[J]. Agricultural and forest meteorology,2009,149(3/
4):431-442.
[8] DIETZ K J,ZÖRB C,GEILFUS C M.Drought and crop yield
[J].Plant biology,2021,23(6):881-893.
[9] DASZKOWSKA-GOLEC A,SZAREJKO I. The molecular
basis of ABA-mediated plant response to drought, in abiotic
stress[M/OL]//VAHDATI K, LESLIE C. Abiotic stress -
plant responses and applications in agriculture. Rijeka: IntechOpen,
2013:103-134 [2023-07-06]. https://doi. org/
10.5772/53128.
[10] ASSMANN S M. OPEN STOMATA1 opens the door to
ABA signaling in Arabidopsis guard cells[J].Trends in plant
science,2003,8(4):151-153.
[11] SEKI M,ISHIDA J,NARUSAKA M,et al. Monitoring the
expression pattern of around 7,000 Arabidopsis genes under
ABA treatments using a full-length cDNA microarray[J].
Functional and integrative genomics, 2002,2(6):282-291.
[12] WANG Y,FAN J,WU X,et al.Genome-wide characterization
and expression profiling of HD-Zip genes in ABA-mediated
processes in Fragaria vesca[J/OL]. Plants, 2022,11(23):
3367[2023-07-06]. https://doi: 10.3390/plants11233367.
[13] SHAZADEE H,KHAN N,WANG L,et al. GhHAI2,
GhAHG3, and GhABI2 negatively regulate osmotic stress tolerance
via ABA-dependent pathway in cotton (Gossypium hir⁃
sutum L.)[J/OL].Frontiers in plant science,2022,13:905181
[2023-07-06].https://doi:10.3389/fpls.2022.905181.
[14] SINGH A,GIRI J,KAPOOR S,et al. Protein phosphatase
complement in rice:genome-wide identification and transcriptional
analysis under abiotic stress conditions and reproductive
development[J/OL].BMC genomics,2010,11:435[2023-07-
06].https://doi:10.1186/1471-2164-11-435.
[15] XUE T,WANG D,ZHANG S,et al. Genome-wide and expression
analysis of protein phospha tase 2C in rice and Arabi⁃
dopsis[J/OL]. BMC genomics,2008,9:550[2023-07-06].
https://doi.org/10.1186/1471-2164-9-550
[16] WEI K,PAN S.Maize protein phosphatase gene family:identification
and molecular characterization[J/OL]. BMC genomics,
2014,15(1):773[2023-07-06]. https://doi:10.1186/
1471-2164-15-773.
[17] CAO J,JIANG M,LI P,et al.Genome-wide identification and
evolutionary analyses of the PP2C gene family with their expression
profiling in response to multiple stresses in Brachypo⁃
dium distachyon[J/OL].BMC genomics,2016,17:175[2023-
07-06].https://doi:10.1186/s12864-016-2526-4.
[18] SHAZADEE H,KHAN N.Identification and expression profiling
of protein phosphatases (PP2C) gene family in Gossypi⁃
um hirsutum L.[J/OL].International journal of mechanical sciences,
2019,20(6):1395[2023-07-06].https://doi:10.3390/
ijms20061395.
[19] ALLEN G J,KUCHITSU K,CHU S P,et al. Arabidopsis
abi1-1 and abi2-1 phosphatase mutations reduce abscisic acidinduced
cytoplasmic calcium rises in guard cells[J].The plant
cell,1999,11(9):1785-1798.
[20] GOSTI F,BEAUDOIN N,SERIZET C,et al.ABI1 protein
phosphatase 2C is a negative regulator of abscisic acid signaling
[J].The plant cell,1999,11(10):1897-1910.
[21] MERLOT S,GOSTI F,GUERRIER D,et al.The ABI1 and
ABI2 protein phosphatases 2C act in a negative feedback regulatory
loop of the abscisic acid signalling pathway[J]. The
plant journal,2001,25(3):295-303.
[22] RUBIO S,RODRIGUES A,SAEZ A,et al. Triple loss of
function of protein phosphatases type 2C leads to partial constitutive
response to endogenous abscisic acid[J].Plant physiology,
2009,150(3):1345-1355.
[23] LIU L X,HU X L,SONG J A,et al.Over-expression of a Zea
mays L. protein phosphatase 2C gene (ZmPP2C) in Arabi⁃
dopsis thaliana decreases tolerance to salt and drought[J].
Journal of plant physiology,2009,166(5):531-542.
[24] XIANG Y L,SUN X P,GAO S,et al. Deletion of an endoplasmic
reticulum stress response element in a ZmPP2C-A
gene facilitates drought tolerance of maize seedlings[J].Molecular
plant,2017,10(3):456-469.
[25] ARSHAD M,MATTSSON J. A putative poplar PP2C-encoding
gene negatively regulates drought and abscisic acid responses
in transgenic Arabidopsis thaliana[J].Trees,2014,28
(2):531-543.
[26] 颜彦,铁韦韦,丁泽红,等. 木薯MePYL8 基因克隆及表达分
析[J]. 分子植物育种,2018,16(14):4498-4504. YAN Y,
TIE W W,DING Z H,et al.Cloning and expression analysis
of MePYL8 gene in cassava[J]. Molecular plant breeding,
2018,16(14):4498-4504( in Chinese with English abstract).
[27] HU W,JI C M,SHI H T,et al.Allele-defined genome reveals
biallelic differentiation during cassava evolution[J]. Molecular
plant,2021,14(6):851-854.
[28] HU W,JI C M,LIANG Z,et al.Resequencing of 388 cassava
accessions identifies valuable loci and selection for variation in
heterozygosity[J/OL]. Genome biology,2021,22(1):316
[2023-07-06].https://doi:10.1186/s13059-021-02524-7.
[29] ZHAO H,WU C L,YAN Y,et al. Genomic analysis of the
core components of ABA signaling reveals their possible role
in abiotic stress response in cassava[J/OL]. Environmental
and experimental botany,2019,167:103855[2023-07-06].
https://doi.org/10.1016/j.envexpbot.2019.103855.
[30] YU X F,HAN J P,LI L,et al. Wheat PP2C-a10 regulates
seed germination and drought tolerance in transgenic Arabi⁃
dopsis[J].Plant cell reports,2020,39(5):635-651.
[31] ZHANG F,WEI Q,SHI J,et al. Brachypodium distachyon
BdPP2CA6 interacts with BdPYLs and BdSnRK2 and positively
regulates salt tolerance in transgenic Arabidopsis[J/
OL]. Frontiers in plant science,2017,8:264[2023-07-06].
https://doi.org/10.3389/fpls.2017.00264.
[32] MEYER K,LEUBE M P,GRILL E. A protein phosphatase
2C involved in ABA signal transduction in Arabidopsis thali⁃
ana[J].Science,1994,264(5164):1452-1455.
[33] SAEZ A,APOSTOLOVA N,GONZALEZ-GUZMAN M,
et al. Gain-of-function and loss-of-function phenotypes of the
protein phosphatase 2C HAB1 reveal its role as a negative regulator
of abscisic acid signalling[J].The plant journal,2004,37
(3):354-369.
[34] NISHIMURA N,YOSHIDA T,KITAHATA N,et al.ABAhypersensitive
germination1 encodes a protein phosphatase
2C,an essential component of abscisic acid signaling in Arabi⁃
dopsis seed[J].The plant journal,2007,50(6):935-949.
[35] WU C L,DING Z H,CHEN M J,et al.Identification and functional
prediction of lncRNAs in response to PEG and ABA
treatment in cassava[J/OL].Environmental and experimental
botany,2019,166:103809[2023-07-06]. https://doi. org/
10.1016/j.envexpbot.2019.103809.
[36] REYES D,RODRÍGUEZ D,GONZÁLEZ-GARCÍA M P,
et al. Overexpression of a protein phosphatase 2C from beech
seeds in Arabidopsis shows phenotypes related to abscisic acid
responses and gibberellin biosynthesis[J]. Plant physiology,
2006,141(4):1414-1424.
[37] LIU X,ZHU Y M,ZHAI H,et al.AtPP2CG1,a protein phosphatase
2C,positively regulates salt tolerance of Arabidopsis
in abscisic acid-dependent manner[J]. Biochemical and biophysical
research communications,2012,422(4):710-715.
(责任编辑:葛晓霞)

