番茄响应南方根结线虫侵染相关转录因子的初步分析


摘要 为明确番茄接种根结线虫后基因种类和表达量在转录水平的变化规律,利用RNA-seq 对未接种及接种南方根结线虫2 龄幼虫6、12、24 和48 h 的番茄进行转录组测序,探究番茄响应南方根结线虫侵染相关的关键转录因子,并采用qRT-PCR 方法对测序结果进行验证。结果显示,接种南方根结线虫后6、12、24 和48 h 分别有350、390、580、1 154 个基因差异表达,其中差异表达转录因子分别为11、11、19、50 个。这些转录因子属于15个家族,其中数量最多的为MYB 家族和bHLH 家族(均为20 个),其次是ERF 家族19 个、WRKY 家族15 个、bZIP 家族9 个。南方根结线虫侵染过程差异表达最明显的主要为ERF、WRKY、MYB 和bHLH 家族转录因子,其中Solyc03g005520、Solyc02g094270 和Solyc09g066350 显著上调,接种后48 h log2FC 分别为 9.16、6.49 和6.33;Solyc02g079280、Solyc12g100140 和Solyc04g072460 显著下调,接种后48 h log2FC 分别为-2.60、-1.72 和-1.70。qRT-PCR 验证结果显示,6 个随机选取基因的表达趋势与测序结果基本一致。以上结果表明,ERF、WRKY、MYB 和bHLH 家族转录因子可能参与番茄与南方根结线虫互作,在番茄响应南方根结线虫侵染反应中发挥着重要的调控作用。
关键词 番茄; 转录因子; 南方根结线虫; 线虫侵染; qRT-PCR
中图分类号 S436.412 文献标识码 A 文章编号 1000-2421(2024)01-0062-08
植物依靠复杂的信号传导机制应对各种不良环境因素胁迫及细菌、真菌、线虫等生物侵染,通过多组分协同作用建立起对不良环境及生物胁迫的防卫反应。植物的防卫反应涉及分子、细胞、生化和生理水平的变化,这些变化通常受到胁迫响应基因表达的调控[1]。转录因子是胁迫响应基因重要的调控因子之一,它通过与靶标基因特定DNA 序列结合调控目的基因的表达,参与调控植物的生长发育及对不良环境和生物胁迫的防卫反应[2]。根结线虫(Meloidogyne spp.)是分布广泛且寄主繁多的植物寄生线虫。迄今为止,全世界报道的根结线虫约100种,其中南方根结线虫(Meloidogyne incognita)是分布最广、危害最严重的4 种常见根结线虫之一[3-4]。
番茄根结线虫病是番茄的重要病害,一般造成减产10%~20%,严重的达60% 以上[5]。常规的防治方法包括轮作、施用杀线剂、种植抗线虫品种等,抗病品种的选育是防治该病最经济、有效、安全的方法[6-7]。番茄的抗病分子育种研究虽然有一定的进展,但多集中于单一抗病基因的挖掘与应用方面,而目前应用最广泛的抗病基因Mi-1 存在热不稳定性且自然界中存在北方根结线虫(M. hapla)、象耳豆根结线虫(M. enterobobii)等抗性小种[8]。越来越多的研究者将目光转向了植物对线虫的防卫反应,试图寻找其中的关键调控因子,通过增强关键调控因子的作用激活植物体内相关防卫基因的表达,从而提高植物的抗病性[9-10]。为了探索番茄接种南方根结线虫后转录因子表达的变化,挖掘番茄响应南方根结线虫侵染的关键转录因子,本研究采用高通量测序技术,提取未接种及接种南方根结线虫2 龄幼虫6、12、24 和48 h 的番茄根RNA 进行转录组测序,初步分析差异表达的转录因子,采用qRT-PCR 技术对测序结果进行验证,旨在为番茄抗根结线虫的分子机制研究及栽培番茄的改良提供理论依据。
1 材料与方法
1.1 材料处理及样本采集
抗南方根结线虫野生番茄材料F5 采自广西柳州市郊区,经抗性鉴定为高抗材料[11]。南方根结线虫采集自广西南宁市武鸣区广西农业科学院里建科研基地,单卵块纯化鉴定后接种至番茄苗(品种为“特级大明星”,广东省湛江市大地蔬菜种子有限公司生产)上繁殖备用。试验时在体视显微镜(NikonSMZ800N)下挑取卵囊,置于25 ℃恒温箱中孵化成2龄幼虫。
将番茄材料(F5)播种于育苗盆中,放置于温室大棚内培养。将4 片真叶的番茄苗移栽到直径20cm、高12 cm 的花盆中,每盆种植3 株,共20 盆60 棵。
移栽后10 d 处理组(T1_6 h、T2_12 h 、T3_24 h、T4_48 h)每盆接种含1 500 头南方根结线虫2 龄幼虫的线虫液,对照组(T0_CK)接种等量清水,处理组和对照组分别设置4 个重复。将处理组和对照组置于25 ℃培养箱进行培养,接种6、12、24、48 h 后分别取番茄植株根尖组织3 cm(约500 mg),利用RNA-seq技术分析番茄对南方根结线虫侵染早期的防卫机制。每个样本同时取2 份,1 份送北京诺禾致源科技股份有限公司测序,另1 份经液氮冷冻后保存于-80 ℃冰箱中用于后续qRT-PCR 验证。
1.2 总RNA提取及质量检测
采用Trizol 提取总RNA。Nanodrop 分光光度计和核酸分析仪Agilent 2200 分别检测RNA 的纯度及完整性。将检测合格的RNA 样品用于转录组测序。
1.3 转录组测序
利用RNA-Seq 试剂盒合成cDNA,经过连接、纯化,获得cDNA 文库;由北京诺禾致源科技股份有限公司利用Illumina HiSeq 4000 平台对cDNA 文库进行测序。
1.4 转录组数据分析
通过Illumina HiSeq 4000 平台获得的原始序列(raw reads),经过匹配、过滤低质量的碱基得到高质量的质控数据(clean reads)。将质控后的原始序列与参考基因组进行比对,只保留能够特异比对到番茄基因组的片段用于后续分析。
以Log2(FoldChange)gt;1 和q-valuelt;0.005 作为筛选条件,用DEseq 软件对接种后6 h 和对照组(T1_6 h VS T0_CK )、接种后12 h 和对照组(T2_12 h VST0_CK)、接种后24 h 和对照组(T3_24 h VST0_CK)及接种后48 h 和对照组(T4_48 h VST0_CK)4 组材料进行差异表达基因筛选。以q-valuelt;0.05 作为阈值,对差异表达基因进行GO 功能注释和KEGG 通路富集分析。
1.5 qRT-PCR验证
随机选取差异表达的6 个基因,利用NTI-11 软件设计扩增引物(表1)。提取与转录组测序相同的样品(处理组T4_48 h)总RNA 并反转录成cDNA 做为模板,以actin 为内参基因进行qRT-PCR 分析,验证转录组测序分析结果的可靠性。qRT-PCR 的反应体系、反应程序及基因相对表达量计算参考唐科志等[12]的方法。
2 结果与分析
2.1 测序数据质量检测及reads 比对分析
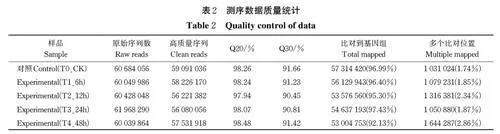
对照组(T0_CK)与试验组(T1_6 h、T2_12 h 、T3_24 h、T4_48 h)原始数据统计结果显示rawreads 数分别为60 684 056、60 049 986、60 428 048、61 968 290、60 039 864 个,经过质控后得到的cleanreads 数分别为59 091 036、58 226 170、56 221 382、56 080 056、57 531 918 个。对各样品的reads 进行质量检测,各样品的Q30 在90.45%~91.66%,Q20 在97.94%~98.48%。利用HISAT 软件将所得reads与番茄基因组参考序列(https://solgenomics.net/organism/Solanum_lycopersi-coides/genome, 2018)比对,分别有57 314 420、56 129 943、53 576 560、54 637 193、53 004 753 个reads 可特异性比对到番茄基因组上(表2)。测序数据质量检测及reads 比对分析结果说明测序数据质量较好,可用于后续的转录组数据分析。
2.2 差异表达基因统计分析
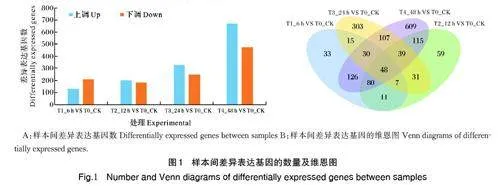
将接种南方根结线虫后6、12、24、48 h 与0 h 样品的转录组数据进行对比分析,筛选差异表达基因。结果显示,接种南方根结线虫后6、12、24、48 h 分别有350、390、580、1 154 个差异表达基因。其中上调表达基因分别为136、204、328、674 个,下调表达基因分别为214、186、252、480 个(图1A)。对样本间共有差异表达基因进行分析发现,接种后6 h 与12 h,共有差异表达基因146 个;接种后6 h 与24 h,共有差异表达基因100 个;接种后6 h 与48 h,共有差异表达基因284 个;接种后6、12、24、48 h,共有差异表达基因48个(图1B)。
2.3 差异表达基因GO功能注释
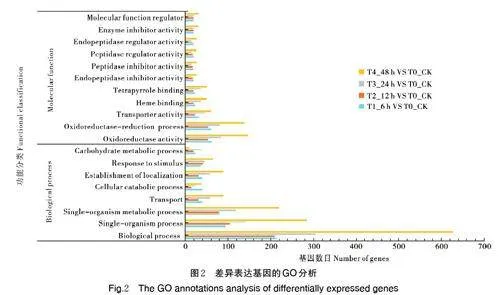
对差异表达基因进行GO 功能注释,结果显示,各样本间差异表达的基因主要包含于生物过程(biologicalprocess)和分子功能(molecular function)。T1_6 h VS T0_CK 差异表达基因共富集到659 条GO 条目。其中,差异表达基因数最多的是biologicalprocess(214 个),其次是single-organism process(95个),single-organism metabolic process 为 81 个;T2_12 h VS T0_CK 差异表达基因共富集到430 条GO条目。其中差异表达基因数最多的是biological process(210 个),其次是single-organism process(104个),single-organism metabolic process 为 79 个;T3_24 h VS T0_CK 差异表达基因共富集到896 条GO条目。其中,差异表达基因数最多的是biologicalprocess(306 个),其次是single-organism process(142个),single-organism metabolic process 为119 个;T4_48 h VS T0_CK 差异表达基因共富集到1 338 条GO 条目。其中,差异表达基因数最多的是biologicalprocess(628 个),其次是catalytic activity 和singleorganismprocess,分别为478 和285 个(图2)。由此可见,生物过程和单细胞过程在番茄响应南方根结线虫侵染调控中发挥着重要的作用。
2.4 差异表达基因的KEGG代谢通路分析
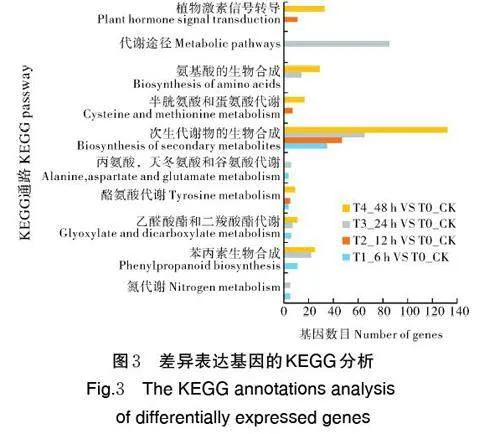
T1_6 h VS T0_CK 差异表达基因显著富集到9条主要的代谢通路,其中富集因子最高的是氮代谢(nitrogen metabolism),其次是苯丙烷生物合成(phenylpropanoid biosynthesis)。而富集差异基因最多的途径为次生代谢物生物合成(biosynthesis of secondarymetabolites),共富集到35 个差异表达基因,其次为苯丙烷生物合成(phenylpropanoid biosynthesis),有11 个差异表达基因被富集到该途径。T2_12h VS T0_CK 差异表达基因显著富集到8 条主要代谢通路。其中,次生代谢物生物合成富集因子最高,其次为异喹生物碱生物合成(isoquinoline alkaloidbiosynthesis);次生代谢物生物合成途径富集差异基因最多,共富集到47 个差异表达基因,其次为植物激素信号传导(plant hormone signal transduction),富集到11 个差异表达基因。T3_24 h VS T0_CK 差异表达基因显著富集到8 条主要代谢通路,富集因子最高的是苯丙烷生物合成,次生代谢物生物合成次之;代谢途径富集差异基因最多,共富集到85 个差异表达基因,次生代谢物生物合成次之,共富集到65 个差异表达基因;T4_48 h VS T0_CK 差异表达基因显著富集到18 条主要的代谢通路,其中,缬氨酸、亮氨酸和异亮氨酸的降解富集因子最高,其次为次生代谢物生物合成;而次生代谢物生物合成途径富集差异基因最多,共富集到132 个差异表达基因,其次为植物激素信号传导途径,共富集到33 个差异表达基因(图3)。
2.5 差异表达的转录因子
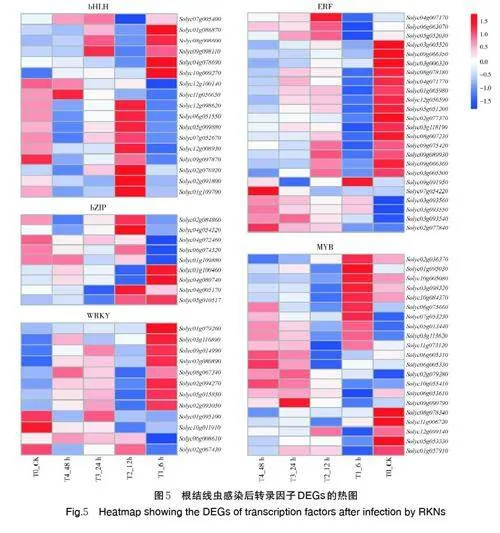
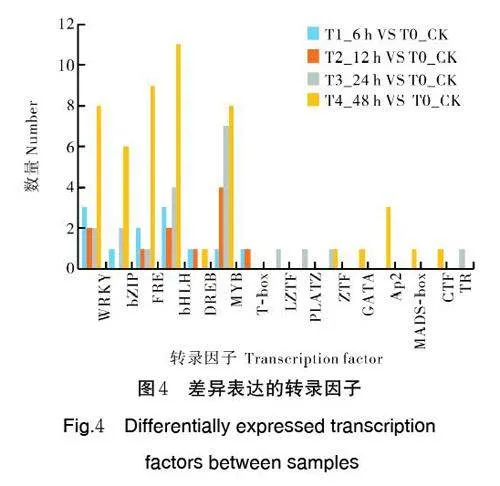
对差异表达的转录因子进行分析发现,接种南方根结线虫后6、12、24 和48 h 分别有11、11、19、50个转录因子差异表达。这些转录因子属于15 个家族,其中数量最多的为MYB 家族和bHLH 家族(均为20 个),其次是ERF 家族19 个、WRKY 家族15 个、bZIP 家族9 个(图4)。
对差异表达明显的转录因子进行分析发现,Solyc03g005520、Solyc02g094270 和Solyc09g066350显著上调,接种后48 h log2FC 分别为9.16、6.49 和6.33;Solyc02g079280、Solyc12g100140 和Solyc04g072460 显著下调,接种后48 h log2FC 分别为-2.60、-1.72 和-1.70。说明这几个转录因子可能参与番茄与南方根结线虫互作,在番茄响应南方根结线虫侵染反应中发挥着重要的调控作用(图5)。
2.6 测序结果验证
随机选取Solyc01g008370.3、Solyc01g103540.3、Solyc02g077430.3 等6 个基因进行qRT-PCR,计算其表达量并换算成log2FC,然后与RNA 测序结果进行比较(图6)。结果显示,选择的6 个基因中除Solyc01g008370.3外,其余5个基因2种方法的表达变化趋势基本一致,表明本研究RNA 测序结果较可靠。
3 讨论
转录因子在植物应对各种不良环境及生物胁迫中通过调控抗性相关基因的表达,改善植物的抗逆性。番茄基因组中WRKY、DOF、MYB、bZIP、ARF、ERF、HSF 和NAC 等转录因子通过激活或抑制不同的植物代谢活动,在番茄应对不良环境及生物胁迫中发挥重要作用[13]。本研究发现,南方根结线虫侵染早期,15 个转录因子基因家族约91 个转录因子差异表达,其中ERF、WRKY、MYB 和bHLH 家族转录因子数量最多,差异表达最显著,表明这些转录因子在番茄响应南方根结线虫侵染反应中可能发挥着重要的调控作用。
ERF 家族转录因子广泛存在植物中,研究发现ERF 转录因子通过结合在靶标基因启动子上的GCC盒(GCCGCC)调控其表达[14]。研究表明,ERF 转录因子参与调控番茄对多种病原物的抗性,但是不同的ERF 转录因子的作用机制不同[13]。SlERF1 正调控番茄乙烯依赖的致病防御途径,过表达SlERF1 基因可增强番茄果实对Rhizopus nigricans 的抗性[15]。SlERF3 在转基因番茄中的过度表达诱导了致病相关蛋白基因如PR1、PR2 和PR5 的表达,从而增强了番茄对Ralstonia solanacearum 的耐受性[16] 。SlERF84 负调控番茄对Pseudomonas syringae pv. 的免疫力,过量表达SlERF84 转基因植株具有更好的活性氧清除能力[17]。与此相类似,本研究中ERF1B(Solyc03g005520)、ERF98(Solyc09g066350)、ERF2(Solyc08g007230)在接种南方根结线虫48 h 后上调表达明显,log2FC 分别为9.16、6.33 和3.45,说明这3个ERF 转录因子在番茄响应根结线虫侵染中可能发挥着重要作用,其作用机制有待进一步探索。
WRKY 转录因子是一类进化保守的转录因子家族,它通过与靶标基因特定区域相结合,调控下游抗病基因的表达,参与调控植物的抗病防卫系统[18]。
Bhattarai 等[19]发现,SlWRKY72a/SlWRKY72b 在Mi 介导的番茄抗根结线虫反应中发挥重要作用,Sl⁃WRKY72a/SlWRKY72b 沉默可降低番茄对根结线虫的抗性。Atamian 等[20]和Chinnapandi 等[21]的研究发现, SlWRKY70 和SlWRKY45 均受外源激素水杨酸(SA)的诱导,而茉莉酸甲酯(MeJA)抑制其表达,说明它们可能通过SA 介导的信号传导路径参与调控植物的抗线虫反应。本研究进一步证实Sl‑WRKY45(Solyc02g094270)在番茄抗线虫反应中的作用,接种48 h 后SlWRKY45 上调表达明显,log2FC为6.49。
MYB 是植物界最大的转录因子家族之一,其成员在植物应对生物及非生物胁迫中发挥多种功能[22]。番茄基因组中共有127 个MYB 转录因子,研究发现12 个MYB 基因在接种假单胞菌(Pseudomo⁃nas putida)Pst DC3000 后表达显著升高,而SlMYB31 和SlMYB33 基因受到抑制;13 个MYB 基因参与调控番茄对荧光假单胞菌(Pseudomonas fluo⁃rescens)的响应。SlMYB8 在番茄对P. putida 和P.fluorescens 响应中均上调表达[23]。本研究也得出了类似的结果,接种南方根结线虫后6、12、24 和48 h 番茄基因组共有20 个MYB 基因差异表达,其中SlMYB108 (Solyc05g053330.3) 和SlMYB8(Solyc10g084370.2)2 个MYB 基因在接种48 h 后上调表达明显,log2FC 分别为4.49 和3.13。这些试验结果表明SlMYB8 在番茄响应对细菌、线虫等生物胁迫中可能发挥着重要的作用,但其作用机制是否相同有待进一步研究。
bHLH 家族转录因子因其bHLH 结构域而得名。番茄基因组中共发现了152 个bHLH 转录因子,番茄黄化卷叶病毒(tomato yellow leaf curl virus,TYLCV)感染导致4 个bHLH 转录因子(SlbHLH077、SlbHLH079、SlbHLH131、SlbHLH132)差异表达,其中在抗性株系中沉默SlbHLH131 可导致细胞死亡[24]。本研究结果与之相似,接种南方根结线虫后6、12、24 和48 h 番茄基因组共有20 个bHLH 基因差异表达,其中SlbHLH055(Solyc08g008600.3)在接种48 h 后上调表达明显,log2FC 为4.48。表明bHLH 转录因子在番茄响应根结线虫侵染中可能发挥着重要作用,但其响应途径及作用机制有待进一步研究。
参考文献References
[1] LI B,MENG X Z,SHAN L B,et al. Transcriptional regula‑
tion of pattern-triggered immunity in plants[J].Cell host amp; microbe,
2016,19(5):641-650.
[2] SEO E,CHOI D,CHOI C.Functional studies of transcription
factors involved in plant defenses in the genomics era[J].Briefings
in functional genomics,2015,14(4):260-267.
[3] JONES J T,ANNELIES H,DANCHIN ETIENNE G J,et
al.Top 10 plant-parasitic nematodes in molecular plant pathology
[J].Molecular plant pathology,2013,14(9):946-961.
[4] 彭德良. 植物线虫病害:我国粮食安全面临的重大挑战[J].
生物技术通报,2021,37(7):1-2.PENG D L.Plant nematode
diseases:serious challenges to China's food security[J]. Biotechnology
bulletin,2021,37(7):1-2(in Chinese).
[5] 王勋芳,何德琴,杨忠庆,等. 番茄根结线虫病的发生特点与
防治技术[J]. 云南农业科技,2020(3):38-39.WANG X F,
HE D Q,YANG Z Q,et al.Occurrence characteristics and control
techniques of tomato root-knot nematode disease[ J].Yunnan
agricultural science and technology,2020(3):38-39(in
Chinese).
[6] ERCOLANO M R,SANSEVERINO W,CARLI P,et al.Genetic
and genomic approaches for R-gene mediated disease resistance
in tomato:retrospects and prospects[J].Plant cell reports,
2012,31(6):973-985.
[7] ALI M A,AZEEM F,ABBAS A,et al.Transgenic strategies
for enhancement of nematode resistance in plants[J/OL].
Frontiers in plant science,2017,8:750[2022-12-08].https://
doi.org/10.3389/fpls.2017.00750.
[8] EL-SAPPAH A H,ISLAM M M,EL-AWADY H H,et al.
Tomato natural resistance genes in controlling the root-knot
nematode[J/OL]. Genes,2019,10(11):925[2022-12-08].
https:// doi.org/10.3390/genes10110925.
[9] ZHANG M,ZHANG H Y,TAN J,et al.Transcriptome analysis
of eggplant root in response to root-knot nematode infection
[J/OL]. Pathogens (Basel,Switzerland),2021,10(4):470
[2022-12-08].https://doi.org/10.3390/pathogens10040470.
[10] SHAHZAD R,JAMIL S,AHMAD S,et al. Harnessing the
potential of plant transcription factors in developing climate resilient
crops to improve global food security:current and future
perspectives[J].Saudi journal of biological sciences,2021,28
(4):2323-2341.
[11] 陆秀红,张雨,秦舒婷,等. 番茄NBS-LRR 抗根结线虫基因
同源序列的克隆与分析[J]. 华中农业大学学报,2019,38
(1):67-72.LU X H,ZHANG Y,QIN S T,et al.Cloning and
analysis of root knot nematode resistance gene of NBS-LRR
analogs from tomato[J]. Journal of Huazhong Agricultural
University,2019,38(1):67-72(in Chinese with English abstract).
[12] 唐科志,周常勇. 红橘响应褐斑病菌侵染的转录组学分析[J].
中国农业科学,2020,53(22):4584-4600.TANG K Z,ZHOU
C Y. Transcriptome analysis of Citrus reticulata blanco,cv.
hongjv infected with Alternaria alternata tangerine pathotype
[J]. Scientia agricultura sinica,2020,53(22):4584-4600(in
Chinese with English abstract).
[13] TOLOSA L N,ZHANG Z B.The role of major transcription
factors in solanaceous food crops under different stress conditions:
current and future perspectives[J/OL]. Plants (Basel,
Switzerland),2020,9(1):56[2022-12-08].https:// doi.org/
10.3390/plants9010056.
[14] KLAY I,GOUIA S,LIU M C,et al.Ethylene Response Factors
(ERF) are differentially regulated by different abiotic
stress types in tomato plants[J]. Plant science,2018,274:
137-145.
[15] PAN X Q,FU D Q,ZHU B Z,et al. Overexpression of the
ethylene response factor SlERF1 gene enhances resistance of
tomato fruit to Rhizopus nigricans[J].Postharvest biology and
technology,2013,75:28-36.
[16] PAN I C,LI C W,SU R C,et al. Ectopic expression of an
EAR motif deletion mutant of SlERF3 enhances tolerance to
salt stress and Ralstonia solanacearum in tomato[J]. Planta,
2010,232(5):1075-1086.
[17] LI Z J,TIAN Y S,XU J,et al. A tomato ERF transcription
factor,SlERF84,confers enhanced tolerance to drought and
salt stress but negatively regulates immunity against Pseudo⁃
monas syringae pv. tomato DC3000[J]. Plant physiology and
biochemistry,2018,132:683-695.
[18] MOHANTA T K,PARK Y H,BAE H H. Novel genomic
and evolutionary insight of WRKY transcription factors in
plant lineage[J/OL].Scientific reports,2016,6:37309[2022-
12-08].https://doi.org/10.1038/srep37309.
[19] BHATTARAI K K,ATAMIAN H S,KALOSHIAN I,et al.
WRKY72-type transcription factors contribute to basal immunity
in tomato and Arabidopsis as well as gene-for-gene resistance
mediated by the tomato R gene Mi-1[J].The plant journal,
2010,63(2):229-240.
[20] ATAMIAN H S,EULGEM T,KALOSHIAN I.SlWRKY70
is required for Mi-1-mediated resistance to aphids and nematodes
in tomato[J].Planta,2012,235(2):299-309.
[21] CHINNAPANDI B,BUCKI P,BRAUN MIYARA S. Sl‑
WRKY45,nematode-responsive tomato WRKY gene,enhances
susceptibility to the root knot nematode, M. javanica infection[J/
OL].Plant signaling amp; behavior,2017,12(12):e1356530[2022-
12-08].https://doi.org/0.1080/15592324.2017.1356530.
[22] AMBAWAT S,SHARMA P,YADAV N R,et al.MYB transcription
factor genes as regulators for plant responses:an overview
[J].Physiology and molecular biology of plants,2013,19
(3):307-321.
[23] LI Z J,PENG R H,TIAN Y S,et al.Genome-wide identification
and analysis of the MYB transcription factor superfamily
in Solanum lycopersicum[J].Plant amp; cell physiology,2016,57
(8):1657-1677.
[24] WANG J Y,HU Z Z,ZHAO T M,et al.Genome-wide analy‑
sis of bHLH transcription factor and involvement in the infection
by yellow leaf curl virus in tomato (Solanum lycopersi⁃
cum)[J/OL].BMC genomics,2015,16(1):39[2022-12-08].
https://doi.org/10.1186/s12864-015-1249-2.
(责任编辑:边书京)

