伴生不同作物对主栽番茄植株根系内生微生物群落结构的影响

摘要 为为解决番茄连作障碍、构建番茄可持续发展的生态栽培技术体系,设置番茄伴生生菜(A)、苋菜(B)、菜心(C)、葱(D)、薄荷(E)以及番茄单作(F)处理,在相同环境条件下进行同样栽培管理,利用IlluminaMiSeq 高通量测序平台,分析不同作物伴生及番茄单作处理下根系内生微生物多样性与群落组成。结果显示:伴生及单作番茄植株根系共有的排名前5 的优势细菌属为链霉菌属(Streptomyces)、Burkholderia-Caballeronia-Paraburkholderia、德沃斯氏菌属(Devosia)、类诺卡氏菌属(Nocardioides)、马赛菌属(Massilia);番茄伴生生菜(A)特有的优势内生细菌属为新草小螺菌属( Noviherbaspirillum),番茄伴生苋菜(B)特有的优势内生细菌属为游动放线菌属( Actinoplanes); 番茄伴生葱(D)特有的优势内生细菌属为爬管菌属(Herpetosiphon),番茄伴生薄荷(E)特有的优势内生细菌属为微杆菌属(Microbacterium),番茄单作(F)特有的优势内生细菌属包括芽孢杆菌属(Bacillus)、栖大理石菌属(Marmoricola)和糖霉菌属( Glycomyces);伴生及单作处理番茄共有的优势真菌属为油壶菌属(Olpidium)、unclassified_o_Sordariales、unclassified_p_Ascomycota,番茄伴生生菜(A)特有的优势内生真菌属为Immersiella,番茄伴生苋菜(B)特有的优势内生真菌包括念珠菌属(Candida)、unclassified_c_Agaricomycetes 和Phialemonium,番茄伴生菜心(C)特有的优势内生真菌包括Rhizophagus、Plectosphaer⁃ella、Geminibasidium,番茄伴生葱(D)特有的优势内生真菌包括unclassified_p_Chytridiomycota、unclassified_f_Ceratobasidiaceae、Ceratorhiza、unclassified_o_Boletales、unclassified_p_Basidiomycota,番茄单作(F)特有的优势内生真菌属为赤霉属(Gibberella)。结果表明,与番茄单作相比,番茄伴生不同作物使主栽番茄根系优势内生细菌和内生真菌属组成发生了变化,伴生条件下主栽番茄根系均富集了特异的优势内生细菌和真菌门、属。伴生富集的特异优势内生细菌或真菌门、属组成具有提升主栽番茄植株抵御环境生物或非生物胁迫的潜力。
关键词 番茄; 伴生; 根系; 内生微生物; 连作障碍; 环境胁迫
中图分类号 S641.2 文献标识码 A 文章编号 1000-2421(2024)01-0031-09
番茄(Solanum lycopersicum L.)为茄科茄属的1年生草本植物。2018 年至今,我国番茄栽培面积已达110.9 万 hm2,产量6 483.2 万t,产量排名世界第一[1]。广西不仅是我国秋冬蔬菜重要产地之一,同时亦是我国“南菜北运”以及供港蔬菜重要的生产基地。其中,番茄是广西秋冬蔬菜中广泛种植的种类之一,而位于右江河谷的田阳县是广西规模最大的番茄生产基地,种植番茄至今已有30 多年的历史。2017 年田阳县番茄栽培面积达1.9 万hm2,产量达92.6 万t[2],种植番茄是当地农户实现脱贫致富以及乡村振兴的重要途径之一。然而,长期种植番茄亦导致广西传统的番茄产地发生了严重的连作障碍现象,出现了土壤酸化、土壤肥力下降、土壤健康受损、土壤病害频发而导致番茄产量与品质下降日趋严重[3-4]。对此,广大番茄生产者普遍采用溴甲烷、速克灵、威百亩等药剂进行化学防治。化学农药存在着污染环境、杀死非靶标生物、使病原生物抗药性和危害日趋加重等缺点,导致整个农田生态系统遭受不同程度的破坏,发展可持续的生态高值农业迫在眉睫。迄今的研究发现,植物对土传病害的抗性与根际土壤微生物紧密相关[5]。已有研究表明,土壤微生物群落结构的丰度越大、物种的均匀性和多样性指数越高,抑制土传病害的能力越强[6]。伴生(间套作)栽培是我国优秀的传统栽培农艺措施,不仅有助于改良土壤理化性状,而且有利于提高土壤肥力和土壤微生物多样性,从而有益于维护土壤健康[7]。杨瑞娟等[8]发现禾本科作物伴生番茄具有抑制根结线虫,提高根际土壤酶活性的效果;谢华[9]发现洋葱伴生番茄提高了番茄植株所含的N、P、K、Ca 和Si 的含量;付彦祥等[10]发现洋葱伴生番茄改变了番茄根际土壤细菌和真菌群落组成,有益细菌相对丰度显著提高,致病真菌属相对丰度显著降低;李红玉[11]发现番茄伴生洋葱,不仅番茄植株根际土壤微生物群落结构改变,而且番茄植株根系防御酶活性及抗病相关基因表达亦随之提高。
然而,伴生栽培除了提高作物根际微环境土壤肥力、提升根际土壤微生物多样性外,是否亦影响了主栽番茄植株的抗性,至今仍鲜见相关研究报道。
植物内生微生物(endophyte)指能够生活在健康植物或组织中生存而不引起寄主植物明显病变的一大类微生物,主要包括细菌、真菌和放线菌[12]。其中,内生细菌是内生微生物的重要组成部分,不仅具有固氮、促生、增强宿主抗性及生物防治等功效,而且存在于根部的内生细菌数量远超其他组织[13];内生真菌亦不仅有助于提高宿主对土壤养分的吸收,还有助于增强宿主的抗逆能力[14]。为此,本研究设置番茄伴生生菜(A)、苋菜(B)、菜心(C)、葱(D)、薄荷(E)以及番茄单作(F)处理,利用Illumina MiSeq 高通量测序平台,分析不同作物伴生及番茄单作根系内生微生物多样性与群落组成,旨在为解决番茄连作障碍、构建番茄可持续发展的生态栽培技术体系,以及开发利用有益微生物资源提供理论依据与技术支撑。
1 材料与方法
1.1 试验材料
主栽番茄品种中研 868(中研益农种苗科技有限公司选育)、伴生作物菜心品种油青 31 号(兴宁市庆丰盈科种子有限公司选育);苋菜品种、台选圆叶红苋菜 262(兴宁市庆丰盈科种子有限公司选育)、薄荷品种香草薄荷(江苏百萌生态发展有限公司选育)、生菜品种特种生菜(聊城华煜农业科技有限公司选育)、葱品种香葱(北京花儿朵朵花仙子农业有限公司选育)均购自南宁市蔬菜种子市场。
1.2 试验地概况
试验于2020 年6-12 月在广西大学农学院蔬菜基地(108°17′25″E,22°51′02″N)进行。采用桶栽方式(桶高 35 cm,半径 30 cm),每个桶中分别装入 20 kg土。土壤类型为赤红壤,理化性状如下:pH 5.71,有机质 8.42 mg/kg,全氮 0.51 mg/kg,全磷 0.67 mg/kg,全钾 7.21 g/kg,速效磷 0.59 mg/kg,速效钾 51.01mg/kg,碱解氮 13.17 mg/kg。
1.3 试验设计
试验共设置6 个处理:番茄伴生生菜(Lactuca sa⁃tiva)(A)、番茄伴生苋菜(Amaranthus tricolor)(B)、番茄伴生菜心(Brassica chinensis var. parachinensis)(C)、番茄伴生葱(Allium fistulosum)(D)、番茄伴生薄荷(Mentha canadensis)(E)及番茄单作(F)。
伴生栽培处理以番茄植株为中心,半径 10 cm处环形种植不同伴生作物,上述6 个处理均同期育苗与定植。番茄生长期间,灌溉、除草等所有生产措施均按常规方法相同管理。
1.4 样品采集与处理
番茄植株根系样品于 2020 年 9 月采集。每个处理随机抽取3 株长势一致的健壮番茄植株,用消毒铁铲铲松植株周围半径约25 cm 的圆圈土层,然后手握植株茎基部,连根拔起整个植株。采用抖根法[15-16]进行采集,抖落根际土壤后,用自来水冲洗植株根系,接着用无菌水冲洗根系,反复多次,直至根系表面无杂质,用消毒好的剪刀剪取植株根系样品,装入无菌自封袋带回实验室,用于根系内生微生物群落结构分析。
1.5 根系样品总DNA提取、PCR扩增和序列测定
根系样品总DNA 提取、PCR 扩增和序列测定委托上海美吉生物医药科技有限公司进行。利用Axy‑PrepDNA 凝胶回收试剂盒根据FastDNA® Spin Kitfor Soil 试剂盒(MP Biomedicals,美国)说明书 抽提DNA,DNA 浓度和纯度使用NanoDrop2000 分光光度计(Thermo Fisher Scientific,美国)检测,在ABIGeneAmp®9700 上进行PCR 扩增,根系内生细菌、真菌PCR 测序引物如表1 所示。
Illumina MiSeq 测序:同一样本的PCR 产物采用AxyPrep DNAGel Extraction Kit (Axygen Biosciences,美国)进行回收产物纯化,混合后使用2% 琼脂糖凝胶进行回收检测,并采用Quantus™ Fluorometer(Promega,USA) 对回收产物进行检测定量。使用NEXTFLEX® RapidDNA-Seq Kit 进行建库。利用Illumina 公司的MiSeq PE250 平台进行测序(上海美吉生物医药科技有限公司)。
1.6 统计分析
数据采用Excel 2019 和IBM SPSS Statistics23统计软件进行统计分析,利用上海美吉生物医药科技有限公司的I-sanger 云数据分析平台进行在线数据分析。采用Shannon 指数和Simpson 指数表示内生细菌多样性,Ace 指数和Chao1 指数分析细菌丰富度。
2 结果与分析
2.1 伴生处理番茄植株根系内生细菌多样性
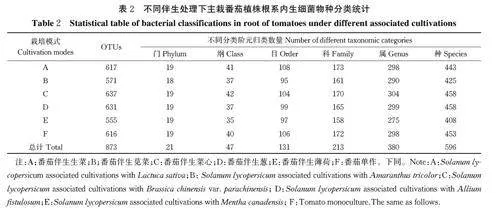
1)番茄根系内生细菌OTUs(operational taxonomicunits,分类操作单元)聚类分析。由表2可知,基于97%相似水平对样品序列不同分类水平进行聚类分析,发现6个处理番茄根系内生细菌群落可分为21门、47纲、131 目、213 科、380 属、596 种和873 个OTUs。
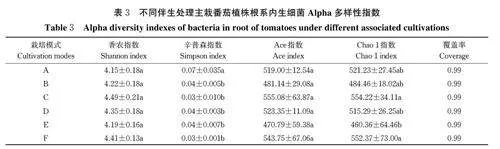
2) 番茄根系内生细菌Alpha 多样性。由表3 可知,番茄与其他蔬菜伴生或者单作时,其植株根系内生细菌以及真菌的覆盖率均为0.99(gt;0.97),表明测序结果可代表样本中细菌及真菌多样性。伴生不同作物主栽番茄植株根系内生细菌Shannon 指数与番茄单作之间并不存在显著差异;同时不同伴生处理之间亦不存在显著差异;除伴生薄荷处理外,其余伴生处理与番茄单作(F)Ace 和Chao1 指数亦不存在显著差异。上述结果表明:本研究5 种不同作物伴生栽培番茄均对主栽番茄植株根系内生细菌的多样性和丰度没有显著影响。
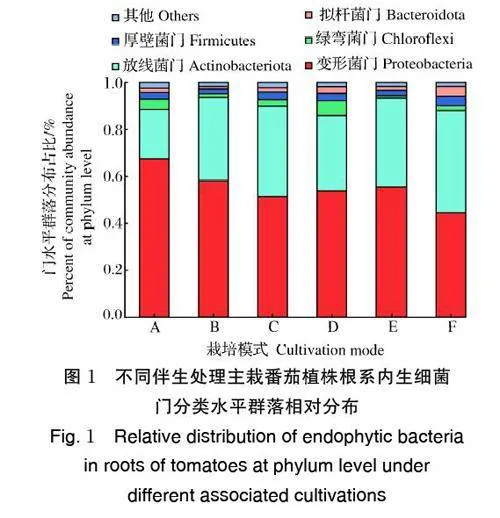
3)番茄根系内生细菌门分类水平。由图1 可知, 植株根系优势内生细菌门分类水平(相对丰度占比大于1%)为:变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)。与番茄单作(F)相比,伴生栽培均使番茄植株根系中,富集了拟杆菌门细菌这一特异的优势内生细菌门类。同时,植株根系优势内生细菌门类丰度占比与排序发生变化,简言之,伴生栽培处理不仅改变了主栽番茄植株根系优势内生细菌的群落组成,同时亦改变了根系优势内生细菌门类的丰度占比。
4)番茄根系内生细菌属分类水平。番茄单作和不同伴生处理番茄植株根系检测出优势内生细菌属(相对丰度占比大于1%)33个(图2)。番茄和生菜(A)、苋菜(B)、菜心(C)、葱(D)、薄荷(E)以及番茄单作(F)的伴生处理下番茄植株根系优势内生细菌属分别有22、20、22、19、23、23 个。其中,番茄伴生与单作处理共有丰度占比排名前5 的细菌属为:链霉菌属(Streptomy⁃ces)、Burkholderia-Caballeronia-Paraburkholderia 、德沃斯氏菌属(Devosia)、类诺卡氏菌属(Nocardioi⁃des)、马赛菌属(Massilia)。相较于番茄单作(F),慢生根瘤菌属( Bradyrhizobium)、不黏柄菌属(Asticca⁃caulis)是番茄伴生处理A 到E 所有的优势内生细菌属。番茄伴生生菜(A)特有的优势内生细菌属为新草小螺菌属 (Noviherbaspirillum),番茄伴生苋菜(B)特有的优势内生细菌属为游动放线菌属 (Acti⁃noplanes), 番茄伴生葱(D)特有的优势内生细菌属为爬管菌属(Herpetosiphon),番茄伴生薄荷(E)特有的优势内生细菌属为微杆菌属(Microbacterium)。
番茄单作(F)特有的优势内生细菌属包括芽孢杆菌属(Bacillus)、栖大理石菌属(Marmoricola)和糖霉菌属( Glycomyces)。结果表明:与番茄单作相比,虽然番茄伴生不同作物并没有提高主栽番茄植株根系内生细菌属分类水平组成,但改变了主栽番茄根系内生中优势细菌属分类水平的丰度占比。
2.2 伴生处理番茄植株根系内生真菌多样性
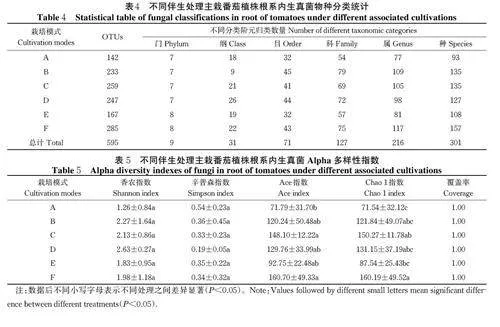
1)番茄根系内生真菌OTUs 聚类分析。基于97% 相似水平对样品序列不同分类水平进行聚类分析(表4),发现6 个处理番茄根系内生真菌群落可分为9 门、31 纲、71 目、127 科、216 属、301 种和595 个OTUs。
2)番茄根系内生真菌Alpha 多样性。 由表5 可知,伴生不同作物主栽番茄植株根系内生真菌香农指数和辛普森指数与番茄单作之间并不存在显著差异;同时不同伴生处理之间亦不存在显著差异;此外,表征根系内生真菌丰富度的Ace 和Chao 1 指数,除伴生薄荷(E)和生菜(A)处理外,其余不同伴生处理与番茄单作(F)之间亦不存在显著差异。上述结果表明:本研究中5 种不同作物伴生番茄处理,同样无助于显著提高主栽番茄植株根系内生真菌的多样性和丰富度。
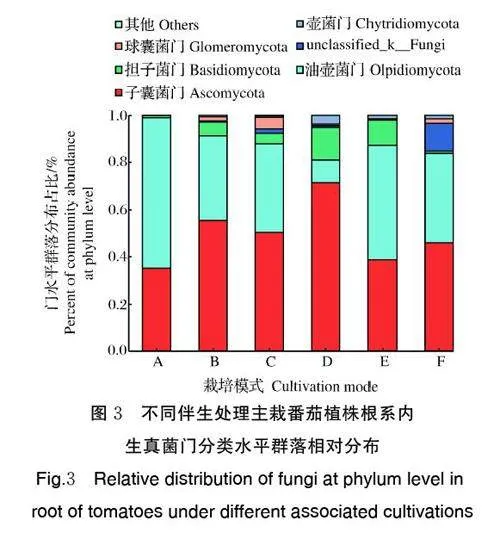
3)番茄根系内生真菌门分类水平。由图3 可知,番茄单作处理植株根系优势内生真菌门类为:子囊菌门(Ascomycota)、油壶菌门(Olpidiomycota)、担子菌门(Basidiomycota)、unclassified_k_Fungi、球 囊 菌门(Glomeromycota)和壶菌门(Chytridiomycota)。番茄伴生生菜(A)、苋菜(B)、菜心(C)、葱(D)、薄荷(E)以及番茄单作(F)的优势内生真菌门类(丰度占比大于1%)数量分别为3、4、5、4、4、5。其中主要区别在于缺少unclassified_k_Fungi。这一结果表明:伴生处理均减少了主栽番茄植株根系中未分类的优势内生真菌门类数量,但减少效果依伴生作物的种类而异。
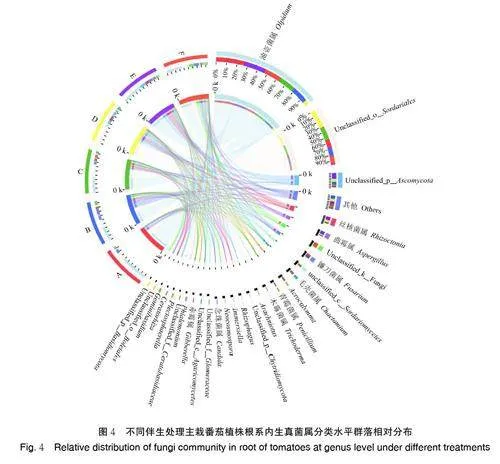
4) 番茄根系内生真菌属分类水平。由图4 可知,番茄单作和不同伴生处理番茄植株根系优势内生真菌属(丰度占比大于1%)检测出28 个。番茄和生菜(A)、苋菜(B)、菜心(C)、葱(D)、薄荷(E)以及番茄单作(F)的伴生处理番茄植株根系优势内生真菌属分别是5、16、13、17、10、11 个。其中,仅油壶菌属(Olpidium)、unclassified_o_Sordariales、unclassified_p_Ascomycota 为番茄单作和伴生处理中番茄植株根系中共有的优势内生真菌属。相较于番茄单作(F),丝核菌属(Rhizoctonia) 和Acrocalymma 是番茄伴生苋菜(B)、菜心(C)、葱(D)、薄荷(E)所有的优势内生真菌属。番茄伴生生菜(A)特有的优势内生真菌属为Immersiella,番茄伴生苋菜(B)特有的优势内生真菌包括念珠菌属(Candida)、unclassified_c_Agaricomycetes 和Phialemonium,番茄伴生菜心(C)特有的优势内生真菌包括Rhizophagus、Plectosphae⁃rella、Geminibasidium,番茄伴生葱(D)特有的优势内生真菌包括unclassified_p_Chytridiomycota、unclassified_f_Ceratobasidiaceae、Ceratorhiza、unclassified_o_Boletales、unclassified_p_Basidiomycota。由上述结果可知,与番茄单作相比,伴生不同作物导致番茄植株根系优势内生真菌属数量发生变化,并且改变了主栽番茄根系内生中优势细菌属分类水平的丰度占比。
3 讨论
植物内生菌广泛存在于植物各器官组织中且根部内生细菌数量远超过其他组织。内生细菌具有固氮、促进植物生长、增强植物抗性、 生物防治[17]等方面的作用。吴绍军等[18]研究发现西瓜伴生大蒜栽培可以显著降低由于连作引发的西瓜枯萎病的发病率,有效改善根际周围土壤菌落平衡状态和土壤酶活性,对于破除西瓜连作障碍有一定的效果。
与番茄单作(F)相比,伴生栽培处理不仅改变了主栽番茄植株根系优势内生细菌门类群落组成,而且还改变了根系内优势内生细菌门类的丰度占比。此外,变形菌门(Proteobacteria)细菌均是伴生处理番茄根系的绝对优势内生细菌门类,其丰度占比均超过50%。Tian 等[19]曾发现,健康番茄植株根系内生细菌优势菌群为变形菌门(Proteobacteria)细菌;由此推断,伴生不同作物处理均有助于番茄植株保持健康状态。
与番茄单作(F)处理相比,伴生处理虽然无助于显著提高番茄植株根系内生细菌多样性,但改变了内生细菌的丰富度。慢生根瘤菌属(Bradyrhizobi⁃um)是伴生处理优势细菌属。研究已证实,慢生根瘤菌能提升根瘤菌与豆科植物的共生效率[20-21],Cerezini等[22]研究表明Bradyrhizobium 菌株影响宿主植物对干旱的反应,和大豆抗旱性有一定的相关性,Bianucci等[23]研究发现大豆根瘤菌的共生物种减轻了大豆中的砷毒性。游动放线菌属(Actinoplanes)属细菌是番茄伴生苋菜(B)特有的优势细菌属;El-tarabily[24]的研究发现Actinoplanes missouriensis 分离株具有生物防治羽扇豆根腐病的潜力。爬管菌属Herpe⁃tosiphon 细菌是番茄伴生葱(D)的特有优势细菌属;Livingstone 等[25]偶然分离出1 种新的环境菌株(CA052B),它被确定为爬管菌属(Herpetosiphon)的成员,发现CA052B 可以捕食大肠杆菌、肺炎克雷伯菌、奇异变形杆菌、金黄色葡萄球菌,对于根系内生有害微生物有一定的抑制作用。
与番茄单作(F)处理相比,伴生处理均减少了主栽番茄植株根系中未分类的优势内生真菌门类数量,但减少效果依伴生作物的种类而异。与番茄单作(F)相比,伴生处理不仅改变了主栽番茄根系内生真菌优势菌属的组成;而且提升了番茄植株根系特有的优势真菌属分类水平数量。其中,番茄伴生苋菜(B)、番茄伴生菜心(C)和番茄伴生葱(D)根系特有的优势真菌属分类水平数量与番茄单作(F)处理相比更多。
由于根系内生真菌是与植物经过长期共生演化形成,能够诱导植物抗性及养分吸收能力发生改变[26]。由此推测,伴生不同作物介导主栽作物-番茄植株根系内生真菌群落结构发生了显著变化,伴生处理中主栽番茄植株吸收养分水平以及抵御生物或非生物环境胁迫能力同样发生了变化。
综上,伴生栽培处理具有改变主栽番茄植株根系内生细菌和真菌群落门、属分类水平组成的效果。主栽番茄植株根系中,富集的特异优势内生细菌或真菌门、属具有提升主栽番茄植株抵御生物或非生物环境胁迫的潜力,对番茄克服连作障碍具有一定的理论和实践指导意义。
参考文献References
[1] 李君明,项朝阳,王孝宣,等“. 十三五”我国番茄产业现状及展
望[J]. 中国蔬菜,2021(2):13-20.LI J M,XIANG C Y,WANG
X X,et al. Current situation of tomato industry in China during
“The Thirteenth Five-Year Plan” period and future prospect[J].
China vegetables,2021(2):13-20 (in Chinese with English abstract).
[2] 燕在珍. 广西和山东番茄主产区产业发展及土地利用效益比较
研究[D]. 南宁:广西大学,2019.YAN Z Z.Comparative research
on industrial development and land use efficiency of main tomato
production areas in Guangxi and Shandong [D]. Nanning:
Guangxi University,2019( in Chinese with English abstract).
[3] 杨尚东,李荣坦,吴俊,等. 番茄连作与轮作土壤生物学特性及
细菌群落结构的比较[J]. 生态环境学报,2016,25(1):76-83.
YANG S D,LI R T,WU J,et al. Comparison of soil microbial
properties and bacterial community structure in continuous cropping
and rotation fields of tomatoes[J].Ecology and environmental
sciences,2016,25(1):76-83( in Chinese with English abstract).
[4] 孙光闻,陈日远,刘厚诚. 设施蔬菜连作障碍原因及防治措施
[J]. 农业工程学报,2005,21(S2):184-188.SUN G W,CHEN
R Y,LIU H C.Causes and control measures for continuous cropping
obstacles in protected vegetable cultivation[J].Transactions
of the CSAE,2005,21(S2):184-188 (in Chinese with English
abstract).
[5] VAN ELSAS J D,GARBEVA P,SALLES J.Effects of agronomical
measures on the microbial diversity of soils as related to
the suppression of soil-borne plant pathogens[J].Biodegradation,
2002,13(1):29-40.
[6] JANVIER C,VILLENEUVE F,ALABOUVETTE C,et al.
Soil health through soil disease suppression:which strategy from
descriptors to indicators?[J]. Soil biology and biochemistry,
2007,39(1):1-23.
[7] TIROESELE B, MATSHELA O. The effect of companion
planting on the abundance of cabbage aphid, Brevicoryne brassi⁃
cae L., on kale (Brassica oleracea var. acephala)[J]. Journal of
plant and pest science, 2015, 2(3):57-65.
[8] 杨瑞娟,王腾飞,周希,等. 禾本科作物伴生对番茄根区土壤酶
活性、微生物及根结线虫的影响[J]. 中国蔬菜,2017(3):38-42.
YANG R J,WANG T F,ZHOU X,et al.Effects of companion
cereal crops on soil enzyme activities,microorganism and root
knot nematodes of tomato rhizosphere[J].China vegetables,2017
(3):38-42( in Chinese with English abstract).
[9] 谢华. 生物炭和伴生对连作番茄生长发育及土壤微生物的影响
[D]. 哈尔滨:东北农业大学,2020.XIE H.Effects of biochar and
intercropping with potato onion on growth and development of
continuously monocropped tomato and soil microbial communities
[D].Harbin:Northeast Agricultural University,2020( in Chinese
with English abstract).
[10] 付彦祥, 李乃荟, 刘佳遥, 等. 伴生分蘖洋葱对番茄根际微生
物群落结构的影响[J]. 中国蔬菜, 2020(6): 49-57. FU Y X,
LI N H,LIU J Y,et al. Effects of concomitant tillering onion on
microbial community structure in tomato rhizosphere soil[J].
China vegetable, 2020( 6): 49-57( in Chinese with English abstract).
[11] 李红玉. 分蘖洋葱伴生番茄根际微生物对番茄黄萎病抗性的影
响[D]. 哈尔滨:东北农业大学,2018.LI H Y.Effect of rhizosphere
microorganism of tomato intercropping with potato onion
on Verticillium wilt resistance in tomato[D].Harbin:Northeast
Agricultural University,2018( in Chinese with English abstract).
[12] HALLMANN J,QUADT-HALLMANN A,MAHAFFEE W
F,et al. Bacterial endophytes in agricultural crops[J]. Canadian
journal of microbiology,1997,43(10):895-914.
[13] SUN L,QIU F B,ZHANG X X,et al.Endophytic bacterial diversity
in rice (Oryza sativa L.) roots estimated by 16S rDNA
sequence analysis[J].Microbial ecology,2008,55(3):415-424.
[14] ROMERO F M,MARINA M,PIECKENSTAIN F L. The
communities of tomato (Solanum lycopersicum L.) leaf endophytic
bacteria,analyzed by 16S-ribosomal RNA gene pyrosequencing
[J].FEMS microbiology letters,2014,351(2):187-194.
[15] 庞师婵,郭霜,任奎瑜,等. 番茄/茄子嫁接对其根际土壤生物学
性状及细菌群落结构的影响[J]. 园艺学报,2020,47(2):253-
263.PANG S C,GUO S,REN K Y,et al.Impact of grafting on
soil microbial properties and bacterial community structure in tomato
rhizosphere[J].Acta horticulturae sinica,2020,47(2):253-
263( in Chinese with English abstract).
[16] 罗俊,林兆里,李诗燕,等. 不同土壤改良措施对机械压实酸化
蔗地土壤理化性质及微生物群落结构的影响[J]. 作物学报,
2020,46(4):596-613.LUO J,LIN Z L,LI S Y,et al.Effects of
different soil improvement measures on soil physicochemical
properties and microbial community structures in mechanically
compacted acidified sugarcane field[J]. Acta agronomica sinica,
2020,46(4):596-613( in Chinese with English abstract).
[17] LU H,ZOU W X,MENG J C,et al.New bioactive metabolites
produced by Colletotrichum sp.,an endophytic fungus in Artemis⁃
ia annua[J].Plant science,2000,151(1):67-73.
[18] 吴绍军,孟佳丽,沈虹,等. 连作西瓜抗逆系统及土壤微生态对
大蒜伴生的响应[J]. 西北植物学报,2021,41(4):635-642.WU
S J,MENG J L,SHEN H,et al. Response of continuous cropping
watermelon resistance system and soil micro-ecology to associative
garlic[J]. Acta botanica boreali-occidentalia sinica,
2021,41(4):635-642( in Chinese with English abstract).
[19] TIAN B Y, CAO Y, ZHANG K Q. Metagenomic insights into
communities, functions of endophytes and their associates with
infection by root-knot nematode, Meloidogyne incognita, in tomato
roots[J/OL]. Scientific reports, 2015, 5:17087[2022-09-
06].https://doi.org/10.1038/srep17087.
[20] DE ALMEIDA LEITE R , MARTINS L C, DOS SANTOS
FRANÇA FERREIr L V, et al. Co-inoculation of Rhizobium
and Bradyrhizobium promotes growth and yield of common
beans[J/OL]. Applied soil ecology, 2022, 172:104356[2022-
09-06].https://doi.org/10.1016/j.apsoil.2021.104356.
[21] DA CONCEIÇÃO JESUS E,DE ALMEIDA LEITE R,DO
AMARAL BASTOS R,et al. Co-inoculation of Bradyrhizobi⁃
um stimulates the symbiosis efficiency of Rhizobium with common
bean[J].Plant and soil,2018,425(1):201-215.
[22] CEREZINI P,KUWANO B H,GRUNVALD A K,et al.Soybean
tolerance to drought depends on the associated Bradyrhizo⁃
bium strain[J]. Brazilian journal of microbiology,2020,51(4):
1977-1986.
[23] BIANUCCI E,GODOY A,FURLAN A,et al.Arsenic toxicity
in soybean alleviated by a symbiotic species of Bradyrhizobium
[J].Symbiosis,2018,74(3):167-176.
[24] EL-TARABILY K A.An endophytic chitinase-producing isolate
of Actinoplanes missouriensis,with potential for biological control
of root rot of lupin caused by Plectosporium tabacinum[J].
Australian journal of botany,2003,51(3):257-266.
[25] LIVINGSTONE P G,MORPHEW R M,COOKSON A R,et
al. Genome analysis,metabolic potential,and predatory capabilities
of Herpetosiphon llansteffanense sp. nov[J/OL].Applied and
environmental microbiology,2018,84(22):e01040-18[2022-09-
06].https://doi.org/10.1128/AEM.01040-18.
[26] PURAHONG W,HYDE K D. Effects of fungal endophytes on
grass and non-grass litter decomposition rates[J].Fungal diversity,
2011,47(1):1-7.
(责任编辑:张志钰)

