基于系统药理学和分子对接探讨浙贝母-瓜蒌配伍调控慢性阻塞性肺病并发心脏衰竭的作用机制











摘要:基于GEO数据库挖掘慢性阻塞性肺疾病(COPD)和心力衰竭(HF)关联靶点,检索浙贝母、瓜蒌化学成分及靶点,以获得其调控COPD并发HF潜在靶点,挖掘靶点功能及通路注释分析,构建组织特异性蛋白相互作用(PPI)网络。浙贝母-瓜蒌影响COPD并发HF进展共涉及靶点227个,包括表达上调基因153个,表达下调基因74个;网络拓扑学分析显示PPI网络平均介数为0.4,平均度值为1.83,关键靶点包括RPS23、SNU13、NOL6、ELAVL1、NCL等;细胞组分定位于内膜系统、核内体和细胞外囊泡;生物学过程涉及囊泡介导的运输、基于微管的运动、细胞内蛋白质运输等;信号通路涉及MAPK信号传导途径;MCODE分析发现Cluster 1涉及TKT、ENO1、NCL、KIF1B等,参与调控驱动蛋白、雌激素的高尔基体运输;Cluster 2涉及SIN3B、PHF20、CTBP1、XPNPEP1等,参与调控组蛋白反应;心耳、左心室、肺的组织特异性PPI网络提示浙贝母-瓜蒌配伍可能通过调控ELAVL1-ENO1-NCL轴影响COPD并发HF进展;分子对接表明其“宽胸散结”主要活性成分瓜蒌酸、“化痰散结”主要成分贝母新碱与ELAVL1、ENO1、NCL蛋白质靶标的结合高度稳定,且贝母新碱与靶蛋白结合力强于瓜蒌酸,体现两者配伍后先治肺再调心,相须为用以实现心肺共治的作用特点。
关键词:浙贝母;瓜蒌;慢性阻塞性肺病;心脏衰竭;系统药理学
中图分类号:R285"" 文献标志码:A"" 文章编号:1002-4026(2024)04-0045-11
开放科学(资源服务)标志码(OSID):
The mechanism of Fritillariae Thunbergii Bulbus-Trichosanthis Fructu pairing
in regulating heart failure complicated by chronic obstructive pulmonary
disease based on systems pharmacology and molecular docking
FANG Mengxiang1 ,CHENG Cheng2,CAO Mingchen2*,REN Wei2,YANG Zhiwei2,LI Wenjing2,XIN Xiaowei2 ,LIU Yuefen2,XU Long2
(1. The Second Traditional Chinese Medicine Hospital of Qingdao West Coast New District, Qingdao 266427, China;
2. The Affiliated Hospital of Qingdao University, Qingdao 266300, China)
Abstract∶We used the Gene Expression Omnibus database to identify targets associated with chronic obstructive pulmonary disease (COPD) and heart failure(HF). Then, we explored the chemical composition and targets of Fritillaria thunbergii-Trichosanthis fructus to determine their potential to regulate COPD complicated by HF. We analyzed the target function and pathway annotation to create a network of tissue-specific protein-protein interactions (PPI).A total of 227 targets were involved in regulating COPD complicated by HF progression through Fritillaria thunbergii-Trichosanthis fructus, including 153 upregulated and 74 downregulated genes.Topological analysis showed that the average median of the PPI network was 0.4, and the average degree value was 1.83, with key targets including RPS23, SNU13, NOL6, ELAVL1. The cellular components were mainly located in the endomembrane system, nuclear endosomes, and extracellular vesicles. Biological processes mainly involved vesicle-mediated transport, microtubule-based motility, and intracellular protein transport.The relevant signaling pathway was the MAPK signaling pathway.MCODE analysis revealed two core clusters: Cluster 1 involves genes such as TKT,ENO1, NCL, and KIF1B, which are involved in regulating the Golgi transport of kinesin and estrogen, and Cluster 2 involves genes such as SIN3B, PHF20, CTBP1, and XPNPEP1, which are involved in the regulation of histone-associated responses.Tissue-specific PPI networks in the auricles, left ventricle, and lungs suggest that the Fritillaria thunbergii-Trichosanthis fructus pairing may affect the progression of COPD complicated by HF through the regulation of the ELAVL1-ENO1-NCL axis.Molecular docking showed that the binding of trichosanic acid, the main active ingredient involved in relieving the chest and dispersing mass, and peimisine, the main ingredient involved in dissipating phlegm and dispersing mass, to the protein targets ELAVL1, ENO1, and NCL was highly stable, and that the binding of peimisine to said three target proteins was stronger than that of trichosanic acid.This indicates that the combination of the two ingredients is first used to treat the lungs and then to regulate the heart, and that they are mutually necessary, resulting in therapeutic effects on both the heart and lungs.
Key words∶ Fritillariae Thunbergii Bulbus ;Trichosanthis Fructus; chronic obstructive pulmonary disease; heart failure; systems pharmacology
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种进行性的以不可逆气流受限为特点的慢性气道炎症性疾病,因高患病率和病死率,成为目前世界范围内重要的公共卫生问题之一[1]。随着COPD的进展,约有25%的患者后期发展为持续性肺动脉高压,心室结构发生病变,出现心力衰竭(heart failure,HF)等并发症,严重影响COPD预后[2]。COPD相关心衰(以下简称COPD-HF)主要临床表现为心悸、胸闷、咳嗽气喘、不能平卧、吐泡沫样痰、紫绀、少尿、水肿、上腹部胀满和疼痛、食欲不振、颈静脉怒张、肝脏肿大等,在中医学属于“喘证”“水肿”“痰饮”范畴,主要病机在于痰饮上凌心肺所致,由于肺、脾、肾功能失调导致津液代谢失常、水液停聚于肺部,血气长期运行不畅、心脉瘀阻[3]。“其人喘满,心下痞坚,面色黝黑”与心肺功能受损、肝脾充血肿大及缺血缺氧等COPD相关心脏衰竭表现一致。
目前COPD治疗中常用支气管舒张剂、糖皮质激素等,合并心衰时应用抗血小板类、他汀类药物等。这些药物短期内可有效缓解症状并减少急性加重次数,但长期用药引发的副作用如耐药性、多重感染、消化道溃疡、免疫力低下、骨质疏松、肝损伤等问题不容忽视[4-5]。浙贝母-瓜蒌(Fritillariae Thunbergii Bulbus-Trichosanthis Fructus,FTBTF)配伍是中医治疗肺部疾病常用的药对,浙贝母归肺、心经,具有清热化痰散结、润肺止咳之功,瓜蒌甘寒而润心肺,善祛痰散结、清热涤痰、利气润燥,两者相须为用,以增强清肺、化痰、止咳之功效。中医学认为两者均作用于肺、心,可能在COPD相关心脏衰竭的治疗中有一定的价值,但目前尚无这一药对在COPD合并心衰治疗相关的分子机制研究。
目前,系统药理学、基因组学和生物信息学等新兴学科的不断发展,促进多学科技术交叉应用融合,系统药理学研究思路符合中药作用于人体时表现出来的整体性、协同性等特点,有助于发现中药“新功能”及临床应用的新途径,更好地指导临床合理用药。
1 研究方法
1.1 COPD-HF相关数据集的预处理
以关键字“chronic obstructive pulmonary disease”、“heart failure”检索GEO基因表达综合数据库(http://www.ncbi.nlm.nih.gov/geo/)数据库,分别获得COPD和HF相关数据集;基于R软件包inSilicoMerging对HF的数据集合并,合并矩阵后应用Empirical Bayes法去除批次效应。
1.2 差异表达基因(differential expressed genes, DEGs)分析
R语言的“sva”包获取去除批次效应后的归一化基因表达矩阵文件,“limma”包分析获取DEGs;t检验法计算的P值,Benjamini和Hochberg法计算调整后的P值。
1.3 浙贝母-瓜蒌活性小分子配体库构建及靶点筛选
基于中药系统药理学数据库与分析平台(TCMSP, http://tcmspw.com/tcmsp.php )、BATMAN-TCM数据库 (http://bionet.ncpsb.org/batman-tcm/),检索浙贝母、瓜蒌的化学成分及靶点信息,下载活性化合物的SMILES格式,整理涉及的靶点信息。
1.4 FTBTF-COPD-HF靶点富集
FUNRICH软件将FTBTF活性成分靶点蛋白与已筛选的COPD-HF所有 Gene Symbol (relevance score≥ 0.19)富集靶点蛋白,获得FTBTF-COPD-HF的相关富集靶点?厱
1.5 构建蛋白相互作用网络(protein-protein interaction networks, PPI)
FTBTF-COPD-HF相应的靶点信息映射至String 数据库,设置Organism为“homo sapines”后,计算每个蛋白相互作用程度的P值,设置为最高置信度(score≥0.95)后,选取P>0.9的最高置信度的蛋白关系,将分析结果导入Cytoscape软件可视化,Network Analysis插件展开网络拓扑学分析,构建FTBTF-COPD-HF靶点的PPI网络图。
1.6 多数据库联合挖掘靶点功能及通路注释分析
对于每个给定的基因列表,使用GO生物过程、KEGG途径、Reactome基因集的本体论来源开展生物学途径和信号通路富集分析;基因组中的所有基因都被作为富集背景,筛选标准为Plt;0.01,最小计数为3,观察到计数与偶然预期计数之间比率gt;1.5的基因被富集,并根据相似性归入集群;多重检验规则根据累积超几何分布计算P值,Benjamini-Hochberg程序计算q值;Kappa分数作为相似度指标(>0.3)对富集基因分层聚类。
1.7 中枢基因的鉴定和验证
基因的模块内连接性等于该基因与该模块中其他基因之间的相关程度之和,通过分子复合物检测方法(molecular complex detection, MCODE)插件识别该PPI网络中的中枢模块。
1.8 构建组织特异性PPI网络
FTBTF-COPD-HF的富集基因集映射至DifferentialNet数据库,分别选取人体组织类型为心耳、左心室、肺,构建组织特异性表达的PPI表达网络。
1.9 分子对接实验
基于计算机蛋白-配体对接软件AutodockVina 1.2.2(http://autodock.scripps.edu/)评估候选小分子与其靶标之间的结合能和相互作用模式并用于模型可视化,从PubChem化合物数据库(https://pubchem.ncbi.nlm.nih.gov/)中获得活性化合物分子结构;从PDB(http://www.rcsb.org/)下载获取蛋白的3D结构;首先准备蛋白和配体文件,将所有蛋白质和分子文件都转换为PDBQT格式,去除了所有水分子,并添加极性氢原子。网格框居中以覆盖每个蛋白质的结构域并适应自由分子运动。对接口袋设置为一个3 nm×3 nm×3 nm的正方体口袋,格点距离为0.05 nm。
2 结果与分析
2.1 COPD-HF数据集的分析前预处理
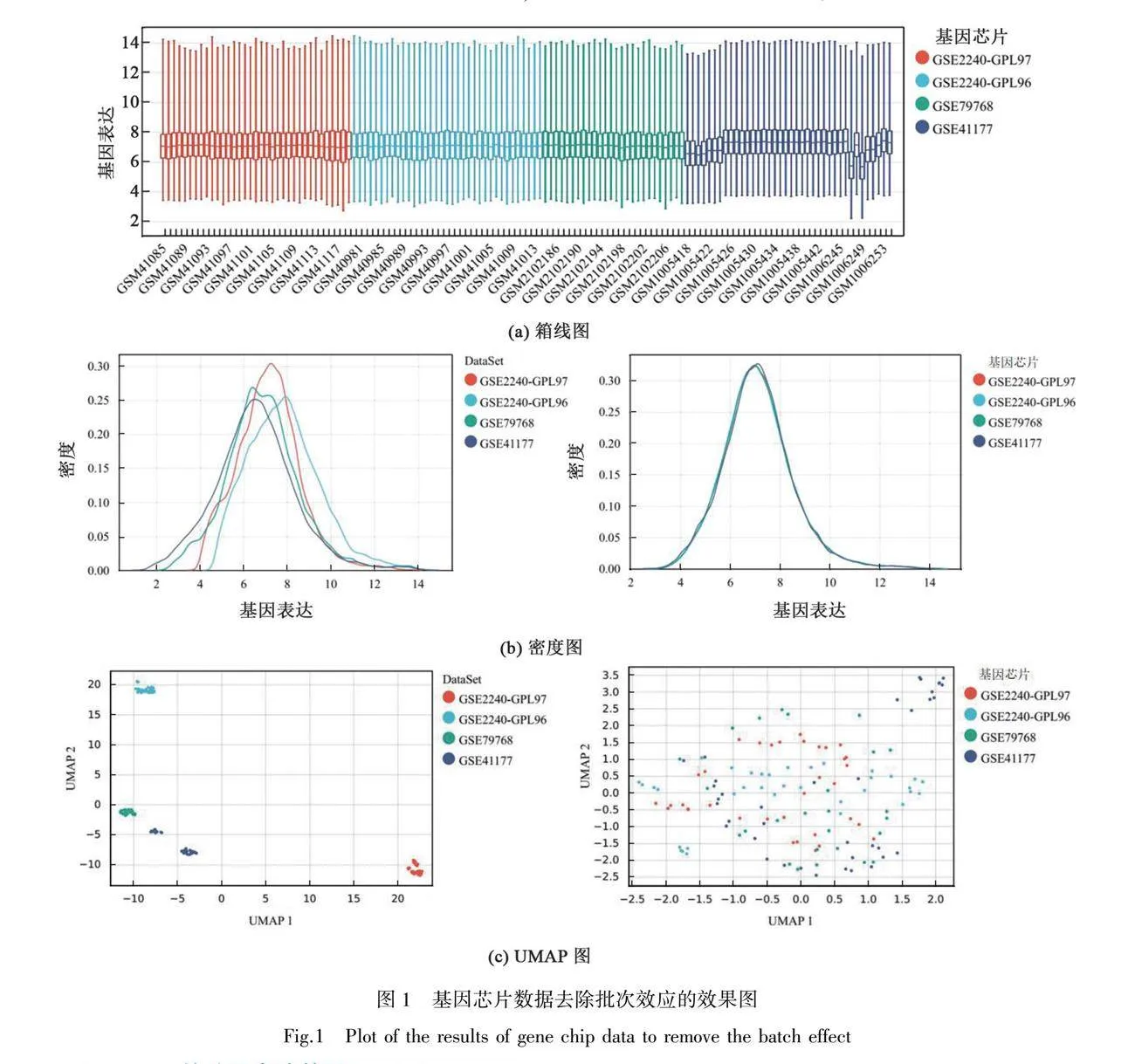
检索GEO数据库,分别获得COPD相关数据集GSE475,心衰相关数据集GSE2240、GSE79768、GSE41177。基于R软件包inSilicoMerging对GSE2240、GSE79768、GSE41177数据集合并,合并矩阵后应用Empirical Bayes法去除批次效应。箱线图(图1(a))显示去除批次效应后各数据集之间的数据分布趋于一致,中位数位于一条线;图1(b)所示分别为去除批次效应前后的密度图,显示去除批次效应后各个数据集之间的数据分布趋于一致,均值和方差相近;图1(c)所示分别为去除批次效应前后的UMAP图,显示去除批次效应后各数据集之间的样本相互聚类交织在一起,提示较好地去除了批次效应。
2.2 COPD-HF的差异表达基因(DEGs)
使用R软件及其扩展包分析COPD相关数据集GSE475和合并后的心衰相关数据集,数据预处理后获得基因表达矩阵,其中COPD相关基因8 780个,HF相关基因1 151个。所有基因的火山图如图2所示。基因热图列出50个最显著的下调基因和上调基因(图3)。
2.3 浙贝母-瓜蒌活性小分子配体库构建及靶点筛选
TCMSP数据库以口服生物利用度(OB)≥20,类药性(DL)≥0.1为标准对浙贝母-瓜蒌成分筛选,涉及活性化合物28个及相关靶点75个;BATMAN-TCM数据库的目标预测方法给出的得分超过给定分界线“score cutoff≥2”被确定为潜在靶标,涉及浙贝母-瓜蒌的55个活性成分及1 875个活性靶点。合并两个数据库涉及的活性化合物及靶点信息,分别下载活性化合物的SMILES格式。
2.4 FTBTF-COPD-HF相关靶点
如图4所示,浙贝母-瓜蒌影响慢性阻塞性肺病并发心脏衰竭进展所涉及的靶点共227个,包括COPD-HF表达上调的基因153个,表达下调的基因74个。
2.5 构建FTBTF-COPD-HF的蛋白-蛋白相互作用(PPI)网络
如图5中所示,颜色越深,面积越大,表示靶点度值越大,在网络中越重要。该网络包含226个节点和207条相互作用关系,网络拓扑学分析显示该网络平均介数为0.4,平均度值为1.83,P值0.115。涉及的关键靶点如RPS23、SNU13、NOL6、ELAVL1、NCL、EEF1A1等。
2.6 基于DAVID数据库的关键靶点GO细胞组分富集分析
基于FTBTF-COPD-HF关键靶点的PPI互作网络,利用R语言的ClusterProfiler功能包分别从细胞组分(cellular component, CC)进行GO分析的标准化描述。结果如表1,表明FTBTF-COPD-HF相关细胞组分主要定位于内膜系统、核内体和细胞外囊泡。
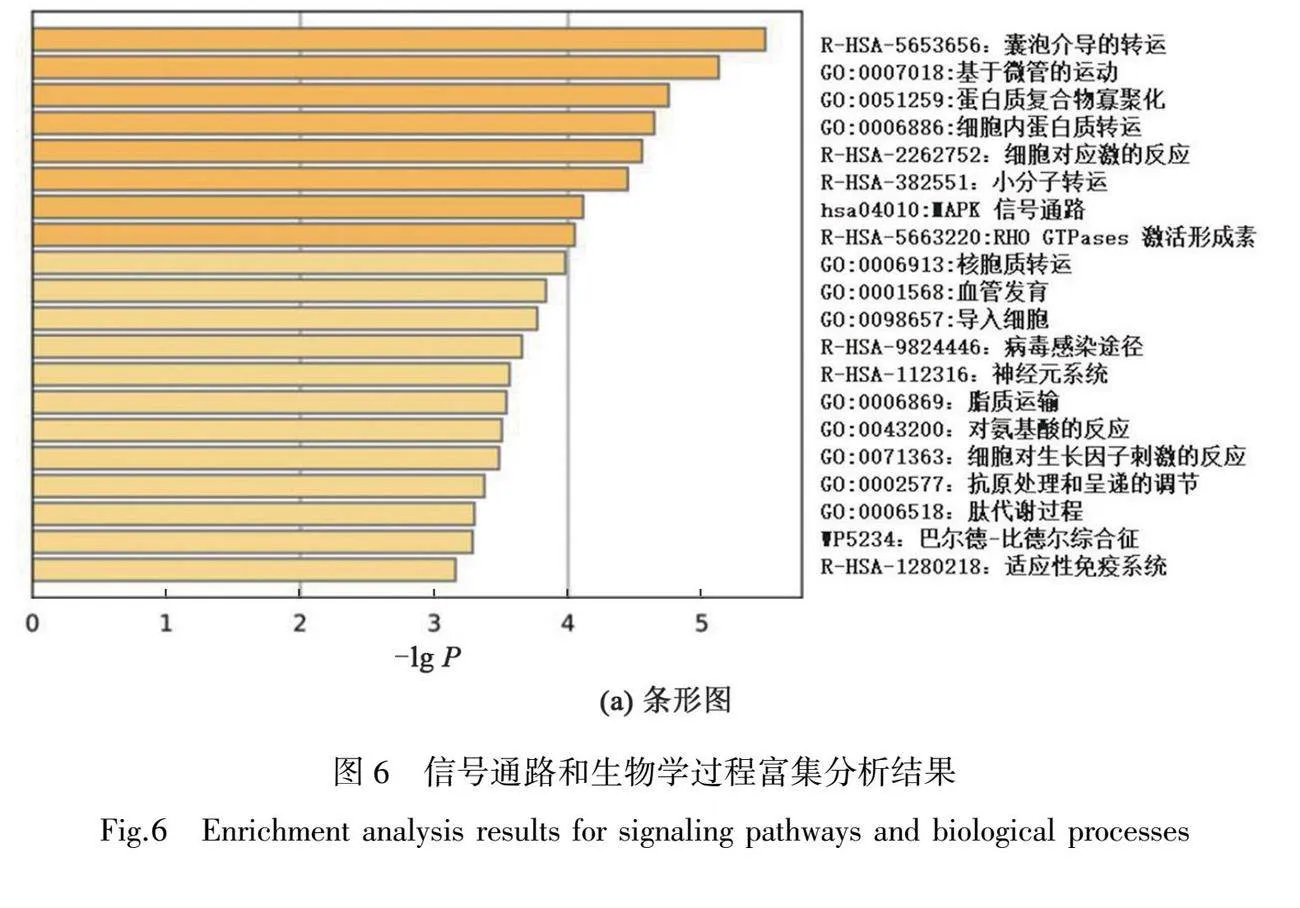
2.7 信号通路和生物学过程富集分析
富集结果见表2与图6,FTBTF-COPD-HF在生物学过程主要涉及囊泡介导的运输、基于微管的运动、蛋白质复合体的寡聚、细胞内蛋白质运输、核胞浆运输、血管发育等;Reactome通路主要涉及细胞对压力的反应、小分子物质的运输、鸟苷酸三磷酸酶(RHO GTPases)激活Formins蛋白等;信号通路方面主要涉及MAPK信号传导途径。
2.8 中枢模块基因的鉴定和验证
如图7所示,在STRING数据库中分析上述226个基因编码蛋白间的相互作用关系,接着采用Cytoscape软件中的MCODE法分析,发现Cluster 1和Cluster 2子网络处于中枢核心位置,总共包含18个关键基因。其中Cluster 1涉及TKT、ENO1、NCL、KIF1B、CLIP4等基因;Cluster 2涉及SIN3B、PHF20、CTBP1、XPNPEP1等基因。
映射上述核心基因至Reactome 生物分子通路知识数据库分析,结果如表3所示,Cluster 1主要涉及驱动蛋白、COPI依赖的高尔基体至ER逆行运输及高尔基体-ER逆行运输;Cluster 2主要涉及基因表达的表观遗传调控、形成含WDR5的组蛋白修饰复合物、组蛋白修饰调控。
2.9 组织特异性PPI网络的构建
DifferentialNet数据库收集组织特异性蛋白质-蛋白质相互作用数据,显示了人类不同类型组织中的蛋白质相互作用。如图8所示,映射相关基因至DifferentialNet数据库并选取人体组织为心耳、左心室、肺,构建FTBTF-COPD-HF组织特异性PPI网络,结果如图所示,发现ELAVL1-ENO1-NCL轴在各个组织表达网络中均处于核心位置,推测浙贝母-瓜蒌配伍可能通过调控ELAVL1-ENO1-NCL轴的表达影响COPD并发心脏衰竭的进展。
2.10 分子对接结果
根据“成分-靶点-通路”网络图核心网络和通路富集筛选出的核心靶点ELAVL1、ENO1、NCL,与度值排名靠前的瓜蒌酸、贝母新碱作分子对接,以AutodockVina获得候选化合物与蛋白质相互作用的结合能。化合物配体分子与受体蛋白之间的结合能越低则亲和力越高,结合构象也越稳定,以分子对接评分(docking score)大于5表示结合能力较好,大于7时表示结合能力极好。对接可视化结果如图9所示,其中瓜蒌活性成分瓜蒌酸与ELAVL1、ENO1、NCL的分子对接评分分别为-25.916、-28.424、-24.244" kJ/mol;而浙贝母活性成分贝母新碱与ELAVL1、ENO1、NCL的分子对接评分分别为-34.694、-40.546、-44.308 kJ/mol,结果表明,活性化合物通过可见的氢键和强静电相互作用与蛋白质靶标结合高度稳定。
3 结论与讨论
慢性阻塞性肺疾病的病变位置主要为气道和肺血管,发作时患者心肌缺血缺氧,收缩力下降,极易引发肺动脉高压,引发心力衰竭[6]。信号通路富集分析提示浙贝母-瓜蒌配伍调控COPD-HF的途径涉及鸟苷酸三磷酸酶(RHO GTPases) 激活Formins蛋白,并可能与有机硝酸脂类药物的作用机制类似,主要通过激活机体鸟苷酸环化酶的活性以舒张血管平滑肌,从而降低心脏负荷,扩张静脉血管与冠状小动脉,降低壁内压,有效改善心肌缺血状态,促进心功能的恢复。肺泡结构破坏是COPD形成肺气肿的重要因素和重要病理状态,浙贝母-瓜蒌配伍调控丝裂原活化蛋白激酶(MAPK)信号转导途径介导的肺泡表面活性物质(PS)的合成和分泌,在维持肺泡结构稳定中发挥重要作用[7-8];MAPK信号通路还与HF进展过程中心肌细胞凋亡与肥大存在密切联系[8-9]。GO富集分析结果提示浙贝母-瓜蒌配伍调控COPD-HF细胞组分主要定位于内质体和细胞外囊泡(EVs)[10-11]。EVs通过向靶细胞运送不同物质(如microRNA、lncRNA、circRNA和mRNA)来介导细胞间的通信[12-13],参与肺部细胞间的交流并调节肺部病理生理过程[14-15],并可能与慢性呼吸道炎症性疾病的发生有关[16]。
COPD患者在不完全可逆的气流受限条件下机体长期缺氧,肺循环阻力逐渐增加,肺动脉血管内膜功能异常增强并伴随血管纤维化和闭塞,肺循环结构发生重塑导致肺动脉高压。肺动脉压升高导致右心室功能失代偿,右心室扩大、缺氧、血流量相对增加、持续性高碳酸血症,诱发心室肥厚发展为肺心病;后期甚至出现右心衰竭,最终影响左心功能并发展为全心衰竭。因此,构建FTBTF-COPD-HF组织特异性PPI网络,提出浙贝母-瓜蒌配伍可能通过调控ELAVL1-ENO1-NCL轴的表达影响COPD并发HF的进展,涉及肺部气道重塑、肺血管内皮细胞功能障碍、肺损伤、肺纤维化及感染相关的炎症途径,心肌细胞相关损伤、糖代谢及心肌纤维化、心肌肥厚等。ELAV样蛋白1(ELAVL1)是一种mRNA稳定蛋白,在COPD的肺组织中高度表达,影响COPD气道重塑过程[17];ELAVL1在衰竭心脏中表达下调,与HF过程中心律失常及房颤的风险相关[18];调控ELAVL1表达能够减轻过氧化氢诱导的心肌细胞损伤[19]。肺血管重塑是肺动脉高压的核心环节, 其始动因素涉及肺动脉内皮细胞功能障碍,α烯醇酶(alpha enolase,ENO1)是肺血管内皮细胞表达的低氧应激蛋白,靶向ENO1-PI3K-Akt-mTOR轴改善低氧相关炎症导致的线粒体功能障碍,调节内皮细胞功能紊乱和代谢重编程,减缓低氧性肺动脉高压的进展[20];而HF时由于能量供应减少和代谢重塑,心肌供能底物从脂肪酸转向糖类等碳水化合物,同样涉及糖代谢相关基因ENO1[21];抑制ENO1转录通过影响糖酵解途径减少心肌梗死后的心肌纤维化[22]。核仁是感染过程中炎症 RNA 的衰变场所,核仁素(nucleolin,NCL)则是穿梭于细胞核、细胞浆与细胞膜之间的蛋白,在肺部病原微生物感染和自身免疫疾病中发挥一定作用,作为引导因子代表感染期间维持炎症基因表达完整性和免疫稳态的核仁依赖性途径[23]。肺泡巨噬细胞膜表面的NCL参与脂多糖内化,抑制NCL表达能够减弱核因子活性进而减少TNF-α和IL-6表达,减轻肺损伤[24];抑制NCL表达还减轻二氧化硅诱导的肺纤维化进展[25]。NCL在缺血-再灌注损伤大鼠心肌及氧化应激损伤的心肌细胞中表达下调且蛋白发生断裂[26];还参与压力负荷增加相关的心肌肥厚的进展过程[27]。
分子对接证实瓜蒌酸与贝母新碱,与ELAVL1、ENO1、NCL靶蛋白的结合高度稳定,且贝母新碱与3种蛋白的结合力均强于瓜蒌酸。贝母新碱作为浙贝母“化痰散结”的主要活性成分,通过作用于M受体、拈抗内钙释放,从而达到舒张气管平滑肌实现平喘的作用,同时明显减轻脂多糖所致肺组织病理学变化,减少黏液分泌并降低肺泡灌洗液中总蛋白、白细胞总数及淋巴细胞和中性粒细胞数量;瓜蒌酸作为瓜蒌“宽胸散结”的主要活性成分,通过降低血小板凝聚、扩张冠状动脉、增加冠脉血流量、并对垂体后叶素诱导的大鼠急性心肌缺血有明显保护作用,有效延缓HF进展。这也恰好体现了两者配伍后先治肺再调心,相须为用以实现心肺共治的作用特点。
综上,本文的研究从系统药理学的角度证明了浙贝母-瓜蒌配伍用于慢性阻塞性肺病的治疗,可能通过调控ELAVL1-ENO1-NCL轴的表达,在治疗COPD进展的同时进一步降低并发心脏衰竭的风险。这与慢性阻塞性肺病并发心脏衰竭的中医治则理论不谋而合,浙贝母清热化痰用于治疗痰热咳喘、咯痰黄稠之证,散结开郁用于治疗痰热互结所致的胸闷心烦之证及瘰疬痰核等;瓜蒌利气开郁,将胸中浊汤下行而起到宽胸散结的功效,用于改善痰气交阻、胸阳不振所引起的胸痹疼痛,两者配伍相须为用先治肺再调心以实现心肺共治。
参考文献:
[1]李娟. 慢性阻塞性肺疾病合并心衰的临床特征分析[J]. 当代临床医刊, 2019, 32(4): 380. DOI: 10.3969/j.issn.2095-9559.2019.04.053.
[2]张家豪, 孙超峰. 伊伐布雷定治疗冠心病合并慢性阻塞性肺病心力衰竭临床疗效研究[J]. 陕西医学杂志, 2019, 48(2): 256-258. DOI: 10.3969/j.issn.1000-7377.2019.02.032.
[3]曹铭晨, 徐龙, 辛兆洋, 等. 基于BATMAN-TCM在线分析平台的浙贝母-瓜蒌配伍治疗慢性阻塞性肺病的网络药理学研究[J]. 山东科学, 2021, 34(1): 10-20. DOI: 10.3976/j.issn.1002-4026.2021.01.002.
[4]石志刚, 李雅娜. BNP在COPD急性发作患者左心功能不全中的检测意义[J]. 世界最新医学信息文摘, 2017, 17(4): 157.
[5]胡家容, 滕明义, 夏淑东. 慢性左心衰合并慢性阻塞性肺病的临床研究[J]. 中国现代医生, 2013, 51(12): 12-14.
[6]LIAO K M, LIN T, HUANG Y B, et al.The evaluation of β-adrenoceptor blocking agents in patients with COPD and congestive heart failure: A nationwide study[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2017, 12: 2573-2581. DOI: 10.2147/COPD.S141694.
[7]杨晓敏, 张蓓, 张鹏飞, 等. 基于p38MAPK通路探讨银杏叶提取物对慢性阻塞性肺疾病大鼠气道黏液高分泌及血管重塑的影响[J]. 现代生物医学进展, 2023, 23(9): 1624-1630. DOI: 10.13241/j.cnki.pmb.2023.09.005.
[8]张欣媛, 熊鑫, 韩金霞, 等. 黄芪甲苷对心衰模型大鼠心肌炎性因子和MAPK信号通路的影响[J]. 中医药学报, 2023, 51(1): 30-35. DOI: 10.19664/j.cnki.1002-2392.230008.
[9]马如风. 基于ATF3/MAP2K3/p38 MAPK通路探究活血益气组分中药防治心梗后大鼠心室重构作用机制[D]. 北京: 北京中医药大学, 2020.
[10]COLOMBO M, RAPOSO G, THRY C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annual Review of Cell and Developmental Biology, 2014, 30: 255-289. DOI: 10.1146/annurev-cellbio-101512-122326.
[11]HESSVIK N P,LLORENTE A. Current knowledge on exosome biogenesis and release[J].Cellular and Molecular Life Sciences: CMLS, 2018, 75(2): 193-208. DOI: 10.1007/s00018-017-2595-9.
[12]VERWEIJ F J, BALAJ L, BOULANGER C M, et al.The power of imaging to understand extracellular vesicle biology in vivo[J]. Nature Methods, 2021, 18: 1013-1026. DOI: 10.1038/s41592-021-01206-3.
[13]HE X, PARK S, CHEN Y, et al. Extracellular vesicle-associated miRNAs as a biomarker for lung cancer in liquid biopsy[J]. Frontiers in Molecular Biosciences, 2021, 8: 630718. DOI:10.3389/fmolb.2021.630718.
[14]TRAPPE A, DONNELLY S C, MCNALLY P, et al. Role of extracellular vesicles in chronic lung disease[J]. Thorax, 2021, 76(10): 1047-1056. DOI: 10.1136/thoraxjnl-2020-216370.
[15]SU G, MA X H, WEI H D. Multiple biological roles of extracellular vesicles in lung injury and inflammation microenvironment[J]. Bio Med Research International, 2020, 2020: 5608382. DOI:10.1155/2020/5608382.
[16]KADOTA T, FUJITA Y, YOSHIOKA Y, et al. Extracellular vesicles in chronic obstructive pulmonary disease[J]. International Journal of Molecular Sciences, 2016, 17(11): 1801. DOI:10.3390/ijms17111801.
[17]孙健. ELAVL1/HuR在气道重塑中的作用及相应干预措施研究[D]. 济南: 山东大学, 2018.
[18]ZHOU A Y, XIE A, KIM T Y, et al. HuR-mediated SCN5A messenger RNA stability reduces arrhythmic risk in heart failure[J]. Heart Rhythm, 2018, 15(7): 1072-1080. DOI: 10.1016/j.hrthm.2018.02.018.
[19]邴森, 袁博, 王昌育, 等. MiR-142-3p通过调控ELAVL1表达影响过氧化氢诱导的心肌细胞损伤的分子机制[J]. 中华细胞与干细胞杂志(电子版), 2019, 9(3): 135-143. DOI: 10.3877/cma.j.issn.2095-1221.2019.03.002.
[20]SHI Y, LIU J, ZHANG R, et al. Targeting endothelial ENO1 (alpha-enolase)-PI3K-akt-mTOR axis alleviates hypoxic pulmonary hypertension[J]. Hypertension(Dallas,Tex),2023,80(5):1035-1047.DOI:10.1161/hypertensionaha.122.19857.
[21]陈文. 蛋白磷酸酶2A缺失导致小鼠心脏线粒体功能异常及能量代谢重构[D]. 南京: 南京师范大学, 2013.
[22]JI J J, YAO Y U Y U. Kallistatin/serpina3c inhibits fibrosis after myocardial infarction by regulating glycolytic pathway[J]. European Heart Journal, 2021, 42(S1): ehab724.0771. DOI: 10.1093/eurheartj/ehab724.0771.
[23]GRIFFITHS C D, BILAWCHUK L M, MCDONOUGH J E, et al. IGF1R is an entry receptor for respiratory syncytial virus[J]. Nature, 2020,583: 615-619. DOI: 10.1038/s41586-020-2369-7.
[24]王艺. 肺泡巨噬细胞膜核仁素在大鼠内毒素肺损伤中作用及机制研究[D]. 重庆: 第三军医大学, 2011.
[25]ZHOU Q, GUAN Y, HOU R Y, et al. PolyG mitigates silica-induced pulmonary fibrosis by inhibiting nucleolin and regulating DNA damage repair pathway[J]. Biomedicine amp; Pharmacotherapy, 2020, 125: 109953. DOI: 10.1016/j.biopha.2020.109953.
[26]周斌. 采用转基因小鼠初步探讨核仁素的心肌保护作用[D]. 长沙: 中南大学, 2011.
[27]严思敏, 吴双, 孙丽, 等. 大鼠压力负荷增加心肌肥厚模型中核仁素的表达[J]. 中南大学学报(医学版), 2014, 39(2): 124-128. DOI: 10.11817/j.issn.1672-7347.2014.02.003.

