籼型血缘渗入对北方粳稻产量和品质的影响
徐海,李秀坤,2,芦佳浩,姜恺,马玥,徐正进,徐铨
籼型血缘渗入对北方粳稻产量和品质的影响
徐海1,李秀坤1,2,芦佳浩1,姜恺1,马玥1,徐正进1,徐铨1
1沈阳农业大学水稻研究所,沈阳 110866;2河北农业大学农学院/华北作物改良与调控国家重点实验室/河北省种质资源实验室,河北保定 071000
【目的】分析籼型血缘渗入对粳稻品种产量和品质的影响,为优化籼型血缘利用的北方粳稻育种方案提供理论基础和基因组资源。【方法】以籼粳交重组自交系(RIL)及从黑龙江省、辽宁省、山东省和江苏省收集的74份不同年代粳稻主栽品种为试材,结合基于Illumina HiSeq2500平台的全基因组高通量测序和多地表型调查,分析籼型血缘对北方粳稻产量和品质的影响,并使用CRISPR/Cas9基因编辑技术对籼型血缘渗入所引入的不利基因进行基因敲除。【结果】分析RIL发现籼型血缘与穗长、粒长呈显著正相关,与碾磨品质呈负相关,其中,与整精米率达到显著水平。籼型血缘在江苏省与直链淀粉含量呈显著负相关,与粗蛋白含量呈显著正相关。籼型频率与粒形的相关性随着纬度的增加而增强,而与穗长和整精米率的相关性随着纬度的增加而减弱。通过调查粳稻主要稻区不同年代主栽品种,发现籼型血缘渗入位置和比例并不是均匀分布在12条染色体上,在第1、10、11和12染色体上,籼型血缘分布较多。江苏省和辽宁省主栽品种的籼型血缘显著高于黑龙江省和山东省,而且2000年后育成的品种籼型血缘显著高于2000年之前的品种。各粳稻区不同年代主栽品种籼型血缘渗入显著增加了每穗粒数,籼型血缘渗入区域中包含多个抗性和育性相关基因。在盐丰47的第5染色体上有一段籼型血缘渗入片段,包含籼型粒型调控基因和籼型垩白调控基因,增加了盐丰47的千粒重,但影响了其垩白性状。应用CRISPR/Cas9技术敲除盐丰47的,纯合基因编辑植株的粒形与盐丰47相似,其垩白性状得到了显著改善。【结论】籼型血缘渗入主要通过增加每穗粒数增加粳稻产量潜力,但对碾磨品质有负面影响。通过全基因组高通量测序挖掘品种不良等位基因,结合CRISPR/Cas9基因编辑打破籼粳杂交育种中的遗传累赘是一种高效的育种辅助手段,可以针对目标性状进行快速准确的改良。
水稻;粳稻育种;籼型血缘渗入;产量;品质;分子设计育种
0 引言
【研究意义】籼粳稻杂交育种是中国特别是北方粳型超级稻育种的总体技术路线,分析籼型血缘渗入在粳稻育种中的作用,可以最大限度地避开亚种间杂交产生的负面影响,将为进一步聚合亚种间优势性状、扩宽粳型栽培稻的遗传多样性、在更高水平上平衡粳稻产量和品质及突破粳稻育种瓶颈提供理论基础和种质资源。【前人研究进展】水稻是世界重要粮食作物,为全球约一半人口提供主食,其中90%以上集中在亚洲。亚洲栽培稻分为籼(Xian,XI)和粳(Geng,GJ)2个亚种,在长期自然选择和人工选择过程中,籼粳稻基因组不断分化,生态适应性等生物学特性产生显著差异,农艺性状各有利弊[1-4]。籼稻约占亚洲栽培稻的90%,广泛分布在印度、中国、东南亚,粳稻主要在中国、日本、韩国等国家种植[5]。我国籼粳并重,其中2/3为籼稻,主要在纬度和海拔较低地区种植,粳稻主要在纬度和海拔较高地区种植,中部地区籼粳交错。我国是世界上唯一同时大面积种植籼稻和粳稻的国家,促使相关遗传基础研究成为得天独厚且成果卓著的优势研究领域[6-8]。早在1959年杨守仁先生率先提出籼粳稻杂交育种新思路[9],在此基础上,陈温福院士团队构建了理想株型与综合籼粳亚种有利性状相结合的育种理论体系,成为我国北方粳型超级稻育种的总体技术路线[10]。通过对20世纪80年代以来我国北方稻区推广的优良品种进行系谱分析,发现其中绝大部分都是由籼粳稻杂交所育成。籼粳杂交所引入的籼型血缘显著增加了我国粳稻产量潜力,但是这些品种一般不是直接通过籼稻与粳稻品种杂交,而是以籼粳交育成品种(系)或衍生后代杂交育成,由于亲本繁多,系谱和育种过程复杂,育种家并不清楚究竟利用了另一亚种的哪些优异基因。总之,随着籼型血缘的引入,北方粳稻的品质有所下降,但是课题组前期发现一些籼型血缘较高的粳型超级稻品种,不但产量潜力显著高于传统日本粳稻品种,外观品质和加工品质也毫不逊色,只是食味值与传统日本粳稻品种相比还有待提高[11]【本研究切入点】籼型血缘的引入在提高产量潜力的同时是否对品质性状有直接负面影响,迄今研究还不能圆满回答这个问题,相关基因组层面研究滞后是限制籼粳稻杂交育种效率的主要瓶颈。【拟解决的关键问题】本研究围绕籼型血缘在粳稻育种中的作用这一关键科学问题,对籼粳交重组自交系和我国不同年代育成粳稻品种进行全基因组测序,明确籼型血缘对我国粳稻重要农艺性状的影响,为通过籼粳杂交聚合亚种有利基因实现精准育种提供新思路。
1 材料与方法
1.1 试验材料
以籼型恢复系材料泸恢99(R99)和粳型超级稻品种沈农265(SN265)杂交后自交10代,随机选取151个株系构建籼粳交重组自交系(recombinant inbred lines,RIL)。于2021年将试验材料分别种植于广东省(GD)中国农业科学院深圳农业基因组研究所试验田(22°N,114°E)、江苏省(JS)淮安市盱眙县古桑乡原种场试验田(32°N,120°E)、四川省(SC)农业科学院水稻高粱研究所试验基地(32°N,104°E)和辽宁省(LN)沈阳农业大学水稻研究所试验田(41°N,123°E)。试验选择完全随机区组设计,田间种植3次生物学重复。每个株系种植4行,每行10株,行株距为30.0 cm×15.0 cm,单苗移植,4个生态环境下均在植株抽穗后45 d进行收获。
试验进行大范围的粳稻品种收集,其中,包括黑龙江省(HLJ)、辽宁省(LN)、山东省(SD)、江苏省(JS)不同年代的74份粳稻主栽品种,品种按育成年代可分为1980年之前育成、1980—1990年育成、1990—2000年育成和2000年后育成4个时间段。于2021年将74份主栽品种分别种植于江苏省(JS)淮安市盱眙县古桑乡原种场试验田(32°N,120°E)、山东省(SD)青岛农业大学水稻试验田(37°N,119°E)、辽宁省(LN)沈阳农业大学水稻研究所试验田(41°N,123°E)、黑龙江省(HLJ)农业科学院耕作栽培研究所(45°N,126°E),4个试验地点基本包含了主要粳稻种植区的纬度跨度,种植方式与RIL相同。
1.2 产量和品质性状调查
植株抽穗后45 d,在各小区中部随机选取长势中等的5株调查有效穗数和株高,取长势均匀的10穗调查每穗粒数、结实率和千粒重。稻谷在收获晒干后存放3个月,待理化特性稳定后进行品质测定。检测指标有糙米率、精米率、整精米率、垩白度、垩白粒率、蛋白质含量、胶稠度、碱消值、直链淀粉含量和蛋白含量,具体测定方法参照Li等[12]。
使用Microsoft Excel 2016整理试验数据,采用SPSS 20.0进行方差分析和显著性分析,LSD(<0.05)方法用于检验品种间差异的显著性,并用Graphpad 8.0进行作图。
1.3 高通量测序
在人工气候箱中播种SN265、R99和151个RIL,以及74份主栽品种。播种四周后取嫩叶,采用CTAB法提取基因组DNA,用于构建文库,随后在Illumina HiSeq2500平台进行全基因组高通量测序。经过质量控制和过滤后,R99和SN265分别得到13.04和13.38 Gb的Clean data;151个子代共得到414.37 Gb的Clean data,平均每个材料2.74 Gb的Clean data。74份主栽品种共获得约1 638.72 Gb的Clean data,Q30平均达到92.51%。SN265和R99的测序深度分别为30×和32×;子代的平均测序深度为6.25×。利用SOAP2软件将序列与参考基因组日本晴(Nipponbare,http:// rapdb.dna.affrc.go.jp/download/irgsp1.html/)进行比对,利用GATK软件进行SNP检测,共得到1 456 445个SNP。74份主栽品种的平均测序深度为53.34×,筛选后得到11 952 151个SNP。
1.4 籼型血缘计算
籼粳特异性SNP数据来自517份水稻种质资源的测序结果[2],将517份水稻种质资源中粳型种质资源基因型一致,且籼型种质资源为另一种基因型的SNP定义为籼粳特异SNP,共得到100 528个籼粳特异SNP,其中,第1染色体有15 961个;第2染色体有23 282个;第3染色体有12 450个;第4染色体有3 637个;第5染色体有5 333个;第6染色体有4 741个;第7染色体有4 107个;第8染色体有7 347个;第9染色体有8 443个;第10染色体有7 701个;第11染色体有3 944个;第12染色体有3 582个。RIL和主栽品种中籼型SNP数值与全部籼粳特异SNP的比值定义为籼型血缘渗入比例。
1.5 CRISPR/Cas9基因编辑
以盐丰47为遗传背景材料进行CRISPR基因编辑。使用华南农业大学亚热带农业生物资源保护与利用国家重点实验室刘耀光院士团队开发的基因编辑工具包CRISPR-GE(http://skl.scau.edu.cn/)进行靶位点的设计,应用BLAST比对日本晴参考基因组确认靶点的特异性(https://rapdb.dna.affrc.go.jp/tools/ blast)。基因编辑靶点序列和引物合成,以及测序服务均由华大基因完成。参照Li等[12]方法进行基因编辑载体构建及基因编辑植株的遗传转化和筛选。
2 结果
2.1 RIL群体的产量和品质性状
将SN265和R99杂交构建的RIL群体分别种植于辽宁省(LN)、四川省(SC)、江苏省(JS)和广东省(GD),并对主要产量和品质性状展开调查。结果显示,JS和LN的穗数显著高于SC和GD(图1-a),SC和JS的每穗粒数显著高于LN和GD(图1-b),千粒重在4个地区没有显著差异(图1-c),LN和SC的结实率显著高于JS和GD(图1-d)。SC和JS的穗长显著长于LN和GD(图1-e),着粒密度为SC>JS>LN>GD,且地区间差异均达到显著水平(图1-f),SC和JS的株高显著高于LN和GD(图1-g),抽穗期在4个地区间差异显著,依次为LN>SC>JS>GD(图1-h)。RIL在SC展现出较好的碾磨品质,其糙米率、精米率和整精米率都显著高于其他3个地区(图1-i—k)。RIL的外观品质在4个地区展现出较大差异,LN垩白粒率显著高于其他3个地区(图1-i),LN和SC的垩白度显著高于JS(图1-m)。粒形一度被认为主要受遗传因素调控,受环境因素影响较小,发现RIL的粒形在不同地区也体现出显著性差异,JS和GD的籽粒显著长于LN和SC(图1-n),其中,LN和SC的粒宽显著大于JS和GD(图1-o),而GD的粒长显著长于其他3个地区(图1-p)。进一步调查RIL在各地区的食味相关品质,发现LN和GD的碱消值显著高于SC和JS(图1-q)。LN、SC和GD之间胶稠度没有显著性差异,均显著高于JS(图1-r),LN的直链淀粉含量显著高于SC和JS,SC和JS显著高于GD(图1-s)。粗蛋白含量展现出随着维度降低而增加的趋势,且4个地区间差异均达到显著水平(图1-t)。

LN:辽宁省;SC:四川省;JS:江苏省;GD:广东省。不同小写字母表示在5%水平上差异显著。下同
2.2 RIL群体中籼型血缘对产量和品质的影响
利用高通量测序数据和籼粳特异SNP确定了每个RIL自交系的籼型血缘比例,结果显示,RIL群体的籼型血缘比例呈正态分布(图2-a),说明RIL的构建理想,满足后续试验分析需求。分别在4个地区对籼型血缘与重要农艺性状的相关性进行分析。结果显示,籼型血缘在4个地区都与穗长呈正相关,在LN、JS和GD达到显著水平,籼型血缘与每穗粒数为正相关,其中,在SC、LN和JS达到显著水平。籼型血缘与结实率和着粒密度呈正相关,与千粒重和穗数呈负相关,4个地区均未达到显著水平。籼型血缘与理论产量呈正相关,在GD达到显著水平。籼型血缘与株高呈负相关,其中,在SC和LN达到显著水平。籼型血缘与糙米率、精米率和整精米率呈负相关,其中,与糙米率和精米率在GD和JS达到显著水平,与整精米率在4个地区均为显著负相关。籼型血缘与垩白粒率和垩白度为正相关,在4个地区均未达到显著水平。籼型血缘与粒长和籽粒长宽比在4个地区均显著正相关,与粒宽显著负相关。籼型血缘与碱消值和胶稠度呈正相关,在4个地区均未达到显著水平。籼型血缘与直链淀粉含量呈负相关,在SC和JS达到显著水平。籼型血缘与粗蛋白含量呈正相关,在JS达到显著水平(图2-b)。
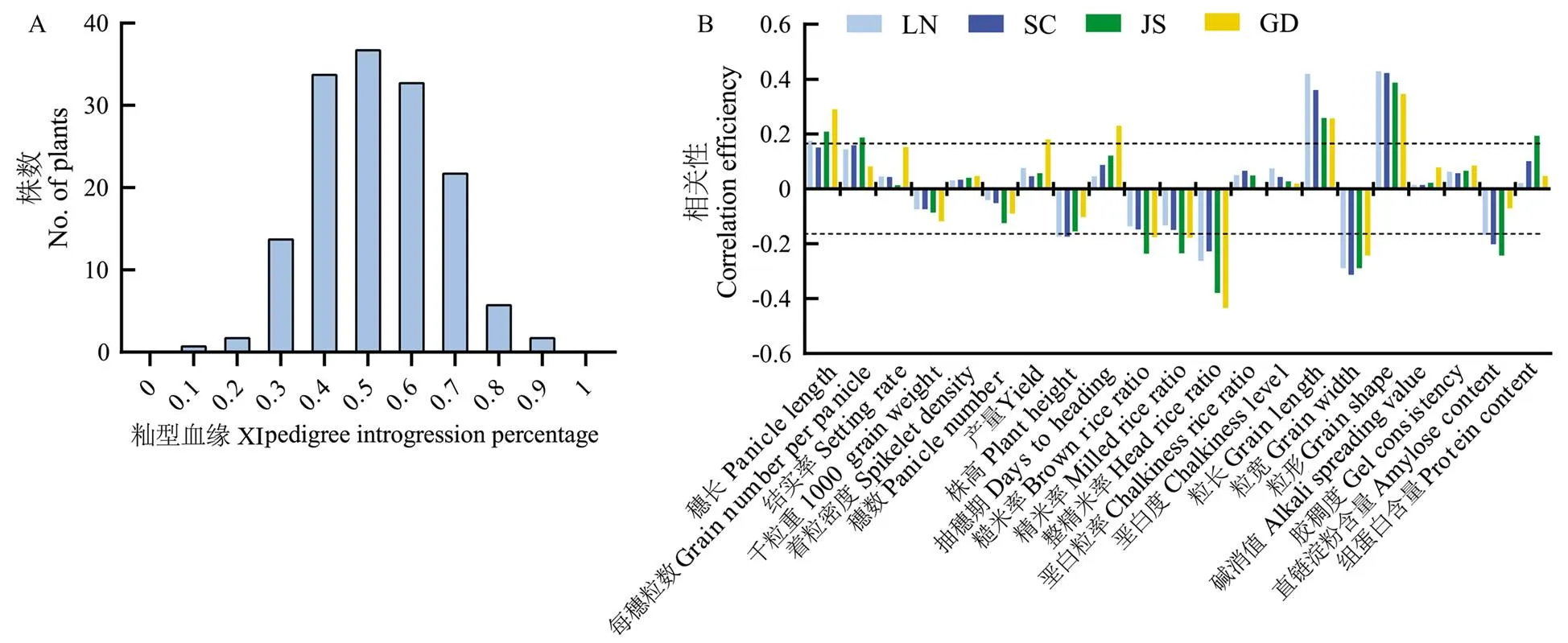
a:RIL群体的籼型血缘比例分布;b:RIL群体中籼型血缘和产量与品质性状的相关性分析。虚线范围外表示在0.05水平差异显著。下同
2.3 主栽品种的产量相关性状
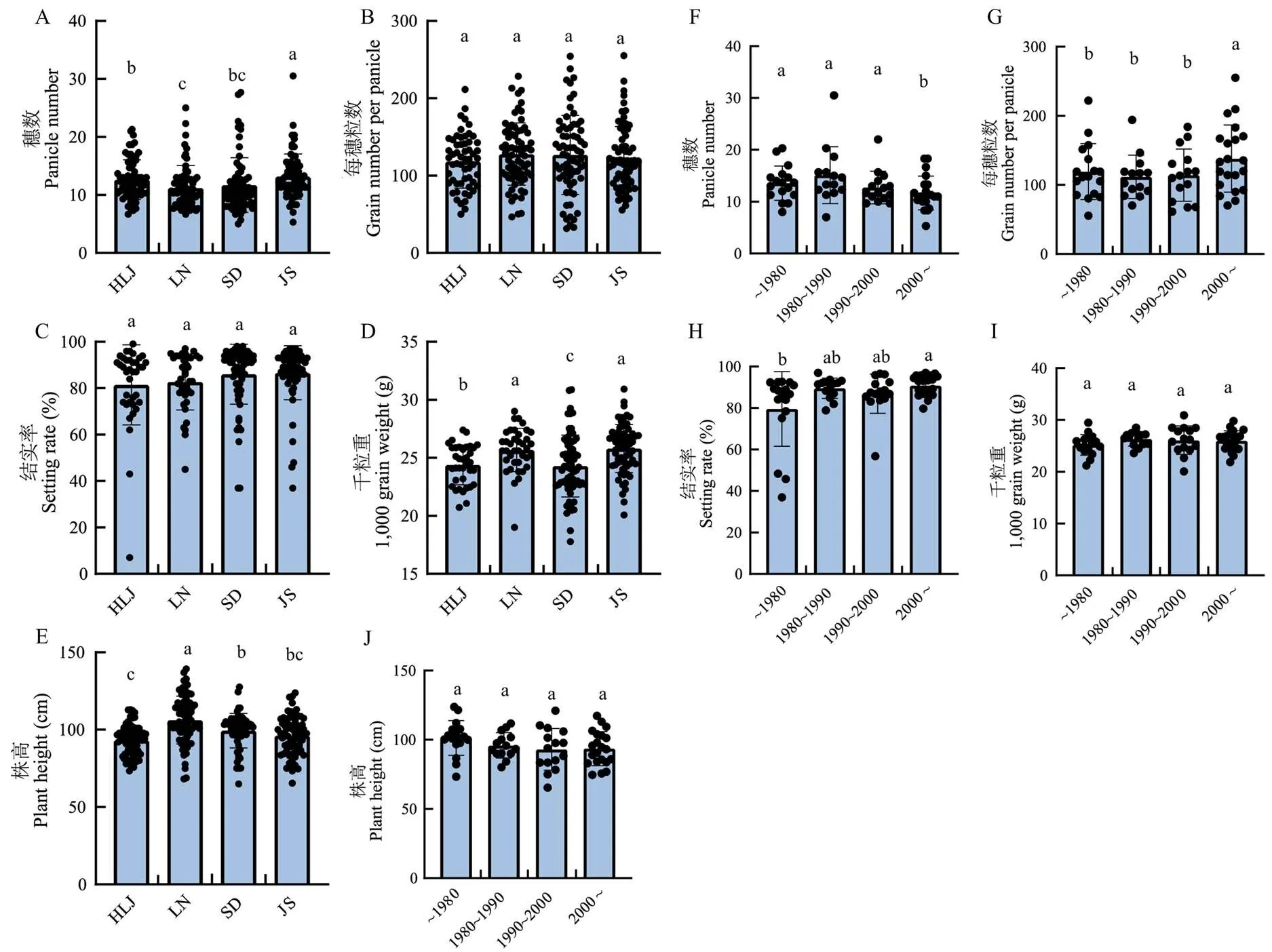
为了分析籼型血缘对粳稻主栽品种产量性状的影响,从黑龙江省(HLJ)、辽宁省(LN)、山东省(SD)和江苏省(JS)4个粳稻稻区收集了74份主栽品种,收集品种的育成年代可分为1980年之前、1980—1990年、1990—2000年和2000年之后4组。将74份品种分别种植于HLJ、LN、SD和JS,并在这4个地区对74份品种的产量相关性状进行调查,结果显示,74份品种在JS穗数显著高于HLJ、LN和SD,HLJ穗数显著高于LN,HLJ和SD之间以及LN和SD之间均没有显著性差异(图3-a)。4个地区的每穗粒数和结实率相近,地区间没有显著性差异(图3-b—c)。JS和LN的千粒重显著高于HLJ,HLJ显著高于SD(图3-d)。74份品种在LN株高显著高于HLJ、SD和JS,SD株高显著高于HLJ,HLJ和JS及SD和JS之间株高没有显著性差异(图3-e)。进一步分析不同育成年代株高和产量构成因素的特点和规律发现穗数和每穗粒数这一对负相关的性状体现出年代变化规律,其中,2000年以后育成品种穗数显著少于之前3个时期的育成品种。相反,2000年后育成品种的每穗粒数显著多于之前3个时期的育成品种(图3-f—g)。结实率也表现出改善的趋势,其中,2000年后育成品种结实率显著高于1980年前育成品种(图3-h)。千粒重和株高在不同年代间没有显著性差异(图3-i—j)。
2.4 籼型血缘对主栽品种产量性状的影响
为了进一步分析籼型血缘对重要农艺性状的影响,绘制了74份品种全基因组籼型血缘渗入比例和位置示意图(图4-a—b)。不同品种的籼型血缘渗入比例和位置展现出丰富的多态性,且籼型血缘渗入位置和比例并不是均匀分布在12条染色体上,在第1、10、11和12染色体上,籼型血缘分布较多(图4-a)。统计不同育成年代品种的籼型血缘渗入比例,发现2000年之前育成的品种籼型血缘较低,普遍低于2.0%,其中1980年以前育成品种的籼型血缘渗入比例小于0.5%。2000年后育成品种的籼型血缘渗入比例显著增加,超过5.0%(图4-c)。进一步分析发现籼型血缘渗入比例在不同地区间存在差异,其中,HLJ和SD籼型血缘渗入比例较低,SD品种籼型血缘渗入比例小于1.0%,HLJ品种籼型血缘渗入比例在1.1%左右。LN和JS品种的籼型血缘渗入比例较高,其中,辽宁省品种达到3.0%,JS品种的籼型血缘渗入比例超过4.5%(图4-d)。结合高通量测序获得的籼型血缘渗入比例和4个地区种植获得的产量构成因素数据,分析籼型血缘对主栽品种产量的影响。结果显示,籼型血缘渗入比例与株高、千粒重和结实率呈正相关,与穗数均呈负相关,在4个地区均未达到显著水平。籼型血缘渗入比例与每穗粒数在4个地区均呈显著正相关(图4-e)。
综上所述,籼型血缘渗入主要增加了粳稻品种的每穗粒数。发现很多品种的特定染色体区域有大量籼型血缘渗入,其中,第1染色体短臂端是每穗粒数基因所在区域,在籼粳之间存在差异,籼型第1个外显子处6 bp的缺失和2个SNP(C/G和G/A),以及第4个外显子处的1个SNP(G/T),导致其蛋白产物与粳稻品种产生差异,引起花序分裂组织中细胞分裂素的积累,进而增加每穗粒数[13]。通过分析74份粳稻主栽品种中的基因型,发现绝大部分粳稻主栽品种的基因型均与日本晴和SN265相同,暗示籼型等位基因还没有广泛应用到粳稻育种中。但是黑龙江省大面积推广的粳稻品种龙粳31的位点基因型与R99相同,均为典型籼型等位基因(图4-f)。进一步比对目前已经公布的基于长读长测序的155份水稻基因组[14-16],发现籼型等位基因广泛分布于热带粳稻种质资源当中,温带粳稻中仅有来自韩国的MAEKJO、来自马来西亚的MR19和中国的安农晚粳B与龙粳31携带籼型基因型。
a—e:四地区主栽品种;f—j:不同时期育成品种。HLJ:黑龙江省;SD:山东省。下同
为了进一步揭示籼型血缘渗入所引入的关键农艺性状调控基因,筛选了在74份粳稻品种中超过20%的品种为籼型的SNP,并分析与这些高频籼型SNP位置重合的已知功能基因,共发现11个已知功能基因(图4-g),其中4个为抗逆性基因[17]、[18]、[19]和[20],2个抗病性基因[21]和[22],3个育性基因[23]、[24]和[25],1个水稻株型调控基因[26]和1个水稻抽穗期基因[27],暗示粳稻品种中的籼型血缘渗入主要引入了抗性和育性相关基因。

a:主栽品种中的籼型血缘渗入位置;b:主栽品种中籼型血缘渗入比例;c:不同年代育成品种中的籼型血缘渗入;d:不同地区主栽品种中的籼型血缘;e:籼型血缘与产量性状的相关性分析;f:沈农265(SN265)、R99、日本晴(Nipponbare)和龙粳31(LG31)Gn1a位点的基因型对比;g:籼型血缘渗入所引入的重要功能基因
2.5 基因编辑打破籼粳杂交育种中的遗传累赘
调控重要农艺性状的功能位点在基因组上的分布并不均匀,许多功能位点集中分布在2 cM区间内,这种现象可能导致引入优异等位基因的育种过程中,因为遗传累赘(genetic drag)也引入了不良性状调控基因[6]。分析主栽品种中籼型血缘渗入区域内的重要农艺性状调控基因。以盐丰47为例,盐丰47为辽宁省、山东省等地区的主栽品种,其产量潜力高,千粒重达到26.2 g,高于大部分粳稻品种,但是垩白性状有待提高。发现盐丰47的第5染色体短臂端有一段籼型血缘渗入,该区间内包含了重要粒形调控基因和垩白调控基因(图5-a)。编码一个丝氨酸羧肽酶,其优势等位基因(ZS97型)显著增加水稻籽粒大小[28]。在上游的为液泡膜质子转运焦磷酸酶,具有无机焦磷酸水解活性和质子转运活性,影响水稻籽粒垩白的形成和精米率等品质性状,其ZS97型等位基因显著增加籽粒垩白度和垩白粒率[29]。通过序列比对,发现盐丰47的和均与籼稻品种ZS97相同(图5-b)。
综上所述,推测盐丰47在育种过程中为了追求高产而引入了籼型等位基因以期增加千粒重,与相邻的籼型也随之渗入到盐丰47基因组,导致垩白性状恶化。为了保留盐丰47的千粒重优势,改良其垩白性状,对盐丰47的位点进行定点基因敲除。在T2代筛选到2个无Cas9的纯合突变系CR-1和CR-2,其中CR-1缺失了一个碱基(A),CR-2缺失2个碱基(TA),二者都造成移码突变,提前产生终止子(图5-c)。突变体CR-1和CR-2与盐丰47在粒形上无显著差异(图5-d),其垩白性状显著改善(图5-e—f)。
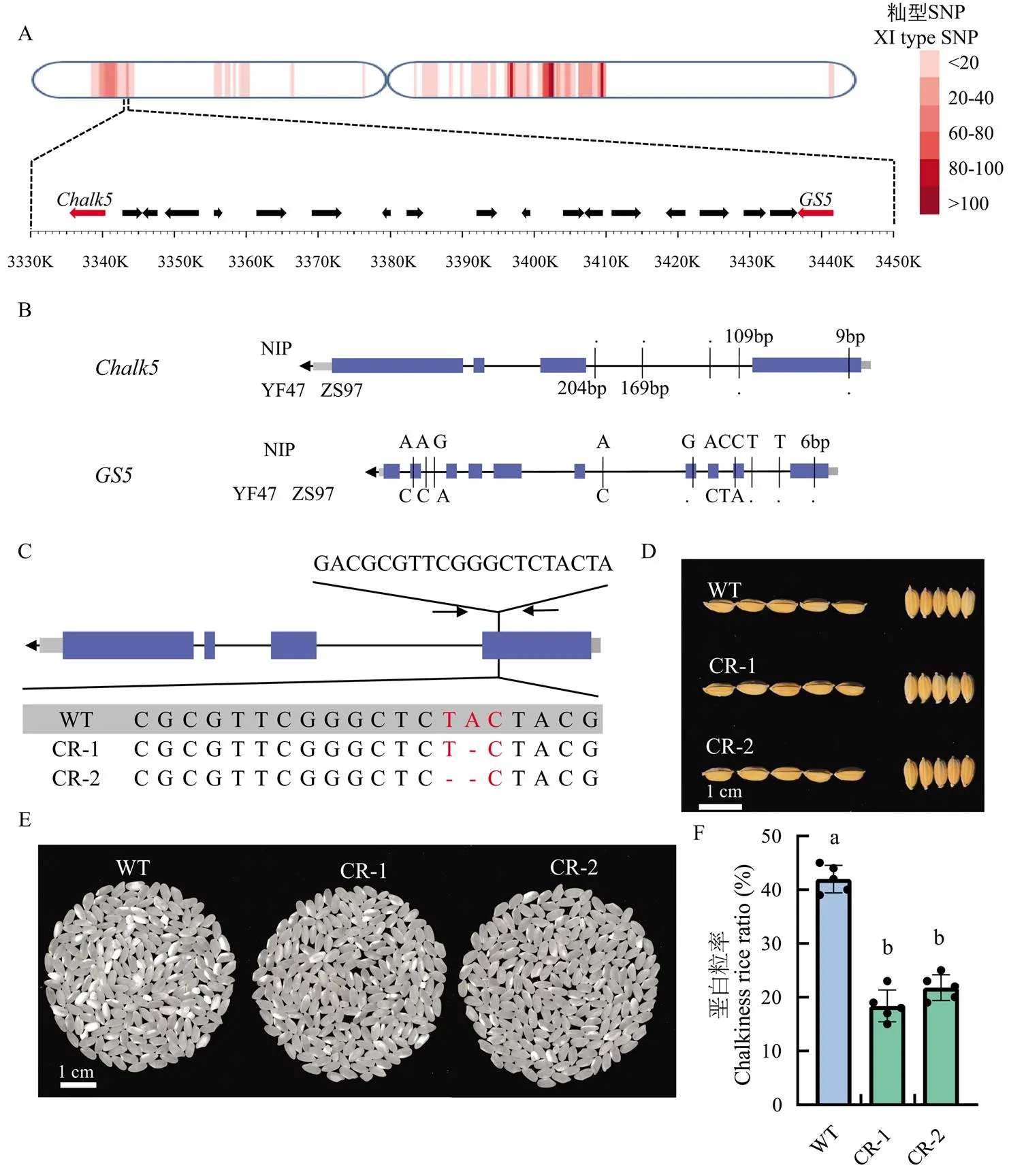
a:Chalk5和GS5的位置;b:盐丰47中Chalk5和GS5的基因型;c:CRISPR/Cas9基因编辑的靶点设计和突变体序列比对;d:野生型和突变体的粒形比较;e:野生型和突变体的垩白性状比较;f:野生型和突变体的垩白粒率
3 讨论
3.1 籼粳杂交育种显著提高北方粳稻产量潜力
目前,全球粳稻种植面积超过1 478万hm2,主要分布在中国东北、日本和韩国。早在1959年,杨守仁先生率先提出籼粳稻杂交育种新思路,在此基础上,陈温福院士团队构建了理想株型与籼粳优势互补相结合的理论体系,即“利用籼粳稻杂交创造新株型和强优势,通过复交优化性状组配聚合有利基因,选育理想株型与籼粳优势互补相结合的超级稻”,成为中国特别是北方粳型超级稻育种的总体技术路线,在此路线的指导下东北粳稻产量水平显著提高,为中国乃至世界粮食安全作出了巨大贡献。截至2014年,东北三省育成超级稻品种22个,覆盖率达到60%以上,促进东北水稻单产由21世纪初平均的6.60 t·hm-2(2000—2004年)提高到近年的7.56 t·hm-2(2010— 2014年),增产幅度达到12.62%,显著高于同期全国平均增产水平(6.20 t·hm-2、6.71 t·hm-2、6.42%)[10]。本研究发现2000年后育成品种籼型血缘显著增加,与我国东北水稻21世纪初开始单产增幅显著提高相吻合,进一步验证籼粳杂交引入籼型血缘可以增加我国粳稻产量潜力,因此,从基因组层面揭示籼型血缘在东北水稻育种中的作用是未来在更高水平上突破粳稻育种瓶颈的关键之一。
3.2 全基因组高通量测序加速粳稻基因组相关研究
高通量测序技术的出现为解决粳稻基因组研究瓶颈提供了有效方法,应用高通量测序技术获得的高密度标记,成功追踪了亚洲栽培稻的驯化起源和水稻育种过程中的基因组印记[30-31]。几项大规模水稻群体的深度测序和表型观测为水稻研究和育种提供了宝贵的基因组信息和种质资源[3, 32]。3 000份水稻(3K-RGP)项目广泛收集和测序了世界主要水稻产区的种质资源,成为水稻群体遗传研究的一个里程碑[5]。对我国不同时期代表性的816份和546份粳稻品种进行二代重测序发现,20世纪80年代以来粳稻品种的籼型血缘持续增加,生育期、低温结实率、稻瘟病抗性和粒形上表现出显著的年代差异,使粳稻的重要农艺性状发生了显著变化[33-34]。虽然基于高通量测序技术的水稻基因组研究已经广泛开展,但是对于籼型血缘在我国粳稻育种中的作用还有待探讨。本研究通过对籼粳交重组自交系和我国不同年代粳稻主栽品种的分析发现,籼型血缘的引入主要增加了粒长和每穗粒数,而且2000年后推广的品种籼型血缘显著高于2000年之前。这与基于2004—2018年全国水稻区试试验的结果相吻合,我国北方粳稻2004—2018年的增产主要得益于每穗粒数的增加[35]。2000年后育成品种籼型血缘增加显著提高了北方粳稻的每穗粒数,进而提升了北方粳稻的产量潜力。本研究还发现,随着籼型血缘渗入,我国北方粳稻品种中引入了籼型的抗性、育性、株型和抽穗期相关基因。
3.3 基因编辑技术改善籼粳杂交育种的遗传累赘现象
CRISPR基因编辑技术自2013年首次应用于水稻之后发展迅速[36],应用CRISPR技术成功鉴定了大量水稻基因功能[37-38],并构建了大量CRISPR基因敲除突变体库[39]。华南农业大学刘耀光院士团队利用CRISPR/Cas9基因编辑技术进行转录水平和转录后水平调控,对水稻Wx等位基因的启动子区域、非编码区和内含子剪接点进行基因编辑,成功得到了多个新等位基因,新等位基因可产生不同直链淀粉含量的籼稻新种质资源[40]。扬州大学刘巧泉团队通过CRISPR/Cas9技术编辑水稻启动子上的关键顺式作用元件,得到了一个温和调节表达的启动子靶位点,获得了6种农艺性状良好的新等位基因及其新种质资源,有潜力应用于稻米品质改良育种[41]。李家洋院士团队通过基于平铺删除策略的CRISPR/ Cas9技术,创制了在启动子中含有54 bp缺失的等位基因,该区域可以与结合以抑制穗中的表达,导致次级和小穗分生组织受到抑制,进而同时增加穗数和每穗粒数,从而提高水稻产量,说明平铺缺失筛选方法可以用来平衡植物育种中的基因多效性[42]。本研究应用CRISPR/Cas9基因编辑技术对盐丰47的位点进行定点基因敲除,在不改变盐丰47其他农艺性状的同时改善其垩白性状。
4 结论
籼粳稻杂交育种中,籼型血缘渗入主要通过增加每穗粒数增加粳稻产量潜力,同时对粳稻碾磨品质有负面影响。通过全基因组高通量测序挖掘籼粳杂交育种过程中因遗传累赘所引入的不良等位基因,应用CRISPR/Cas9基因编辑技术对不良等位基因进行快速准确的改良,是一种高效的育种辅助手段。
[1] Garris A J, Tai T H, Coburn J,KRESOVICH S, MCCOUCH S. Genetic structure and diversity inL.. Genetics, 2005, 169(3): 1631-1638.
[2] Huang XH, WEI X H, SANG T, ZHAO Q, FENG Q, ZHAO Y, LI C Y, ZHU C R, LU T T, ZHANG Z W, LI M, FAN D L, GUO Y L, WANG A H, WANG L, DENG L W, LI W J, LU Y Q, WENG Q J, LIU K Y, HUANG T, ZHOU T Y, JING Y F, LI W, LIN Z, BUCKLER E S, QIAN Q, ZHANG Q F, LI J Y, HAN B. Genome-wide association studies of 14 agronomic traits in rice landraces. Nature Genetics, 2010, 42(11): 961-967.
[3] Huang X H, ZHAO Y, WEI X H, LI C Y, WANG A H, ZHAO Q, LI W J, GUO Y L, DENG L W, ZHU C R, FAN D L, LU Y Q, WENG Q J, LIU K Y, ZHOU T Y, JING Y F, SI L Z, DONG G J, HUANG T, LU T T, FENG Q, QIAN Q, LI J Y, HAN B. Genome-wide association study of flowering time and grain yield traits in a worldwide collection of rice germplasm. Nature Genetics, 2012, 44(1): 32-39.
[4] Yu H, Lin T, Meng X B, DU H L, ZHANG J K, LIU G F, CHEN M J, JING Y H, KOU L Q, LI X X, GAO Q, LIANG Y, LIU X D, FAN Z L, LIANG Y T, CHENG Z K, CHEN M S, TIAN Z X, WANG Y H, CHU C C, LI J Y. A route todomestication of wild allotetraploid rice. Cell, 2021, 184(5): 1156-1170. e14.
[5] Wang W S, MAULEON R, HU Z Q, CHEBOTAROV D, TAI S S, WU Z C, LI M, ZHENG T Q, FUENTES R R, ZHANG F, MANSUETO L, COPETTI D, SANCIANGCO M, PALIS K C, XU J L, SUN C, FU B Y, ZHANG H L, GAO Y M, ZHAO X Q, SHEN F, CUI X, YU H, LI Z C, CHEN M L, DETRAS J, ZHOU Y L, ZHANG X Y, ZHAO Y, KUDRNA D, WANG C C, LI R, JIA B, LU J Y, HE X C, DONG Z T, XU J B, LI Y H, WANG M, SHI J X, LI J, ZHANG D B, LEE S, HU W S, POLIAKOV A, DUBCHAK I, ULAT V J, BORJA F N, MENDOZA J R, ALI J, LI J, GAO Q, NIU Y C, YUE Z, NAREDO M E B, TALAG J, WANG X Q, LI J J, FANG X D, YIN Y, GLASZMANN J C, ZHANG J W, LI J Y, HAMILTON R S, WING R A, RUAN J, ZHANG G Y, WEI C C, ALEXANDROV N, MCNALLY K L, LI Z K, LEUNG H. Genomic variation in 3,010 diverse accessions of Asian cultivated rice. Nature, 2018, 557(7703): 43-49.
[6] Wei X, Qiu J, Yong K C, FAN J J, ZHANG Q, HUA H, LIU J, WANG Q, OLSEN K M, HAN B, HUANG X H. A quantitative genomics map of rice provides genetic insights and guides breeding. Nature Genetics, 2021, 53(2): 243-253.
[7] Liu Y Q, WANG H R, JIANG Z M, WANG W, XU R N, WANG Q H, ZHANG Z H, LI A F, LIANG Y, OU S J, LIU X J, CAO S Y, TONG H N, WANG Y H, ZHOU F, LIAO H, HU B, CHU C C. Genomic basis of geographical adaptation to soil nitrogen in rice. Nature, 2021, 590(7847): 600-605.
[8] Zhou G, Chen Y, Yao W, ZHANG C J, XIE W B, HUA J P, XING Y Z, XIAO J H, ZHANG Q F. Genetic composition of yield heterosis in an elite rice hybrid. Proceedings of the National Academy of Sciencesof the United States of America, 2012, 109(39): 15847-15852.
[9] 杨守仁, 赵纪书. 籼粳稻杂交问题之研究. 农业学报, 1959, 10 (4): 256-268.
Yang S R, Zhao J S. A study on the problem of cross between XI and GJ rice. Acta Agriculture Sinica, 1959, 10(4): 256-268. (in Chinese)
[10] 徐正进, 陈温福. 中国北方粳型超级稻研究进展. 中国农业科学, 2016, 49(2): 239-250.
Xu Z j, Chen W f. Research progress and related problems on japonica super rice in northern China. Scientia Agricultura Sinica, 2016, 49(2): 239-250. (in Chinese)
[11] 徐铨, 唐亮, 徐凡, 福嶌阳, 黄瑞冬, 陈温福, 徐正进. 粳稻食味品质改良研究现状与展望. 作物学报, 2013, 39(6): 961-968.
Xu Q, Tang L, Xu F, fu d y, HUANG R D, CHEN W F, XU Z J. Research advances and prospects of eating and quality improvement inrice (L.) Acta Agronomica Sinica, 2013, 39(6): 961-968. (in Chinese)
[12] Li X k, Wu L, Wang J H, SUN J, XIA X H, GENG X, WANG X H, XU Z J, XU Q. Genome sequencing of rice subspecies and genetic analysis of recombinant lines reveals regional yield- and quality- associated loci. BMC Biology, 2018, 16(1): 102.
[13] Ashikari M, Sakakibara H, Lin S Y, YAMAMOTO T, TAKASHI T, NISHIMURA A, ANGELES E R, QIAN Q, KITANO H, MATSUOKA M. Cytokinin oxidase regulates rice grain production. Science, 2005, 309(5735): 741-745.
[14] Wang Y, Li F c, Zhang F,WU L, XU N, SUN Q, CHEN H, YU Z W, LU J H, JIANG K, WANG X C, WEN S Y, ZHOU Y, ZHAO H, JIANG Q, WANG J H, JIA R Z, SUN J, TANG L, XU H, HU W, XU Z J, CHEN W F, GUO A P, XU Q. Time-ordering japonica/geng genomes analysis indicates the importance of large structural variants in rice breeding. Plant Biotechnology Journal, 2023, 21(1): 202-218.
[15] Zhang F, Xue H z, Dong X r, LI M, ZHENG X M, LI Z K, XU J L, WANG W S, WEI C C. Long-read sequencing of 111 rice genomes reveals significantly larger pan-genomes. Genome Research, 2022, 32(5): 853-863.
[16] Qin P, Lu H W, DU H L, WANG H, CHEN W L, CHEN Z, HE Q, OU S J, ZHANG H Y, LI X Z, LI X X, LI Y, LIAO Y, GAO Q, TU B, YUAN H, MA B T, WANG Y P, QIAN Y W, FAN S J, LI S G. Pan-genome analysis of 33 genetically diverse rice accessions reveals hidden genomic variations. Cell, 2021, 184(13): 3542-3558. e16.
[17] Ghosh A, Pareek A, Sopory S K, SINGLA-PAREEK S L. A glutathione responsive rice glyoxalase II, OsGLYII-2, functions in salinity adaptation by maintaining better photosynthesis efficiency and anti-oxidant pool. The Plant Journal, 2014, 80(1): 93-105.
[18] Du H, Wang N L, CUI F, LI X H, XIAO J H, XIONG L Z. Characterization of the beta-carotene hydroxylase gene DSM2 conferring drought and oxidative stress resistance by increasing xanthophylls and abscisic acid synthesis in rice. Plant Physiology, 2010, 154(3): 1304-1318.
[19] Zou J, Liu AL, CHEN X B, ZHOU X Y, GAO G F, WANG W F, ZHANG X W. Expression analysis of nine rice heat shock protein genes under abiotic stresses and ABA treatment. Journal of Plant Physiology, 2009, 166(8): 851-861.
[20] Zhou L Y, NI E D, YANG J W, ZHOU H, LIANG H, LI J, JIANG D G, WANG Z H, LIU Z L, ZHUANG C X. Rice OsGL1-6 is involved in leaf cuticular wax accumulation and drought resistance. PlosOne, 2013, 8(5): e65139.
[21] Liu Y q, Wu H, Chen H, LIU Y L, HE J, KANG H Y, SUN Z G, PAN G, WANG Q, HU J L, ZHOU F, ZHOU K N, ZHENG X M, REN Y L, CHEN L M, WANG Y H, ZHAO Z G, LIN Q B, WU F Q, ZHANG X, GUO X P, CHENG X N, JIANG L, WU C Y, WANG H Y, WAN J M. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice. Nature Biotechnology, 2015, 33(3): 301-305.
[22] Zhao H J, WANG X Y, JIA Y L, MINKENBERG B, WHEATLEY M, FAN J B, JIA M H, FAMOSO A, EDWARDS J D, WAMISHE Y, VALENT B, WANG G L, YANG Y N. The rice blast resistance gene Ptr encodes an atypical protein required for broad-spectrum disease resistance. Nature Communications, 2018, 9: 2039.
[23] Zhou H, Zhou M, Yang Y Z, LI J, ZHU L Y, JIANG D G, DONG J F, LIU Q J, GU L F, ZHOU L Y, FENG M J, QIN P, HU X C, SONG C L, SHI J F, SONG X W, NI E D, WU X J, DENG Q Y, LIU Z L, CHEN M S, LIU Y G, CAO X F, ZHUANG C X. RNaseZS1processesUbmRNAs and controls thermosensitive genic male sterility in rice. Nature Communications, 2014, 5: 4884.
[24] Zhang P P, ZHANG Y X, SUN L P, SINUMPORN S, YANG Z F, SUN B, XUAN D D, LI Z H, YU P, WU W X, WANG K J, CAO L Y, CHENG S H. The rice AAA-ATPase OsFIGNL1 is essential for male meiosis. Frontiers in Plant Science, 2017, 8: 1639.
[25] Song S y, Chen Y, Liu L, SEE Y H B, MAO C Z, GAN Y B, YU H. OsFTIP7 determines auxin-mediated anther dehiscence in rice. Nature Plants, 2018, 4(7): 495-504.
[26] Zhou L J, Xiao L T, Xue H W. Dynamic cytology and transcriptional regulation of ricejoint development. Plant Physiology, 2017, 174(3): 1728-1746.
[27] Zhang J, Fan X w, Hu Y, ZHOU X C, HE Q, LIANG L W, XING Y Z. Global analysis of CCT family knockout mutants identifies four genes involved in regulating heading date in rice. Journal of Integrative Plant Biology, 2021, 63(5): 913-923.
[28] Li Y b, Fan C c, Xing YZ, JIANG Y H, LUO L J, SUN L, SHAO D, XU C J, LI X H, XIAO J H, HE Y Q, ZHANG Q F. Natural variation in GS5 plays an important role in regulating grain size and yield in rice. Nature Genetics, 2011, 43(12): 1266-1269.
[29] Li Y b, Fan C c, Xing Y Z, YUN P, LUO L J, YAN B, PENG B, XIE W B, WANG G W, LI X H, XIAO J H, XU C G, HE Y Q. Chalk5 encodes a vacuolar H+-translocating pyrophosphatase influencing grain chalkiness in rice. Nature Genetics, 2014, 46(4): 398-404.
[30] Huang X h, Kurata N, Wei X H, WANG Z X, WANG A H, ZHAO Q, ZHAO Y, LIU K Y, LU H Y, LI W J, GUO Y L, LU Y Q, ZHOU C C, FAN D L, WENG Q J, ZHU C R, HUANG T, ZHANG L, WANG Y C, FENG L, FURUUMI H, KUBO T, MIYABAYASHI T, YUAN X P, XU Q, DONG G J, ZHAN Q L, LI C Y, FUJIYAMA A, TOYODA A, LU T T, FENG Q, QIAN Q, LI J Y, HAN B. A map of rice genome variation reveals the origin of cultivated rice. Nature, 2012, 490(7421): 497-501.
[31] Xie W B, WANG G W, YUAN M, YAO W, LYU K, ZHAO H, YANG M, LI P B, ZHANG X, YUAN J, WANG Q X, LIU F, DONG H X, ZHANG L J, LI X L, MENG X Z, ZHANG W, XIONG L Z, HE Y Q, WANG S P, YU S B, XU C G, LUO J, LI X H, XIAO J H, LIAN X M, ZHANG Q F. Breeding signatures of rice improvement revealed by a genomic variation map from a large germplasm collection. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(39): E5411-E5419.
[32] Zhao K Y, TUNG C W, EIZENGA G C, WRIGHT M H, ALI M L, PRICE A H, NORTON G J, ISLAM M R, REYNOLDS A, MEZEY J, MCCLUNG A M, BUSTAMANTE C D, MCCOUCH S R. Genome- wide association mapping reveals a rich genetic architecture of complex traits in. Nature Communications, 2011, 2: 467.
[33] Cui D, Zhou H, Ma X D, LIN Z C, SUN L H, HAN B, LI M M, SUN J C, LIU J, JIN G X, WANG X J, CAO G L, DENG X W, HE H, HAN L Z. Genomic insights on the contribution of introgressions from Xian/to the genetic improvement of Geng/rice cultivars. Plant Communication, 2022, 3(3): 100325.
[34] Chen Z, Bu Q Y, LIU G F, WANG M Q, WANG H R, LIU H Z, LI X F, LI H, FANG J, LIANG Y, TENG Z F, KANG S, YU H, CHENG Z K, XUE Y B, LIANG C Z, TANG J Y, LI J Y, CHU C C. Genomic decoding of breeding history to guide breeding-by-design in rice. National Science Review, 2023, 10(5): nwad029.
[35] Fei C, Xu Q, Xu Z J, CHEN W F. Effect of rice breeding process on improvement of yield and quality in China. Rice Science, 2020, 27(5): 363-367.
[36] Shan Q W, Wang Y P, Li J, ZHANG Y, CHEN K L, LIANG Z, ZHANG K, LIU J X, XI J J, QIU J L, GAO C X. Targeted genome modification of crop plants using a CRISPR-Cas system. Nature biotechnology, 2013, 31(8): 686-688.
[37] Cui Y, Zhu M M, Xu Z J, XU Q. Assessment of the effect of ten heading time genes on reproductive transition and yield components in rice using a CRISPR/Cas9 system. Theoretical and Applied Genetics, 2019, 132(6): 1887-1896.
[38] Cui Y, Jiang N, Xu Z J, XU Q. Heterotrimeric G protein are involved in the regulation of multiple agronomic traits and stress tolerance in rice. BMC Plant Biology, 2020, 20(1): 90.
[39] Lu Y M, YE X, GUO R M, HUANG J, WANG W, TANG J Y, TAN L T, ZHU J K, CHU C C, QIAN Y W. Genome-wide targeted mutagenesis in rice using the CRISPR/Cas9 system. Molecular Plant, 2017, 10(9): 1242-1245.
[40] Zeng D C, LIU T L, MA X L, WANG B, ZHENG Z Y, ZHANG Y L, XIE X R, YANG B W, ZHAO Z, ZHU Q L, LIU Y G. Quantitative regulation of Waxy expression by CRISPR/Cas9-based promoter and 5'UTR-intron editing improves grain quality in rice. Plant Biotechnology Journal, 2020, 18(12): 2385-2387.
[41] Huang L C, LI Q F, ZHANG C Q, CHU R, GU Z W, TAN H Y, ZHAO D S, FAN X L, LIU Q Q. Creating novel Wx alleles with fine-tuned amylose levels and improved grain quality in rice by promoter editing using CRISPR/Cas9 system. Plant Biotechnology Journal, 2020, 18(11): 2164-2166.
[42] Song X G, MENG X B, GUO H Y, CHENG Q, JING Y H, CHEN M J, LIU G F, WANG B, WANG Y H, LI J Y, YU H. Targeting a gene regulatory element enhances rice grain yield by decoupling panicle number and size. Nature Biotechnology, 2022, 40(9): 1403-1411.
The effect of/Xian pedigree introgression in/Geng rice breeding in China
Xu Hai1, Li Xiukun1,2, Lu Jiahao1, Jiang Kai1, Ma Yue1, Xu Zhengjin1, Xu Quan1
1Rice Research Institute, Shenyang Agricultural University, Shenyang 110866;2College of Agronomy, Hebei Agricultural University/State Key Laboratory of North China Crop Improvement and Regulation/Key Laboratory for Crop Germplasm Resources of Hebei, Baoding 071001, Hebei
【Objective】To demonstrate the impact of(XI) pedigree introgression on the yield and quality of(GJ) rice varieties, providing a theoretical basis and genomic resources for optimizing XI pedigree introgression breeding programs in northern GJ rice.【Method】In this study, the whole genome sequence on Illumina platform was employed to elucidate the effects of XI pedigree introgression on the yield and quality of rice in Northeast China were analyzed using recombinant inbred lines (RIL) derived from the cross between XI and GJ varieties, and 74 major GJ varieties grown from Heilongjiang, Liaoning, Shandong, and Jiangsu provinces as test materials. Using CRISPR/Cas9 gene editing technology to knock out the unfavorable genes introduced by XI pedigree introgression. 【Result】Analysis of RIL revealed a significant positive correlation between XI pedigree introgression and panicle length, grain length, and a negative correlation with head rice ratio. XI pedigree introgression was significantly negatively correlated with Amylose content, and significantly positively correlated with protein content in Jiangsu. With the increase of latitude, the correlation efficiency between XI pedigree introgression and grain shape increased, while the correlation between XI pedigree introgression and panicle length and head rice ratio decreased. The genomic fragments of XI pedigree introgression are unevenly distributed across different chromosomes and are more abundantly present on chromosomes 1, 10, 11, and 12. The XI pedigree introgression of the major cultivars in Jiangsu and Liaoning provinces is significantly higher than that in Heilongjiang and Shandong provinces, and the XI pedigree introgression of the cultivars after 2000 is significantly higher than that before 2000. The XI pedigree introgression includes multiple resistance and fertility-related genes. The project identified an XI pedigree introgression fragment on chromosome 5 of YF47, including the XI type grain regulatory geneand XI type chalkiness regulatory gene, which increased the 1000 grain weight of YF47 but affected its chalkiness-related traits. The project uses CRISPR/Cas9 technology to knock out thegene of YF47. The grain shape of the homozygous gene editing plants is similar to those of YF47, and its chalkiness character has been significantly improved. 【Conclusion】The XI pedigree introgression mainly increases the yield potential of GJ rice by increasing the number of grains per panicle, but has a negative impact on milling quality. Exploring the unfavorable alleles in varieties through high-throughput genome sequencing, combined with CRISPR/Cas9 gene editing, to break the genetic drag in breeding using the cross between XI and GJ, is an efficient breeding strategy that can quickly and accurately improve target traits.
rice;/Geng breeding;/Xian pedigree introgression; yield; quality; molecular design breeding

10.3864/j.issn.0578-1752.2023.22.001
2023-05-19;
2023-06-16
国家自然科学基金(32071982)
徐海,E-mail:chinaxuhai@163.com。通信作者徐铨,E-mail:kobexu34@syau.edu.cn
(责任编辑 李莉)
