血清NE、Sortilin与急性脑梗死患者颈动脉粥样硬化斑块的关系及对预后不良的预测价值*
秦学敏,王铁军,左丽君,段春苗
1.首都医科大学大兴教学医院神经内科,北京 102600;2.首都医科大学附属北京天坛医院神经内科,北京 100050
急性脑梗死(ACI)是脑局部供血下降或血流停止引起的脑组织坏死,其发病率、致死率和致残率较高,随着我国老龄化趋势不断发展,ACI已成为我国成人排名第一位的致死和致残疾病[1]。研究显示,颈动脉粥样硬化(CAS)是ACI的病理基础,而血管内皮炎症是导致CAS的主要因素,约1/3 ACI的发生与CAS斑块破裂有关[2]。相关研究证实,血管损伤及炎症反应在ACI发生和进展中扮演着重要角色[3-4]。目前临床尚缺乏有效评估ACI患者CAS斑块形成及预测ACI预后的方法和手段。因此,寻找安全、有效的血清标志物评估CAS发生风险有助于ACI的临床防治和预后的改善。
中性粒细胞弹性蛋白酶(NE)是中性粒细胞活化后释放的一种糖蛋白,具有蛋白水解活性,NE可通过蛋白水解作用参与脑损伤后的血脑屏障破坏,促进炎症细胞浸润,且可预测重症肺炎等炎症疾病的预后[5-6]。另有报道指出,NE对2型糖尿病合并CAS有较高的诊断效能[7]。分拣蛋白(Sortilin)是Vps10P受体家族成员,广泛分布于神经系统、血管壁及炎症细胞中,在动脉粥样硬化、血管壁炎症反应及颈动脉钙化中发挥重要作用[8-9]。HUANG等[10]研究发现,高水平的Sortilin与CAS及颈动脉斑块负荷有关。上述研究均说明NE、Sortilin与机体炎症反应及CAS形成密切相关,推测二者可能参与ACI的发生和发展。鉴于此,本研究分析NE、Sortilin与ACI患者CAS的关系及对预后不良的预测价值,以期为ACI的防治提供参考。
1 资料与方法
1.1一般资料 选取2020年12月至2022年11月首都医科大学大兴教学医院收治的155例ACI患者为研究对象,其中男98例,女57例;年龄45~79岁,平均(65.66±8.44)岁;体重指数(BMI) 19.4~26.7 kg/m2,平均(23.22±1.71)kg/m2;有吸烟史54例,有饮酒史64例,合并高血压94例,合并糖尿病32例;首次医疗接触时间<6 h,平均(3.45±1.05)h。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2018》[11]中ACI的诊断标准,且经头颅电子计算机断层扫描(CT)或磁共振成像(MRI)、实验室检查确诊;(2)首次发病,年龄18岁以上;(3)首次医疗接触时间<6 h;(4)入院24 h内进行美国国立卫生研究院卒中量表(NIHSS)评分;(5)患者或家属签订知情同意书。排除标准:(1)颅脑影像学检查明确伴有脑出血者;(2)大面积脑梗死者;(3)复发脑卒中者;(4)伴凝血功能障碍或其他血液系统疾病者;(4)近期有手术史者;(5)近期接受抗凝药物治疗者;(6)伴急慢性感染性疾病者;(7)合并严重心、肝、肾功能低下者;(8)合并精神疾病、自身免疫性疾病、恶性肿瘤者。另选取同期该院的40例体检健康者作为对照组,其中男24例,女13例;年龄46~79岁,平均(65.05±11.25)岁;BMI 20.3~26.4 kg/m2,平均(23.25±1.67)kg/m2;有吸烟史10例,有饮酒史14例。两组性别、年龄、BMI及吸烟史、饮酒史比例比较,差异无统计学意义(P>0.05),具有可比性。本研究已通过首都医科大学大兴教学医院医学伦理委员会审核批准。
1.2方法
1.2.1血清NE、Sortilin水平及实验室指标检测 ACI患者入组后未经治疗前、对照组体检时抽取空腹静脉血各8 mL,以3 200 r/min离心8 min(离心半径11.5 cm),取上清液。采用酶联免疫吸附试验(ELISA)检测血清NE、Sortilin水平,人NE ELISA试剂盒购自上海雅吉生物科技有限公司(货号:YS01709);人Sortilin ELISA试剂盒购自北京诺为生物技术有限公司(货号:EH433RB),按照试剂盒说明书检测450 nm波长处的吸光度值,根据标准曲线计算NE、Sortilin水平。
1.2.2颈动脉超声检查及分组 ACI患者入组后未经治疗前采用彩色多普勒超声诊断仪(美国GE,型号Voluson E10)测量颈动脉内膜中层厚度(IMT),检测颈总动脉、分叉处及颈内动脉血管的纵切面,IMT为血管后壁内膜与外膜间“双线征”的距离。根据IMT进行分组:IMT<1.0 mm为正常,纳入IMT正常组;IMT在1.0~1.2 mm为IMT增厚,纳入增厚组;IMT>1.2 mm为斑块形成,纳入斑块组。
1.2.3基线资料收集 利用本院病历系统收集ACI患者的基线资料,包括性别、年龄、BMI及吸烟史、饮酒史比例,是否合并高血压及糖尿病、脑梗死部位(脑干、基底节区、脑叶、多部位并存)、入院NIHSS评分、首次医疗接触时间;收集入院后治疗前的实验室指标,包括低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、甘油三酯(TG)、空腹血糖(FPG)、血红蛋白(Hb)、白蛋白(ALB)、肌酐(Scr)、尿酸(UA)、白细胞计数(WBC)。
1.2.4治疗方法 入院完善常规检查,根据《中国急性缺血性脑卒中诊治指南2018》[11]推荐方案进行ACI急性期诊断与治疗,排除静脉溶栓禁忌证者,即刻进行静脉溶栓改善脑血循环,同时给予吸氧、抗凝、营养脑神经等对症治疗。
1.2.5随访及分组 采用电话或门诊复查方式随访3个月,以随访截止时间、患者死亡或失访为终止事件。根据改良Rankin量表(mRS)评分评估患者预后,将0~<3分患者纳入预后良好组,将3~6分患者纳入预后不良组。
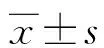
2 结 果
2.1IMT正常组、增厚组、斑块组及对照组血清NE、Sortilin水平及IMT值比较 ACI患者中IMT正常32例(20.64%)、增厚40例(25.81%)、斑块形成83例(53.55%)。IMT正常组、增厚组、斑块组血清NE、Sortilin水平高于对照组,增厚组和斑块组血清NE、Sortilin水平及IMT值高于IMT正常组,且斑块组高于增厚组,差异均有统计学意义(P<0.05)。见表1。
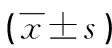
表1 IMT正常组、增厚组、斑块组及对照组血清NE、Sortilin水平及IMT比较
2.2血清NE、Sortilin水平与IMT的相关性分析 Pearson相关分析显示,血清NE、Sortilin水平与IMT均呈正相关(r=0.509、0.483,P<0.05),见图1。
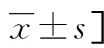
表2 预后良好组与预后不良组基线资料比较[n(%)或
2.3预后良好组与预后不良组基线资料比较 ACI患者均随访3个月,无失访者,预后不良61例(预后不良组),预后良好94例(预后良好组),预后不良发生率为39.35%(61/155)。预后不良组合并糖尿病占比及年龄、入院NIHSS评分、LDL-C、TC、FPG、WBC、Scr、UA、NE、Sortilin水平均高于预后良好组(P<0.05);两组性别,BMI,吸烟史、饮酒史比例,合并高血压、脑梗死部位比例,首次医疗接触时间及HDL-C、TG、Hb、ALB水平比较,差异无统计学意义(P>0.05)。见表2。
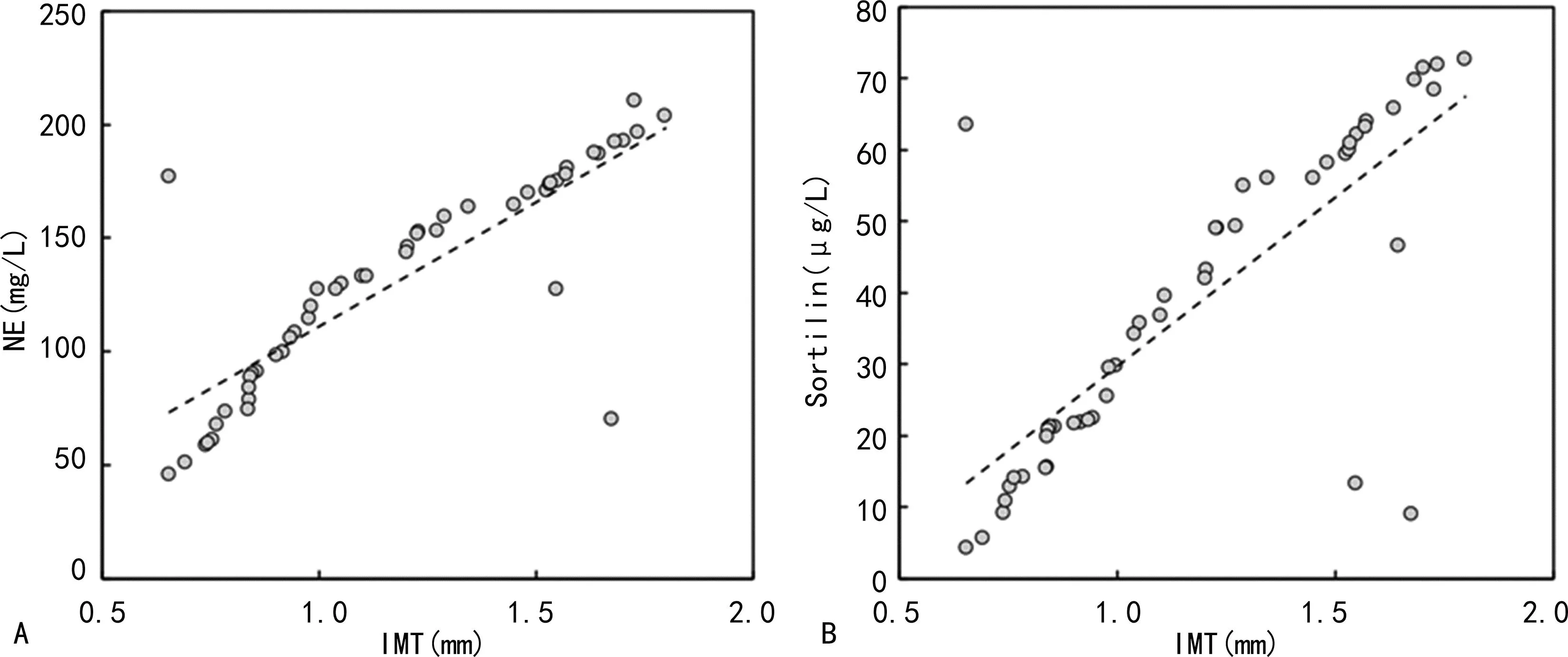
注:A为血清NE水平与IMT的Pearson相关分析散点图;B为血清Sortilin水平与IMT的Pearson相关分析散点图。
2.4多因素Logistic回归分析ACI患者的影响因素分析 分析设计:建立多因素Logistic回归模型,以ACI短期预后(随访3个月)为因变量,赋值:预后不良=1,预后良好=0。以前述单因素分析中P<0.10的指标为自变量。采用逐步后退法进行自变量的选择和剔除,设定α剔除=0.10,α入选=0.05。结果显示,入院NIHSS评分及UA、NE、Sortilin水平均是导致ACI患者预后不良的独立危险因素(P<0.05,OR>1)。见表3。
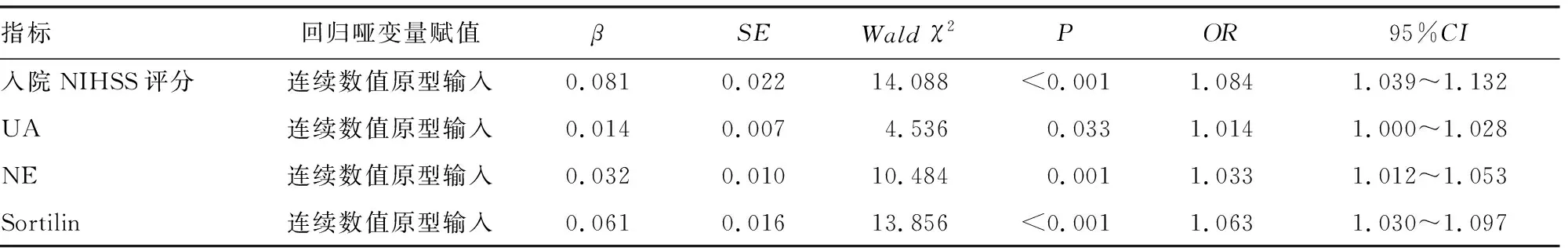
表3 多因素Logistic回归分析ACI患者预后的危险因素
2.5血清UA、NE、Sortilin单独及联合应用对ACI患者预后不良的预测价值 径前述多因素Logistic回归分析结果,建立风险评估预测模型,以其LogP=0.014×UA +0.032×NE +0.061×Sortilin(去除常数项和NIHSS评分项)为联合应用的虚拟概率量指标,再行ROC曲线分析。分析结果显示,血清NE、Sortilin、UA这3个指标单独及联合应用的AUC(95%CI)分别为0.695(0.413~0.952)、0.740(0.526~0.944)、0.752(0.494~0.983)、0.869(0.758~0.981)。联合应用模型的预测效能很高,AUC及灵敏度、特异度、准确度均高于各指标单独应用。见图2、表4。
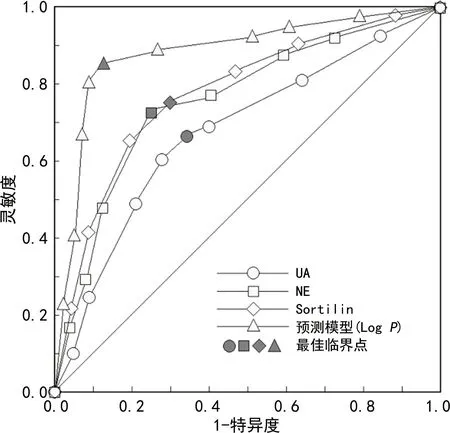
图2 血清UA、NE、Sortilin单独及联合应用预测ACI患者预后不良的ROC曲线

表4 血清UA、NE、Sortilin单独及联合应用对ACI患者预后不良的预测价值
3 讨 论
CAS是ACI最常见的病理生理学基础,CAS斑块形成并发展至一定程度会导致脑梗死[12]。炎症反应在CAS进展过程中起关键作用,血管内皮细胞激活介导炎症反应,大量炎症细胞或细胞因子作用于LDL-C形成氧化型低密度脂蛋白(ox-LDL)聚集于血管内壁,此外,大量巨噬细胞、炎症细胞渗出物质紧贴细胞壁,导致CAS斑块破裂及血栓形成,最终引起ACI[13]。因此,寻找能够准确、有效反映CAS进程的可靠血清标志物对ACI的早期防治及预后评估十分必要。研究显示,IMT对血管事件的发生具有独立预测价值,且CAS斑块形成与脑梗死之间存在因果关系[14]。现阶段临床中评估颈动脉病变的方法多种,包括超声、数字血管造影、数字减影血管造影等,虽然诊断效果确切,但部分方法有创,且无法评估预后,临床尚缺乏可靠的、能够预测CAS形成的血清标志物。本研究就此展开分析。
本研究发现,血清NE、Sortilin水平在对照组、IMT正常组、增厚组、斑块组中依次升高,Pearson相关分析显示,血清NE、Sortilin水平与IMT均呈正相关,提示ACI患者血清NE、Sortilin水平升高,与CAS程度密切相关。NE属于糜蛋白酶超家族成员,生理状态下储存于中细粒细胞初级颗粒中,炎症反应发生时中性粒细胞活化,NE迅速释放至细胞外,因此NE作为炎症介质能促进炎症细胞浸润,同时发挥内源性抑制剂、蛋白水解等作用[15]。有研究发现,NE能够通过靶向Toll样受体4/核因子-κB信号通路促进血管新生内膜增生(NH),而在NE缺陷小鼠中NH明显减少[16]。OH等[17]研究发现,循环血中NE水平与慢性血液透析患者的动静脉瘘狭窄程度呈正相关,推测NE通过促进先天性免疫炎症反应发生,从而导致动静脉瘘狭窄。因此,NE水平升高能通过促进炎症反应、NH,从而参与血管狭窄及CAS形成,诱导ACI的发生。Sortilin是一种Ⅰ型跨膜蛋白,主要存在于高尔基体、细胞膜中,近年来其在心脑血管中的作用受到广泛关注[18]。有研究显示,血清Sortilin水平在原发性高血压患者中升高,且与IMT呈正相关,提示高水平的Sortilin能明显增加原发性高血压发生及CAS风险[19]。SIMSEK等[20]研究证实,Sortilin水平与CAS狭窄程度呈正相关,其预测重度狭窄CAS有较高的灵敏度(83.49%)。由此推测NE、Sortilin可能通过促进CAS的形成导致ACI的发生。本研究也显示NE、Sortilin与IMT均呈正相关,分析NE、Sortilin水平升高导致CAS斑块增厚的可能原因为二者水平升高能够通过激活炎症反应,导致脂质代谢紊乱,影响血管内皮细胞功能,从而导致CAS及其不稳定斑块增厚,参与ACI的发生[21-22],提示NE、Sortilin可能成为CAS相关心脑血管疾病治疗的有效靶点。
本研究采用多因素Logistic回归分析发现,NIHSS评分、UA水平是导致ACI患者预后不良的独立危险因素。高NIHSS评分提示神经功能损伤严重,就诊时NIHSS评分偏高是ACI预后不良的独立危险因素已被证实[23]。UA是嘌呤代谢终产物,是一种强抗氧化剂,能够防止LDL-C氧化形成ox-LDL,清除血液中60%的自由基,但过高的UA可能引起氧化应激等不良反应[24]。多项研究证实,高水平UA是ACI患者预后不良的独立危险因素[25-26],与本研究结果一致。此外,本研究发现NE、Sortilin水平均是导致ACI患者预后不良的独立危险因素。生理情况下,中枢神经系统受血脑屏障保护作用而免受血源性炎症侵害,ACI后血脑屏障结构和功能会发生破坏,血管内皮细胞受损,基膜连续性被破坏,血脑屏障通透性增加。NE水平升高能释放大量氧自由基、弹性蛋白酶、细胞因子等,发挥较强的蛋白水解作用,从而进一步加剧血脑屏障的破坏[27],促进ACI后脑损伤,从而导致患者预后不良。MA等[28]发现,通过激活创伤性脑损伤小鼠NE能够加速血脑屏障的破坏,抑制NE活性能够减轻血脑屏障的破坏。LEINWEBER等[29]应用NE抑制剂干预短暂大脑中动脉闭塞小鼠,研究结果显示小鼠血脑屏障、炎症损伤减轻,小鼠神经功能得到改善,病死率降低。此外,NE从中性粒细胞中释放后,还能诱导白细胞介素-8、核因子-κB、细胞间黏附分子等生成,从而促进中性粒细胞黏附和浸润,促进炎症反应[15-16]。上述研究说明NE高水平可能通过加速破坏血脑屏障,加重ACI后脑组织继发性炎症损伤,从而增加预后不良风险。BISCETTI等[30]研究发现,糖尿病合并外周动脉疾病患者血清Sortilin水平升高,Sortilin高水平与患者预后的主要不良心血管事件(MACE)有关,对MACE发生有较高预测价值(AUC为0.94)。由此推测Sortilin水平升高增加ACI患者预后不良风险的可能机制为高水平Sortilin能够促进血管粥样硬化斑块形成,导致ACI患者预后不良风险增加,但具体机制尚待深入研究。本研究进一步经ROC曲线分析发现,血清NE、Sortilin及UA三者单独及联合预测ACI患者随访3个月后预后不良的AUC为0.695、0.740、0.752、0.869。显然,包括血清NE、Sortilin在内的联合预测效能明显高于各指标单独检测,说明检测血清NE、Sortilin水平有助于辅助预测ACI患者预后。
综上所述,ACI患者血清NE、Sortilin水平升高,与CAS呈正相关,且是影响患者预后不良的独立危险因素,检测血清NE、Sortilin水平有助于辅助判断ACI患者预后。但本研究仍存在样本量小及随访时间短的不足,在接下来的研究中会进一步扩大样本量,并观察NE、Sortilin对ACI患者远期预后的影响,为ACI的临床防治提供更充足的支持。

