miR-432-5p靶向调控DDX41对胃癌细胞增殖、转移和放疗敏感性的影响*
李 伟,左嘉玮,马媛媛,乔 岩,周立庆
徐州医科大学附属淮安医院/淮安市第二人民医院肿瘤放射治疗科,江苏淮安 223022
胃癌是世界上最常见的恶性肿瘤之一,大多数患者确诊时已处于晚期。尽管关于胃癌治疗策略的研究已经取得很大进展,但胃癌复发和转移使患者死亡率仍然很高,预后不良[1-2]。胃癌的治疗包括临床手术、放疗、化疗和分子靶向治疗等多种方式,其中放疗在控制局部复发方面起着至关重要的作用[3-4]。因此,探索胃癌发病的潜在机制对于放疗有效性的提高具有重要意义。目前,一些生物标志物如微小RNA(miRNA)被广泛用于胃癌诊断或预后,miRNA是一类小的非编码RNA,与癌症发展和放疗的改善有关[5]。有研究表明,miR-144-3p通过靶向锌指E盒结合蛋白1增强胃癌细胞放疗敏感性,miR-432-5p能够抑制卵巢癌、肝细胞癌和鼻咽癌等多种肿瘤的发展,是一种重要的肿瘤抑制分子[6-7]。研究发现,miR-432-5p在胃癌细胞中通过被环状RNA海绵化来发挥肿瘤抑制功能[8]。DEAD-盒解旋酶41(DDX41)是一种高度保守的蛋白质,其作为干扰素基因(STING)刺激物上游的DNA传感器,在不同类型的癌症中可能具有双重作用[9]。本研究以胃癌细胞为研究对象,利用分子生物学技术探讨miR-432-5p和DDX41在胃癌细胞中的表达差异及二者之间的靶向关系,再进一步研究二者对胃癌细胞增殖、转移和放疗敏感性的调节作用。
1 材料与方法
1.1材料 人正常胃黏膜上皮细胞GES-1购自尚恩生物技术有限公司,人胃癌细胞MKN-45、HGC-27、NCI-N87均购自武汉普诺赛生命科技公司。SPF级BALB/c裸鼠,体重(20±2)g,购自厦门大学,许可证号:SCXK(闽)2018-0003,置于温度20~24 ℃,湿度50%~60%的环境中饲养,光照12 h和黑暗12 h交替。动物实验通过本院动物伦理委员会批准。
1.2仪器与试剂 CFX Connect荧光定量PCR仪(美国伯乐公司),SpectraMax多功能酶标仪(美谷分子仪器公司),BD FACSCalibur流式细胞仪(美国BD公司)。一步法荧光定量试剂盒(南京诺唯赞),Lipofectamine 3000转染试剂(上海恒斐生物科技有限公司),MTT细胞增殖检测试剂盒(北京索莱宝科技有限公司),Annexin V-FITC/PI凋亡检测试剂盒(弗元生物科技有限公司),0.1%结晶紫染色液(北京伊塔生物科技有限公司),Transwell小室(康宁生命科学有限公司),miR-432-5p mimics及其阴性对照(miR-NC)、pcDNA-DDX41及其阴性对照(pcDNA-NC)序列构建(吉满生物科技有限公司),miR-432-5p和DDX41引物设计及合成(广州吉赛生物科技股份有限公司),DDX41、GAPDH兔多抗、山羊抗兔IgG(英国Abcam公司)。
1.3方法
1.3.1细胞培养 将人正常胃黏膜上皮细胞GES-1和人胃癌细胞MKN-45、HGC-27、NCI-N87分别接种于含有10%胎牛血清(FBS)和1%双抗(青霉素-链霉素)的RPMI-1640培养基中,置于37 ℃,5%CO2的培养箱中培养。待细胞融合率在80%~90%时进行传代,取第3代生长状态较好的细胞进行后续实验。
1.3.2实时荧光定量PCR(qRT-PCR)检测细胞中miR-432-5p、DDX41的表达 分别收集人正常胃黏膜上皮细胞和人胃癌细胞,利用Trizol法提取总RNA。然后利用一步法荧光定量试剂盒进行qRT-PCR反应,反应体系:2×SYBR Green Mix 10 μL,Enzyme 1 μL,上、下游引物各0.5 μL,RNA 1 μL,加ddH2O至总体积20 μL。反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,共40个循环。以U6、GAPDH为内参,采用2-ΔΔCt计算细胞中miR-432-5p和DDX41 mRNA的相对表达水平,引物序列见表1。

表1 qRT-PCR引物
1.3.3细胞转染 取第3代且生长状态较好的HGC-27细胞,用Lipofectamine 3000转染试剂进行转染分组:NC组(未转染质粒)、miR-NC组(转染miR-432-5p mimics阴性对照)、miR-432-5p组(转染miR-432-5p mimics)、miR-432-5p+pcDNA-NC组(转染miR-432-5p和pcDNA-DDX41阴性对照)、miR-432-5p+pcDNA-DDX41组(转染miR-432-5p mimics和pcDNA-DDX41),48 h后收集细胞,根据1.3.2的实验步骤提取细胞RNA并检测各组细胞中miR-432-5p和DDX41 mRNA的表达,确定转染效率。
1.3.4MTT检测细胞增殖活性 将HGC-27细胞以1×104个/孔的密度接种到96孔板中,按照转染分组培养48 h后,每孔加入10 μL MTT(5 mg/mL)溶液再培养4 h。然后加入100 μL二甲基亚砜混匀,并孵育10 min,用酶标仪在490 nm处测量吸光度,并计算细胞存活率。
1.3.5Transwell实验检测细胞的迁移能力 将转染培养48 h后的HGC-27细胞接种至Transwell上室中(2×104个/孔),并在上室加入200 μL的无血清培养基,下室加入750 μL含有10% FBS的培养基,在37 ℃下培养24 h。然后将迁移膜外的细胞用4%多聚甲醛固定20 min,再用0.1%结晶紫染色10 min,最后在显微镜下对迁移的细胞进行计数。
1.3.6克隆形成实验检测细胞的放疗敏感性 将HGC-27细胞转染培养48 h后,利用X射线装置以2 Gy/min的剂量率对各组细胞照射4 Gy的放疗剂量,24 h后收集细胞并接种至12孔板中(500个/孔),培养10 d后,弃培养液,将细胞用甲醇固定30 min,然后用0.1%结晶紫染色15 min,最后在显微镜下分析菌落形成并对形成菌落进行计数。
1.3.7流式细胞术检测放疗后细胞的凋亡情况 将转染培养后的细胞按照1.3.6的方法进行放疗,在37 ℃培养48 h。收集各组细胞并用PBS清洗,然后将细胞悬浮在300 μL结合缓冲液中,向每个样品中加入5 μL Annexin V-FITC和5 μL PI,室温下避光孵育15 min,用流式细胞仪和FlowJo软件分析细胞凋亡情况,计算细胞凋亡率。
1.3.8双荧光素酶报告基因实验 首先,通过ENCORI信息网站预测miR-432-5p和DDX41在3′UTR上的结合位点。然后,将DDX41序列片段克隆到pmirR-GLO载体中,构建DDX41-WT野生型质粒,并利用突变的DDX41片段构建DDX41-MUT突变型质粒。随后,利用Lipofectamine 3000转染试剂将各质粒与miR-432-5p mimics或miR-NC共转染至细胞中,24 h后收集细胞,用双荧光素酶活性检测试剂盒检测细胞荧光素酶活性。
1.3.9裸鼠移植瘤模型 将裸鼠适应性喂养1周后,将正常培养的HGC-27细胞和转染miR-NC、miR-432-5p mimics的HGC-27细胞以每毫升1×106个的密度皮下注射到裸鼠腹部右侧(200 μL),记为NC组、miR-NC组、miR-432-5p组,每组6只。当皮下肿瘤体积大于200 mm3时,每隔5天用游标卡尺测量一次肿瘤的长径(a)和短径(b),并利用公式计算肿瘤体积(v):v(mm3)=(ab2)/2,持续25 d后,处死小鼠并分离肿瘤并称重。
1.3.10蛋白质印迹法(Western blot)检测肿瘤组织中DDX41蛋白的表达 将称重后的组织立即用预冷的PBS冲洗,然后置于匀浆器中加入蛋白裂解液进行匀浆,提取总蛋白。然后蛋白进行煮沸变性,并通过10% 聚丙烯酰胺凝胶电泳分离蛋白,然后转移到聚偏二氟乙烯膜中。将聚偏二氟乙烯膜用5%脱脂奶粉在室温下封闭1 h,随后在4 ℃下与DDX41(1∶1 000)、GAPDH(1∶2 500)一抗稀释液一起孵育过夜,然后与山羊抗兔二抗(1∶500)一起孵育1 h,最后用ECL显影。以GAPDH为内参蛋白,通过凝胶成像和Image J软件分析蛋白条带。
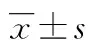
2 结 果
2.1不同胃癌细胞中miR-432-5p和DDX41水平比较 与人正常胃黏膜上皮细胞GES-1比较,人胃癌细胞MKN-45、HGC-27、NCI-N87中miR-432-5p水平降低,DDX41 mRNA水平升高(P<0.05),且HGC-27细胞中miR-432-5p水平最低,DDX41 mRNA水平最高,见表2。因此,选择HGC-27细胞进行后续实验。
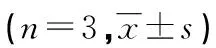
表2 不同胃癌细胞中miR-432-5p和DDX41 mRNA水平比较
2.2各组HGC-27细胞中miR-432-5p和DDX41水平比较 与NC组和miR-NC组比较,miR-432-5p组细胞中miR-432-5p水平升高,DDX41 mRNA水平降低,差异有统计学意义(P<0.05);与miR-432-5p组和miR-432-5p+pcDNA-NC组比较,miR-432-5p+pcDNA-DDX41组细胞中miR-432-5p水平降低,DDX41 mRNA水平升高,差异有统计学意义(P<0.05),见表3。
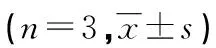
表3 各组HGC-27细胞中miR-432-5p和DDX41 mRNA水平比较
2.3miR-432-5p对HGC-27细胞增殖活性的影响 与NC组[(99.63±2.32)%]和miR-NC组[(98.79±3.83)%]比较,miR-432-5p组细胞存活率[(42.58±4.71)%]降低,差异有统计学意义(P<0.05);与miR-432-5p组和miR-432-5p+pcDNA-NC组[(43.17±4.63)%]比较,miR-432-5p+pcDNA-DDX41组细胞存活率[(76.92±7.84)%]升高,差异有统计学意义(P<0.05)。
2.4miR-432-5p对HGC-27细胞迁移能力的影响 与NC组[(216.74±26.34)个]和miR-NC组[(208.61±16.42)个]比较,miR-432-5p组细胞迁移数[(54.86±5.71)个]减少,差异有统计学意义(P<0.05);与miR-432-5p组和miR-432-5p+pcDNA-NC组[(53.20±5.64)个]比较,miR-432-5p+pcDNA-DDX41组细胞迁移数[(162.54±17.83)个]增加,差异有统计学意义(P<0.05),见图1。
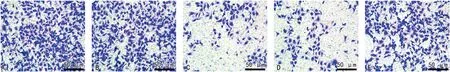
注:A~E分别为NC组、miR-NC组、miR-432-5p组、miR-432-5p+pcDNA-NC组、miR-432-5p+pcDNA-DDX41组HGC-27细胞迁移图。
2.5miR-432-5p对HGC-27细胞放疗敏感性的影响 对各转染组细胞进行放疗后,与NC组、miR-NC组细胞克隆形成数[(71.54±7.73)个、(69.42±6.28)个]和凋亡率[(22.68±3.10)%、(23.93±3.92)%]比较,miR-432-5p组细胞克隆形成数[(23.61±2.87)个]减少,细胞凋亡率[(68.43±6.12)%]升高,差异均有统计学意义(P<0.05);与miR-432-5p组、miR-432-5p+pcDNA-NC组细胞克隆形成数[(23.61±2.87)个、(22.18±2.92)个]和凋亡率[(68.43±6.12)%、(66.86±6.53)%]比较,miR-432-5p+pcDNA-DDX41组细胞克隆形成数[(54.24±5.56)个]增加,细胞凋亡率[(37.59±4.24)%]降低,差异均有统计学意义(P<0.05),见图2。
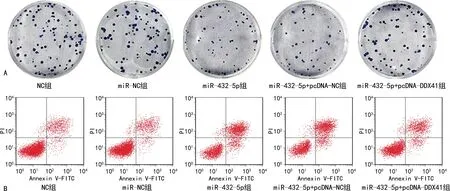
注:A为平板克隆检测细胞克隆形成数;B为流式细胞术检测细胞凋亡率。
2.6双荧光素酶报告基因实验验证miR-432-5p与DDX41的靶向关系 通过ENCORI信息网站预测发现,miR-432-5p与DDX41在3′-非翻译区(3′-UTR)区域存在靶向结合位点,见图3。然后又通过双荧光素酶报告基因实验发现,与miR-NC与DDX41-WT(野生型)共转染的细胞相对荧光素酶活性[(0.99±0.06)]比较,miR-432-5p mimics和DDX41-WT共转染的细胞相对荧光素酶活性[(0.38±0.02)]降低,差异有统计学意义(P<0.05);而与miR-NC与DDX41-MUT共转染的细胞相对荧光素酶活性[(0.98±0.05)]比较,miR-432-5p mimics和DDX41-MUT共转染的细胞相对荧光素酶活性[(1.00±0.05)]无明显变化(P>0.05)。

图3 miR-432-5p与DDX41的靶向结合位点预测
2.7miR-432-5p对裸鼠肿瘤组织的生长及DDX41蛋白的影响 移植瘤裸鼠模型建立第25 d,与NC组和miR-NC组肿瘤体积[(869.52±32.14)mm3、843.69±33.63)mm3]和肿瘤质量[(1.93±0.13)g、1.89±0.15)g]比较,miR-432-5p组裸鼠肿瘤的生长速度缓慢,肿瘤体积[(534.21±28.34)mm3]和肿瘤质量[(0.72±0.05)g]均减小,差异均有统计学意义(P<0.05)。Western blot检测肿瘤中DDX41蛋白结果显示,与NC组、miR-NC组[(1.02±0.06)、(1.01±0.05)]比较,miR-432-5p组肿瘤组织中DDX41蛋白表达[(0.38±0.02)]降低,差异均有统计学意义(P<0.05),见图4。
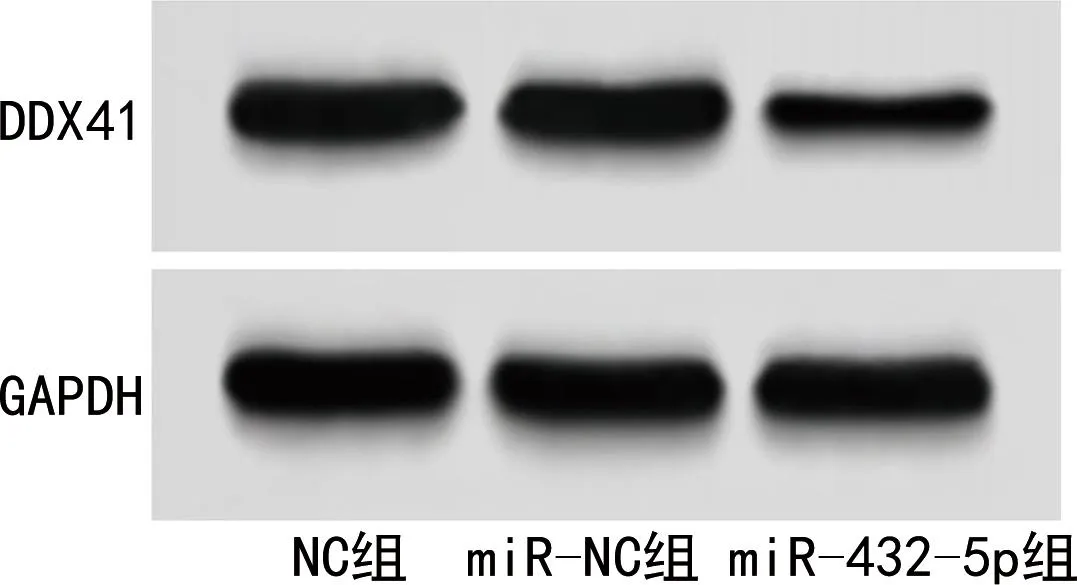
图4 各组裸鼠肿瘤组织中DDX41蛋白表达
3 讨 论
胃癌是一种常见的恶性肿瘤,胃癌晚期患者的主要治疗方法是放疗,但大多数胃癌晚期患者会发生癌转移、复发及放疗耐受性,导致存活率依然很低[10-11]。尽管许多基因已被证明与癌症的放疗敏感性有关,但胃癌放疗抵抗的机制仍不清楚[12]。有研究表明,miRNA已经成为各种癌症发生和发展的关键调节因子,其参与肿瘤的增殖、分化、DNA修复和凋亡[13]。例如miR-93-5p的过表达可以通过促进细胞凋亡来增强乳腺癌细胞的放疗敏感性,miR-432-5p能够促进胃癌细胞的增殖和迁移,增强宫颈癌的紫杉醇化疗敏感性[8,14-15]。但miR-432-5p对胃癌细胞放疗敏感性的作用尚不清楚。本研究通过对不同胃癌细胞中miR-432-5p水平的检测发现,miR-432-5p在胃癌细胞中的水平低于正常细胞,且在HGC-27细胞中的水平最低。因此,将该细胞用于后续实验的研究。将过表达miR-432-5p质粒转染至HGC-27细胞发现,miR-432-5p组细胞的存活率降低、迁移细胞数减少,在接受4 Gy的放射剂量治疗后细胞的克隆数减少,凋亡率升高,揭示了miR-432-5p过表达能够抑制胃癌细胞的增殖和迁移,增强细胞对放疗的敏感性。
miRNA能够与其靶mRNA 3′-UTR区域的序列结合,导致mRNA降解或抑制蛋白质翻译,进而在细胞增殖、凋亡、迁移和分化等方面发挥重要作用[16]。为了进一步探索miR-432-5p对胃癌的作用,本研究通过生物信息学预测发现,DDX41可能是miR-432-5p的靶mRNA。DDX41是具有遗传易感性的骨髓肿瘤中最常见的突变基因之一,可受到种系和体细胞突变的影响[17]。在髓样树突细胞中充当细胞内DNA传感器,通过STING途径激活先天免疫[18]。据报道,miR-H2-3p通过靶向DDX41来抑制Ⅰ型干扰素的产生并增强单纯疱疹病毒Ⅰ型的免疫逃避,DDX41的功能丧失会导致核糖体前体生物发生缺陷,破坏核糖体合成,从而导致细胞周期停滞和凋亡[19-20]。虽然DDX41参与RNA代谢相关的多种重要过程,并且可能与人类疾病密切相关,但其在实体恶性肿瘤中的作用研究甚少。因此,本研究检测了DDX41在胃癌细胞中的表达,结果显示胃癌细胞中DDX41 mRNA水平均高于正常细胞,表明DDX41可能参与胃癌的发展过程。而miR-432-5p过表达的细胞中DDX41 mRNA水平降低,表明miR-432-5p抑制DDX41的表达。为了进一步验证miR-432-5p与DDX41之间的调控关系,利用DDX41进行回补实验发现,DDX41过表达逆转了miR-432-5p对胃癌细胞增殖、迁移及放疗敏感性的作用,提示了miR-432-5p可能通过抑制DDX41表达来抑制胃癌细胞的增殖和迁移,增强细胞放疗敏感性。随后利用生物信息学网站和双荧光素酶报告基因实验验证了miR-432-5p与DDX41存在靶向调控关系。本研究通过体内移植瘤实验发现,在miR-432-5p过表达的裸鼠中,肿瘤组织的重量和体积均减小,DDX41蛋白表达降低,揭示了miR-432-5p过表达可以靶向下调DDX41,进而抑制胃癌的恶性发展。
综上所述,miR-432-5p靶向下调DDX41来抑制胃癌细胞的增殖和迁移,增强细胞放疗敏感性。本研究根据体内外实验为胃癌的治疗提供了新的靶点和理论依据。但临床对DDX41在实体瘤发展中的作用及其机制知之甚少,其在肿瘤中的具体机制还有待进一步深入探索。

