基于传统功效的野生与栽培细辛药效学对比研究
刘萌萌,路 静,林 喆,李唯嘉,张文静, 黄晓巍, 律广富
(1.长春中医药大学药学院,长春 130117;2.长春中医药大学东北亚中医药研究院,长春 130117;3.吉林省人参科学研究院,长春 130117)
细辛为马兜铃科植物北细辛Asarum heterotropoidesFr. Schmidt var. Mandshuricum(Maxim.) Kitag.、汉城细辛Asarum sieboldiiMiq. var. seoulenseNakai 或华细辛Asarum sieboldiiMiq.的干燥根和根茎[1],前两种习称“辽细辛”,始载于《神农本草经》,距今已2000 多年。其性温,味辛,归心、肺、肾经,具有解表散寒,祛风止痛,通窍,温肺化饮的功效,用于风寒感冒,头痛,牙痛,鼻塞流涕,鼻渊,风湿痹痛,痰饮喘咳等病症[2]。
细辛是一种常见的中药材,其药用历史可追溯到古代。 最初,人们采集细辛,将其用于制作汤剂,以缓解各种常见病症。 近年来,随着现代科技和研究方法的快速发展,通过对细辛的深入研究,使人们对其药理与功效有了更深入的了解。 细辛主要生长在山区,野生品种的细辛具有较高的药效,含有丰富的有效成分, 科研人员通过分离和提纯细辛中的活性成分,进一步了解其药理作用和机制。这些研究成果使细辛的应用范围不断扩大。 除了传统的入汤剂外,以细辛为主要原料的中成药开始在临床上广泛应用,如辛芩颗粒、九味羌活片、小青龙颗粒等。细辛的市场需求量逐年上升, 由于人们对野生细辛的过度采挖及采挖无序,加之其生长缓慢、结实率低,致使野生细辛资源逐渐减少。 自上世纪70年代末期,细辛栽培成功后,商品来源的细辛便由野生品转变为栽培品,栽培细辛成为市场购销的主流[3]。但在细辛的种植栽培过程中,各地盲目扩张加上栽培环境复杂多样[4],栽培技术参差不齐且无统一规范的栽培标准、大多数药农缺乏基础知识和永续利用观念,栽培品质量良莠不齐,药效差异很大,导致在临床应用中难以准确把握其疗效和用量[5]。因此,对于栽培细辛质量控制和药用效果研究亟需加强,以提高其质量、稳定药效,进而更好地应用于临床实践。 本研究从细辛的传统功效入手,对比分析野生和栽培细辛在抗炎、镇痛及解热等方面的药效差异,以期为栽培细辛的质量标准控制和临床精准用药提供数据支撑。
1 材料与仪器
1.1 实验药物
野生细辛产自吉林东部长白山地区,栽培细辛产自吉林通化地区,经过鉴定,符合2020 版《中国药典》细辛相关规定,为正品药材。 按照聂安政[6-7]所使用的方法对所购的细辛进行处理加工,并在灌胃给药前提取不同生药量(1.6g·ml-1、0.8g·ml-1)的野生和栽培细辛浸膏。
1.2 实验动物
SPF 级昆明小鼠,体质量(18.00±2.00)g,雌雄兼用,由辽宁长生生物技术股份有限公司提供,动物生产合格证号:SCXK(辽)2020-0001。
1.3 实验试剂
阿司匹林 (北京索莱宝科技有限公司, 批号:510F011); 冰乙酸 (天津市津东天正精细化学试剂厂);二甲苯(北京化工厂,批号:20101015);角叉菜胶(Sigma-Aldrich,批号:C1013-100G);LPS(北京索莱宝科技有限公司,批号:L8880);氯化钠注射用水(四川科伦药业股份有限公司, 批号: 国药准字H51021158);干酵母(安琪酵母股份有限公司,批号:CA10193)。
1.4 实验仪器
电动耳肿打耳器(济南益延科技发展有限公司,型号:YLS-25A);分析天平(上海菁海仪器有限公司,型号:FA1204); 智能热板仪 (成都泰盟科技有限公司,型号:RB-200);测温枪(深圳市长坤科技有限公司,型号:CK-T1503)。
2 方法
2.1 小鼠炎症模型的建立
2.1.1 二甲苯致小鼠耳肿胀试验
42 只昆明种小鼠,随机分为正常对照组、模型对照组、阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)、野生细辛组(6.0g·kg-1)、栽培细辛组(12.0g·kg-1)、栽培细辛组(6.0g·kg-1)。 各组小鼠分别灌胃给予规定含量的药物,对照组给予等体积0.9%氯化钠水溶液,连续给药7d,第7 次给药1h 后,在右耳两面均匀涂抹二甲苯50μl,左耳不进行处理,1h 后脱颈处死小鼠,用打孔器在两耳耳廓相同位置打孔, 取大约8mm 左右耳片,将耳片称重,计算耳肿胀度及抑制率[8]。
2.1.2 角叉菜胶致小鼠足肿胀试验
42 只昆明小鼠,随机分为正常对照组、模型对照组、阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)、野生细辛组(6.0g·kg-1)、栽培细辛组(12.0g·kg-1)、栽培细辛组(6.0g·kg-1)。 各组小鼠分别灌胃给予规定含量的药物,对照组给予等体积0.9%氯化钠水溶液,连续给药7d, 末次给药前用记号笔在小鼠后肢踝关节周围做一标记,使用手术线测量长度,后于小鼠右足趾处皮下注射0.1ml 的1.0%角叉菜胶溶液致炎,致炎后灌胃给予相应药物,观察小鼠足趾肿胀程度,1h 后再次测量长度,计算足肿胀度及抑制率[9]。
2.2 小鼠镇痛模型的建立
2.2.1 醋酸致小鼠疼痛扭体试验
42 只昆明小鼠,随机分为正常对照组、模型对照组、阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)、野生细辛组(6.0g·kg-1)、栽培细辛组(12.0g·kg-1)、栽培细辛组(6.0g·kg-1)。 各组小鼠分别灌胃给予规定含量的药物,对照组给予等体积0.9%氯化钠水溶液,连续给药7d。 第7 次给药1h 后,腹腔注射0.2ml 的1%醋酸,记录小鼠15min 内出现扭体反应(腹部内凹、伸展后肢、臀部抬高)的次数[10]。
2.2.2 热板试验
雌性昆明种小鼠,每次一只放在热板仪器上测量其痛阈值(小鼠放在热板上至出现舔后足所需时间),舔足出现时间小于5s 或大于30s 或跳跃的小鼠视为不合格。 取36 只合格小鼠,重复测两次痛阈值,取平均值,作为小鼠给药前痛阈值。
随机分为6 组, 即正常对照组、 阿司匹林组(0.1g·kg-1)、 野生细辛组 (12.0g·kg-1)、 野生细辛组(6.0g·kg-1)、 栽培细辛组 (12.0g·kg-1)、 栽培细辛组(6.0g·kg-1)。 各组小鼠分别灌胃给予规定含量的药物,对照组给予等体积0.9%氯化钠水溶液,连续给药7d。第7 次给药后30min、60min 测量各组小鼠痛阈值并记录[11]。
2.3 小鼠解热模型的建立
2.3.1 脂多糖致热小鼠试验
雄性昆明种小鼠, 每日用测温枪测量颈部体温,在每天的同一时间进行体温测量,共持续3d,挑选体温在范围内且连续三天体温变化小于0.3℃的小鼠作为合格小鼠,以备后续实验研究。
将合格小鼠随机分为6 组,每组6 只,正常对照组、阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)、野生细辛组(6.0g·kg-1)、栽培细辛组(12.0g·kg-1)、栽培细辛组(6.0g·kg-1)。 实验前禁食不禁水,造模前每隔0.5h 测定体温,共测量3 次,取平均值作为基础体温,各组皮下注射LPS 溶液80μg·kg-1, 正常对照组注射等体积0.9%氯化钠水溶液。 造模后,各组小鼠分别灌胃给予规定含量的药物, 对照组给予等体积0.9%氯化钠水溶液,给药不同时间测量各组小鼠体温,连续观察3h,记录小鼠体温变化[12]。
2.3.2 干酵母致热小鼠试验
雄性昆明种小鼠, 每日用测温枪测量颈部体温,在每天的同一时间进行体温测量,共持续3d,挑选体温在范围内且连续三天体温变化小于0.3℃的小鼠作为合格小鼠,以备后续实验研究。
将合格小鼠随机分为6 组,每组6 只,正常对照组、阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)、野生细辛组(6.0g·kg-1)、栽培细辛组(12.0g·kg-1)、栽培细辛组(6.0g·kg-1)。 实验前禁食不禁水,造模前每隔0.5h 测定体温,共测量3 次,取平均值作为基础体温,各组皮下注射20%酵母混悬液10ml·kg-1, 正常对照组注射等体积0.9%氯化钠水溶液。 造模后,各组小鼠分别灌胃给予规定含量的药物, 对照组给予等体积0.9%氯化钠水溶液, 给药不同时间测量各组小鼠体温,连续观察3h,记录小鼠体温变化[12]。
2.4 统计学方法
采用SPSS 22.0 统计软件对数据进行统计学分析,计算结果以±s 表示,组间数据比较采用单因素方差分析,P<0.05,P<0.01 表示有统计学差异。
3 结果
3.1 小鼠炎症模型的结果
3.1.1 小鼠耳肿胀模型的影响
与正常对照组比较,模型对照组耳肿胀度明显上升,具有统计学差异(P<0.01)。 与模型对照组相比,阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)与栽培细辛组(12.0g·kg-1)耳肿胀度均有所降低,具有统计学差异(P<0.01);与相同剂量野生细辛组相比较,栽培细辛组(12.0g·kg-1)耳肿胀度高于野生细辛组,具有统计学差异(P<0.01)。 表示野生与栽培细辛对二甲苯致小鼠耳肿胀均有显著的抑制作用,但在相同剂量下,野生细辛的抑制效果优于栽培细辛。 详见表1。
表1 各组耳肿胀度及抑制率的测定结果(±s,n=6)
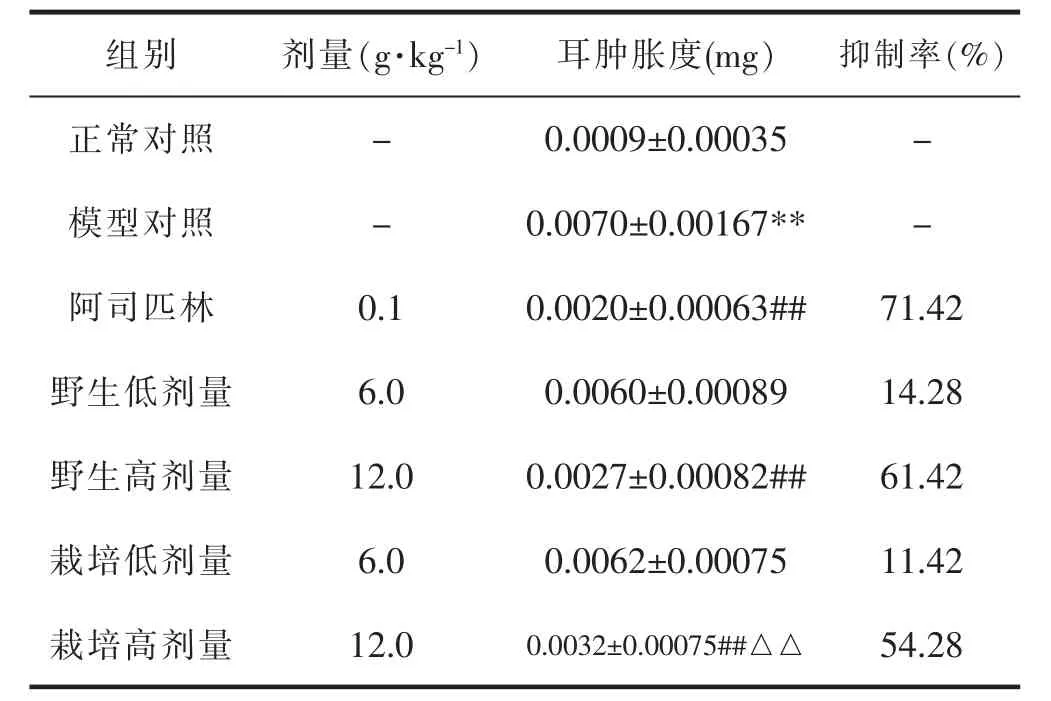
表1 各组耳肿胀度及抑制率的测定结果(±s,n=6)
注:与正常对照组相比,*P<0.05,**P<0.01;与模型对照组相比,#P<0.05,##P<0.01; 与野生细辛相同剂量组相比,△P<0.05,△△P<0.01(下同)
组别剂量(g·kg-1)耳肿胀度(mg)抑制率(%)正常对照-0.0009±0.00035-模型对照-0.0070±0.00167**-阿司匹林0.10.0020±0.00063##71.42野生低剂量6.00.0060±0.0008914.28野生高剂量12.00.0027±0.00082##61.42栽培低剂量6.00.0062±0.0007511.42栽培高剂量12.00.0032±0.00075##△△54.28
3.1.2 小鼠足肿胀模型的影响
与正常对照组相比,模型对照组足肿胀度明显上升,具有统计学差异(P<0.01)。 与模型对照组相比,阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)与栽培细辛组(12.0g·kg-1)均可降低小鼠的足肿胀度,具有统计学差异(P<0.01); 与相同剂量的野生细辛组相比,栽培细辛高剂量组小鼠的足肿胀度明显高于野生细辛组,具有统计学差异(P<0.01)。 表示野生与栽培细辛均对小鼠的足肿胀存在抑制作用,但在相同剂量下,野生细辛的抑制效果优于栽培细辛。 详见表2。
表2 各组足肿胀度及抑制率的测定结果(±s,n=6)
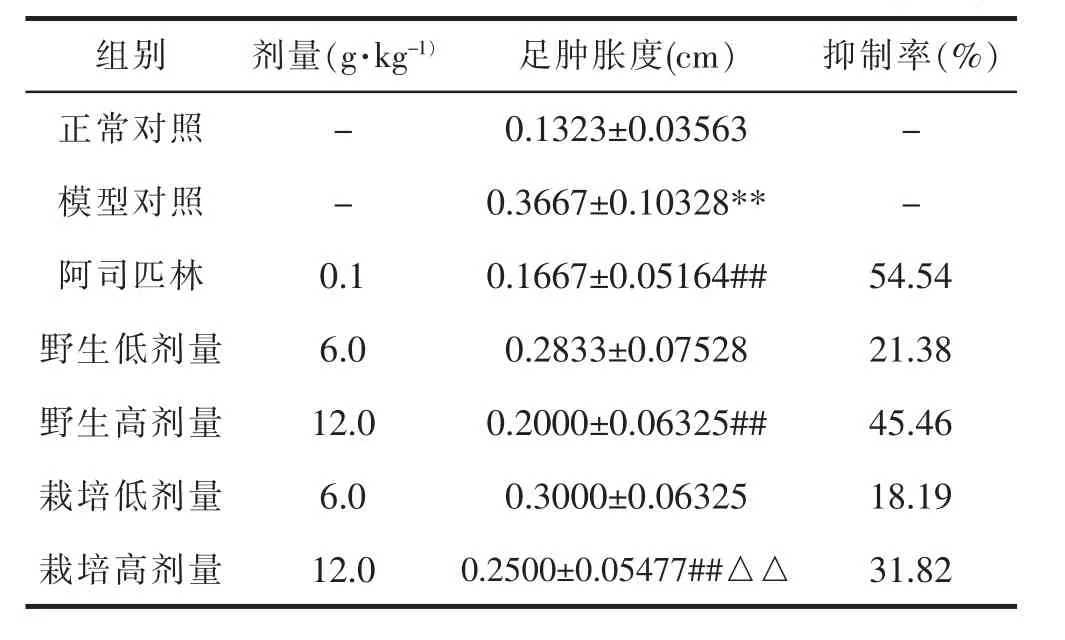
表2 各组足肿胀度及抑制率的测定结果(±s,n=6)
组别剂量(g·kg-1)足肿胀度(cm)抑制率(%)正常对照-0.1323±0.03563-模型对照-0.3667±0.10328**-阿司匹林0.10.1667±0.05164##54.54野生低剂量6.00.2833±0.0752821.38野生高剂量12.00.2000±0.06325##45.46栽培低剂量6.00.3000±0.0632518.19栽培高剂量12.00.2500±0.05477##△△31.82
3.2 小鼠镇痛模型的结果
3.2.1 醋酸致小鼠疼痛扭体模型的影响
与正常对照组比较,模型对照组小鼠的扭体次数明显增多,具有统计学差异(P<0.01)。 与模型对照组相比,阿司匹林组(0.1g·kg-1)、野生细辛组(6.0g·kg-1)、野生细辛组(12.0g·kg-1)与栽培细辛组(12.0g·kg-1)均可明显降低扭体次数, 具有统计学差异 (P<0.05 或P<0.01); 与相同剂量野生细辛组相比较, 栽培细辛组(12.0g·kg-1)扭体次数高于野生细辛组,具有统计学差异(P<0.01)。 表示野生与栽培细辛均可抑制醋酸致小鼠的痛感,有明显的镇痛效果,但在相同的剂量下,野生细辛的镇痛效果比栽培细辛更好。 详见表3。
表3 各组醋酸扭体试验的测定结果(±s,n=6)
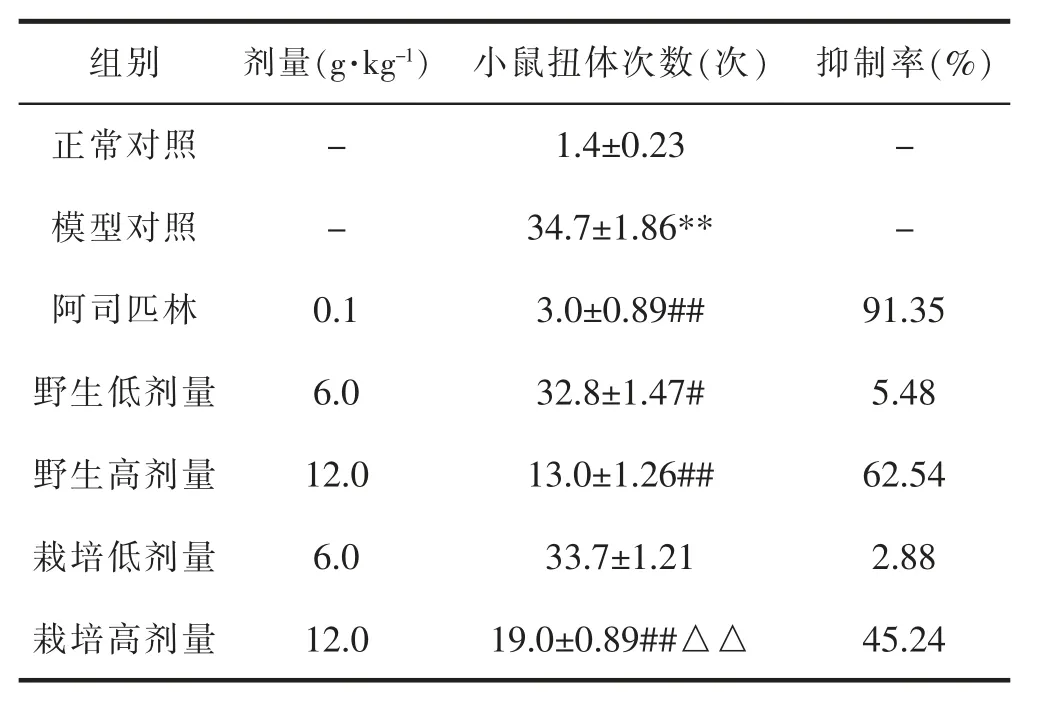
表3 各组醋酸扭体试验的测定结果(±s,n=6)
组别剂量(g·kg-1) 小鼠扭体次数(次) 抑制率(%)正常对照-1.4±0.23-模型对照-34.7±1.86**-阿司匹林0.13.0±0.89##91.35野生低剂量6.032.8±1.47#5.48野生高剂量12.013.0±1.26##62.54栽培低剂量6.033.7±1.212.88栽培高剂量12.019.0±0.89##△△45.24
3.2.2 热板致小鼠疼痛模型的影响
与正常对照组相比, 阿司匹林组、 野生细辛组(6.0g·kg-1)、野生细辛组(12.0g·kg-1)与栽培细辛组(12.0g·kg-1)均有明显的镇痛效果,可显著增加小鼠痛阈值,具有统计学差异(P<0.05 或P<0.01);与相同剂量野生细辛组比较,栽培细辛组(12.0g·kg-1)的镇痛效果显著低于野生细辛组(P<0.05 或P<0.01)。表示野生与栽培细辛均可抑制热板致小鼠的疼痛反应。 相同剂量下, 野生细辛的镇痛效果优于栽培细辛。 详见表4。
表4 小鼠热板试验的测定结果(±s,n=6)
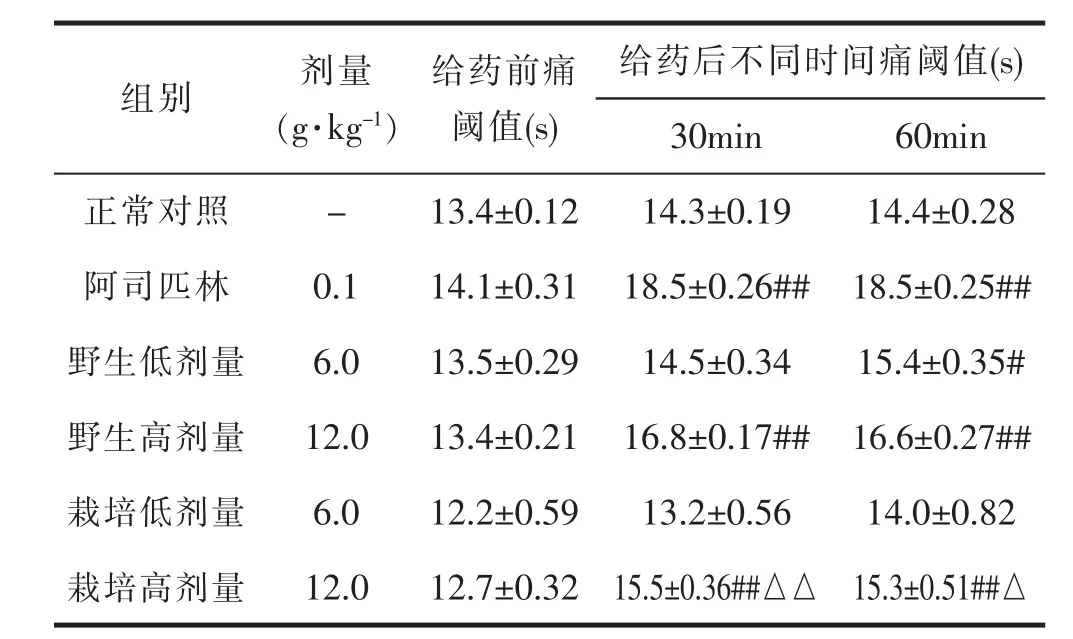
表4 小鼠热板试验的测定结果(±s,n=6)
给药后不同时间痛阈值(s)30min60min正常对照-13.4±0.1214.3±0.1914.4±0.28阿司匹林0.114.1±0.31 18.5±0.26## 18.5±0.25##野生低剂量6.013.5±0.2914.5±0.3415.4±0.35#野生高剂量12.013.4±0.21 16.8±0.17## 16.6±0.27##栽培低剂量6.012.2±0.5913.2±0.5614.0±0.82栽培高剂量12.012.7±0.32 15.5±0.36##△△ 15.3±0.51##△组别剂量(g·kg-1)给药前痛阈值(s)
3.3 小鼠解热模型的影响
3.3.1 脂多糖致热小鼠模型的影响
与正常对照组相比,发热模型组小鼠的体温在不同测定时间均显著升高,具有统计学差异(P<0.01)。与模型对照组相比,阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)与栽培细辛组(12.0g·kg-1)均可明显降低脂多糖引起的小鼠发热表现, 具有统计学差异(P<0.05 或P<0.01);与相同剂量野生细辛组比较,栽培细辛组 (12.0g·kg-1) 体温显著高于野生细辛 (P<0.05)。 表示野生与栽培细辛均具有解热作用,可抑制脂多糖引起的小鼠发热表现。 但在相同剂量下,野生细辛的解热效果优于栽培细辛。 详见表5。
表5 脂多糖致热小鼠的测定结果(±s,n=6)

表5 脂多糖致热小鼠的测定结果(±s,n=6)
给药后体温变化t(℃)120min正常对照-36.37±0.360.13±0.48发热模型-37.18±0.271.08±0.14**阿司匹林0.136.03±0.510.29±0.38##野生低剂量6.036.56±0.760.56±0.37野生高剂量 12.036.57±0.290.37±0.41##栽培低剂量6.036.73±0.220.89±0.32组别剂量(g·kg-1)基础体温(℃)30min60min 0.11±0.38 0.15±0.16 1.03±0.26** 1.24±0.27**0.27±0.12## 0.32±0.29##0.57±0.15 0.63±0.12 0.40±0.41## 0.44±0.15#0.87±0.15 0.91±0.29
3.3.2 干酵母致热小鼠模型的影响
与正常对照组相比,发热模型组小鼠的体温在不同测定时间均显著升高,具有统计学差异(P<0.01)。与模型对照组相比,阿司匹林组(0.1g·kg-1)、野生细辛组(12.0g·kg-1)与栽培细辛组(12.0g·kg-1)均可明显降低干酵母引起的小鼠发热体温, 具有统计学差异(P<0.05 或P<0.01);与相同剂量野生细辛组比较,栽培细辛组(12.0g·kg-1)体温显著高于野生细辛组(P<0.05)。 表示野生与栽培细辛均具有解热作用,可抑制干酵母引起的小鼠发热表现,在相同剂量下,野生细辛的解热效果优于栽培细辛。 详见表6。
表6 干酵母致热小鼠模型的影响(±s,n=6)
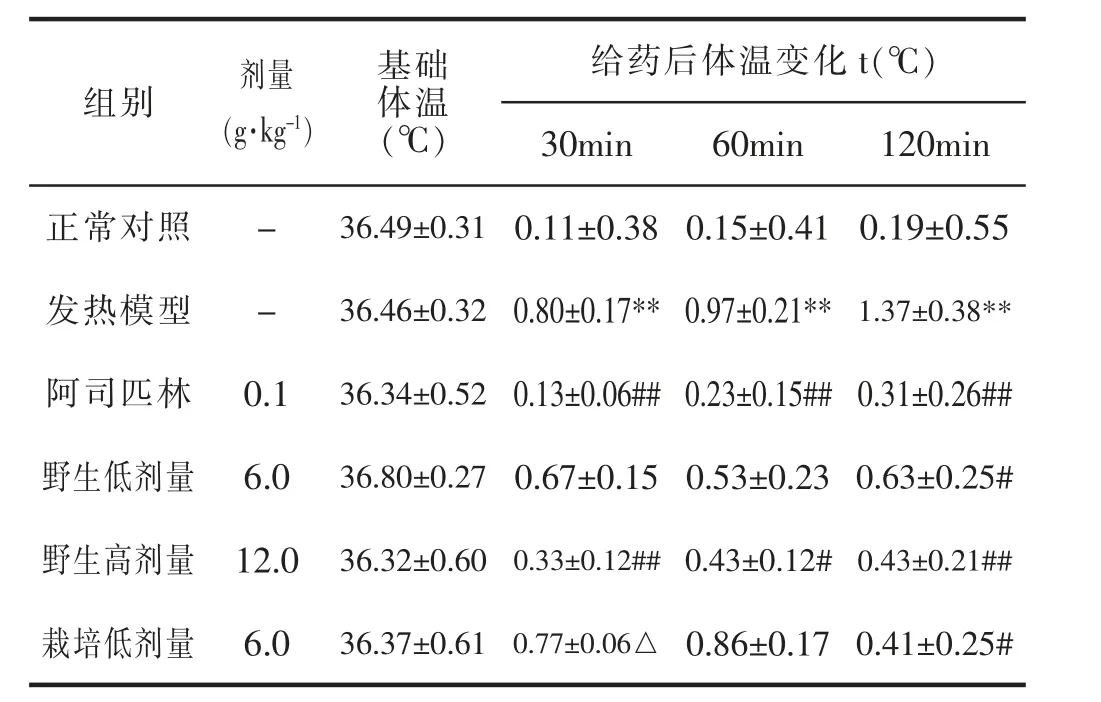
表6 干酵母致热小鼠模型的影响(±s,n=6)
给药后体温变化t(℃)120min正常对照-36.49±0.310.19±0.55发热模型-36.46±0.321.37±0.38**阿司匹林 0.136.34±0.520.31±0.26##组别剂量(g·kg-1)基础体温(℃)30min60min 0.11±0.38 0.15±0.41 0.80±0.17** 0.97±0.21**0.13±0.06## 0.23±0.15##0.67±0.15 0.53±0.23 0.33±0.12## 0.43±0.12#0.77±0.06△ 0.86±0.17野生低剂量 6.036.80±0.270.63±0.25#野生高剂量 12.0 36.32±0.600.43±0.21##栽培低剂量 6.036.37±0.610.41±0.25#
4 讨论
细辛首见于《山海经》,被称为“少辛”[13]。 随后,细辛一名最初被提及在《神农本草经》中[14],并被列为上品:“细辛,味辛温。 主咳逆,头痛,脑动,百节拘挛,风湿痹痛,死肌。 久服明目,利九窍,轻身长年。 一名小辛,生山谷”[15]。 通过现代药理学研究,细辛除了具有镇痛、抗炎、止咳、平喘等传统功效外,还显示了其他多种活性,如抗病毒、抗氧化、抗抑郁、降血压和抑制癌细胞等活性[16]。
然而, 目前大量文献对野生细辛进行药理研究,而针对野生与栽培细辛的药效学对比研究相对较少,本文基于细辛的传统功效,从抗炎、镇痛、解热等方面开展药效学对比研究。 研究结果表明,野生与栽培细辛都具有良好的抗炎作用,能够有效抑制二甲苯引起的小鼠耳肿胀及角叉菜胶所引起的小鼠足肿胀。野生与栽培细辛对醋酸所致小鼠疼痛,热板引起的小鼠疼痛也有良好的镇痛作用。野生与栽培细辛对脂多糖及干酵母所致小鼠的发热亦有良好地解热效果,由此可见,野生与栽培细辛均有明显的抗炎、镇痛、解热作用, 且相同剂量下的野生细辛药效显著强于栽培细辛, 这可能与栽培品存在农药残留以及其生长环境、生长年限、采收时间、有效成分含量存在差异相关。臧埔[17],王志清[18],刘东吉[19]等均对不同产地的栽培品细辛有效成分含量有所研究,结果表明不同产地的细辛有效成分含量各不相同,药效亦不相同。 吴艳蓉[20]等研究表明,不同采收期的细辛主要成分含量亦存在差异。 杨大峰[21]等研究表明,野生与栽培细辛有效成分含量存在差异。 陆杨[22]等对比野生与栽培细辛的总挥发油及细辛脂素含量,结果表明栽培细辛的挥发油含量低于野生细辛且未达到《药典》标准。
本研究进一步补充了细辛野生品与栽培品不同药效的对比研究,为野生和栽培细辛的临床使用提供了参考,同时为栽培细辛的质量标准控制提供数据支撑。

