生物絮团浓度和枯草芽孢杆菌添加量对生物絮团主要性能的影响
徐思行,贺 希,陈 菲,俞奇力,罗国芝 ,,3
(1 上海水产养殖工程技术研究中心,上海 201306;2 杭州萧山东海养殖有限责任公司,浙江 杭州 311200;3 上海市水产动物良种创制与绿色养殖协同创新中心,上海海洋大学,上海 201306)
生物絮团技术(Biofloc Technology,BFT)通过添加有机碳源维持水体碳氮比(C/N)在15以上,促使异养细菌同化氨氮优势生长,和水体中颗粒物结合形成以微生物为主的生物絮团[1]。生物絮团既能去除水体氨氮、硝酸盐氮等无机氮,对养殖动物也具有一定的营养价值。BFT可以较低成本实现封闭、高密度水产养殖[2],近年来受到国内外水产养殖者的普遍关注。
碳源种类、碳源添加方式、碳源浓度、C/N、盐度、絮团粒径大小等操作因素对生物絮团性能有明显影响[3-4],其中生物絮团浓度是生物絮团养殖过程中重点控制参数[5]。絮团量太低氨氮处理能力低,生物絮团量太高,会增加系统中的氧气消耗,且可能会对养殖动物产生胁迫[6]。有研究者认为生物絮团量宜控制在500~600 mg/L[7]。枯草芽孢杆菌(Bacillussubtilis,B.subtilis)是水产养殖常用益生菌[8]。已有研究表明,向絮团水体中添加B.subtilis可提高生物絮团粗蛋白和部分氨基酸组成含量,有利于为养殖对象提供更好的营养[8]。
研究了生物絮团浓度(以总悬浮颗粒物浓度表征)与B.subtilis添加量对生物絮团系统中氨氮去除、生物絮团营养组成的影响,为生物絮团技术在水产养殖中的实际应用提供参考。
1 材料与方法
1.1 材料
生物絮团已提前培养好且性能良好[8]。使用18个250 mL锥形瓶并接种100 mL絮团。每个锥形瓶中装2个规格相同的石英砂曝气石,曝气石连接一个100 W空气泵,维持反应器溶氧(DO)大于5 mg/L和生物絮团呈悬浮状态。试验期间添加适量碳酸氢钠(NaHCO3)调整水体碱度在250 mg/L CaCO3左右。
1.2 方法
1.2.1 枯草芽孢杆菌来源与添加量
使用的B.subtilis种子液购自中国微生物菌种网,试验时在100 mL 2216E培养液中接入2%种子液,在培养箱中发酵培养20 h后,用LB培养基平板计数法分别稀释10、102、103、104、105、106、107倍,用涂布棒快速均匀地将稀释后的菌液涂布,每个稀释倍数两个重复,继续培养20 h后用30~300 CFU/mL平板计数。根据菌落数目和种子液的稀释倍数计算出稀释后的菌浓度。
1.2.2 试验设计
B.subtilis添加量分别为104CFU/mL(A)、105CFU/mL(B)和106CFU/mL(C),每种添加量设置300 mg/L和600 mg/L生物絮团浓度,分别用A-300、A-600、B-300、B-600、C-300、C-600表示,每组3个平行。添加10 mg/L氨氮(38.46 mg/L氯化铵)至锥形瓶中,再添加葡萄糖使水体溶解有机碳(dissolved organic carbon,DOC)与总氮比为15。每间隔0.5 h进行主要水质指标连续监测。总氨氮降至0.5 mg/L以下时视为试验结束。取试验结束时絮团,测定絮团营养组成和主要氮素代谢功能基因拷贝数。
1.2.3 主要水质指标的测定
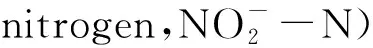
1.2.4 氨氮去除效率
TAN去除效率按下式计算:
R= (Ci-Ce)/Ci×100%
(1)
式中:R为TAN的去除效率(%);Ci为初始的TAN质量浓度(mg/L);Ce为终末的TAN质量浓度(mg/L)。
1.2.5 生物絮团性能指标
将取得的生物絮团在65℃条件下烘干至恒重,用碳氮元素分析仪(Elmenter Vario Max,德国)测定碳、氮元素质量。生物絮团粗蛋白含量用测得的氮素乘以6.25估算[9],粗灰分含量用称重法测定,总脂肪含量用氯仿-甲醇法测定,氨基酸相对含量用氨基酸分析仪测定(氨基酸分析仪L-8800,日立公司)。生物絮团沉降性能用5 min絮团沉降体积(Bioflocs volume index in 5 minutes,FVI-5)表征,具体测试方法为:使用英霍夫式(Imhoff)锥形管从生物絮团反应器中取100 mL混合均匀的水样(含絮团),静置5 min后,读取沉淀絮团的体积,单位为mL/L。
1.2.6 絮团相关功能基因拷贝数
从反应器中取50 mL混合均匀的水样,0.22 μm无菌微孔滤膜过滤,将截留了絮团的滤膜剪碎放进5 ml无菌离心管,零下80 ℃冰箱中保存,送上海微基生物有限公司采用Real-time PCR对ureC、AOB、nxrA、Hao进行基因拷贝数测定,所用引物序列见表1。

表1 ureC、AOB、nxrA、Hao基因引物Tab.1 The Gene Primers of ureC,AOB,nxrA and Hao
1.3 数据处理
试验数据采用Excel软件进行结果统计,用Origin 8.5进行相关图表绘制。试验数值用平均值±标准差(Mean±SD)形式表示,采用SPSS 19.0统计软件Tukey方法对试验数据进行组间多重比较分析,显著性水平设为0.05。
2 结果
2.1 各处理组的主要水质指标情况
各试验组溶氧、水温、pH和碱度等指标差异不显著(表2)(P>0.05)。
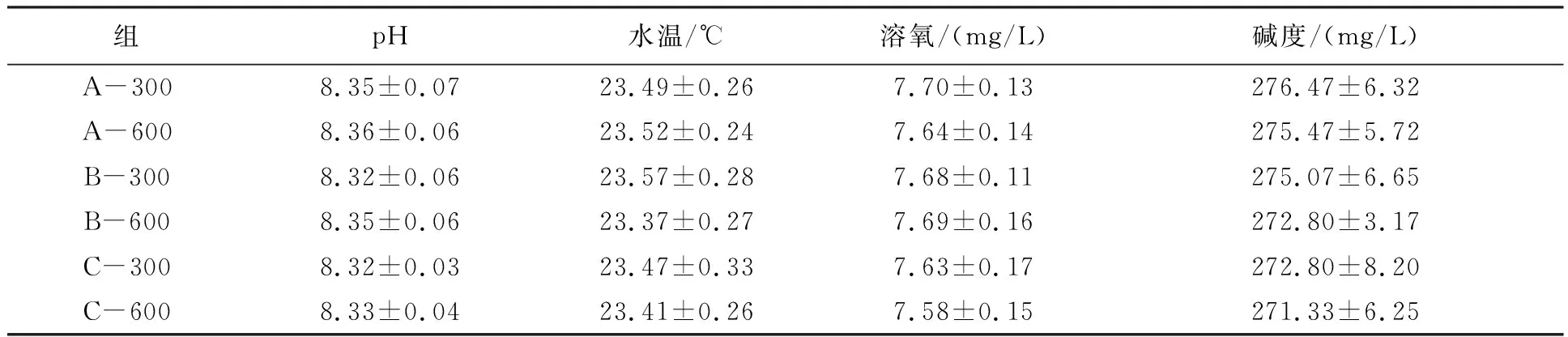
表2 试验期间各组主要水质指标平均值和范围Tab.2 Mean values and ranges of primary water quality parameters in experiment groups during the experimental period
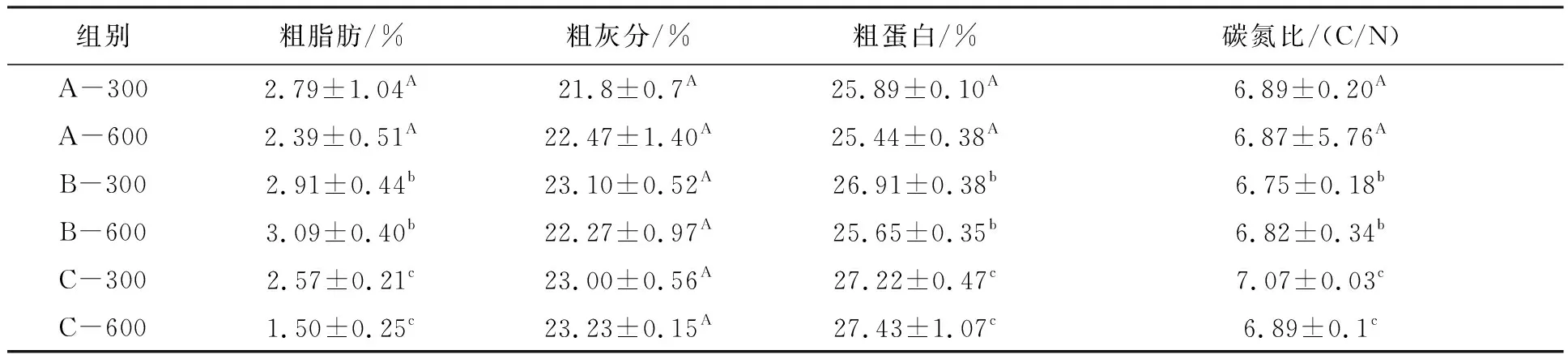
表3 不同处理组絮团粗蛋白、粗脂肪、粗灰分含量和C/NTab.3 Crude protein,crude ash,crude fat content and C/N of bioflocs
8 h内各组氨氮去除率均在99%以上(图1)。
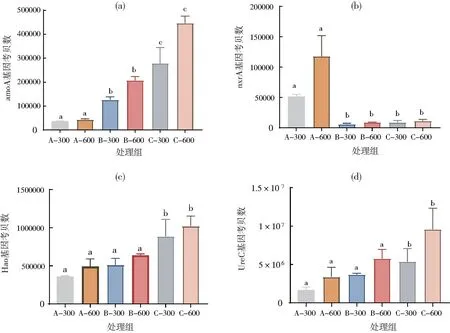
图2 各组生物絮团的硝化功能基因拷贝数Fig.2 Copies of ureC,amoA,nxrA and Hao in bioflocs of the experiment groups
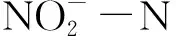
2.2 生物絮团硝化作用功能基因拷贝数
各组絮团amoA、ureC,Hao拷贝数随B.subtilis添加量升高而显著升高。B.subtilis添加量为104CFU/mL的A-300和A-600组nxrA基因拷贝数高于添加量为105CFU/mL和106CFU/mL组(P<0.05)。絮团悬浮物质量浓度为600 mg/L各基因拷贝数高于生物絮团质量浓度为300 mg/L组,但差异不显著。
标有不同字母表示组间有显著性差异(P<0.05),标有相同字母表示组间无显著性差异(P>0.05)
2.3 生物絮团营养组成
B.subtilis添加量为105CFU/mL的试验组絮团粗脂肪含量高于其他两组。B.subtilis添加量为106CFU/mL试验组粗蛋白含量高于其他两组(P<0.05)。B.subtilis添加量对絮团粗脂肪、粗蛋白、C/N影响显著(P<0.05),絮团浓度对生物絮团粗脂肪、粗灰分、粗蛋白、C/N影响不显著(P>0.05)。
絮团浓度对Ser、Glu、Gly、Met、His、Pro含量影响不显著 (P>0.05),对其余氨基酸含量影响显著(P<0.05)。B.subtilis添加量对Ser、Glu、Gly、Ala、Tyr、Lys含量影响不显著,对其余氨基酸影响显著(P<0.05)。B.subtilis添加量为106CFU/mL组(C-300,C-600)的絮团氨基酸含量高于B.subtilis添加量为104CFU/mL组(A-300,A-600)(表4)。
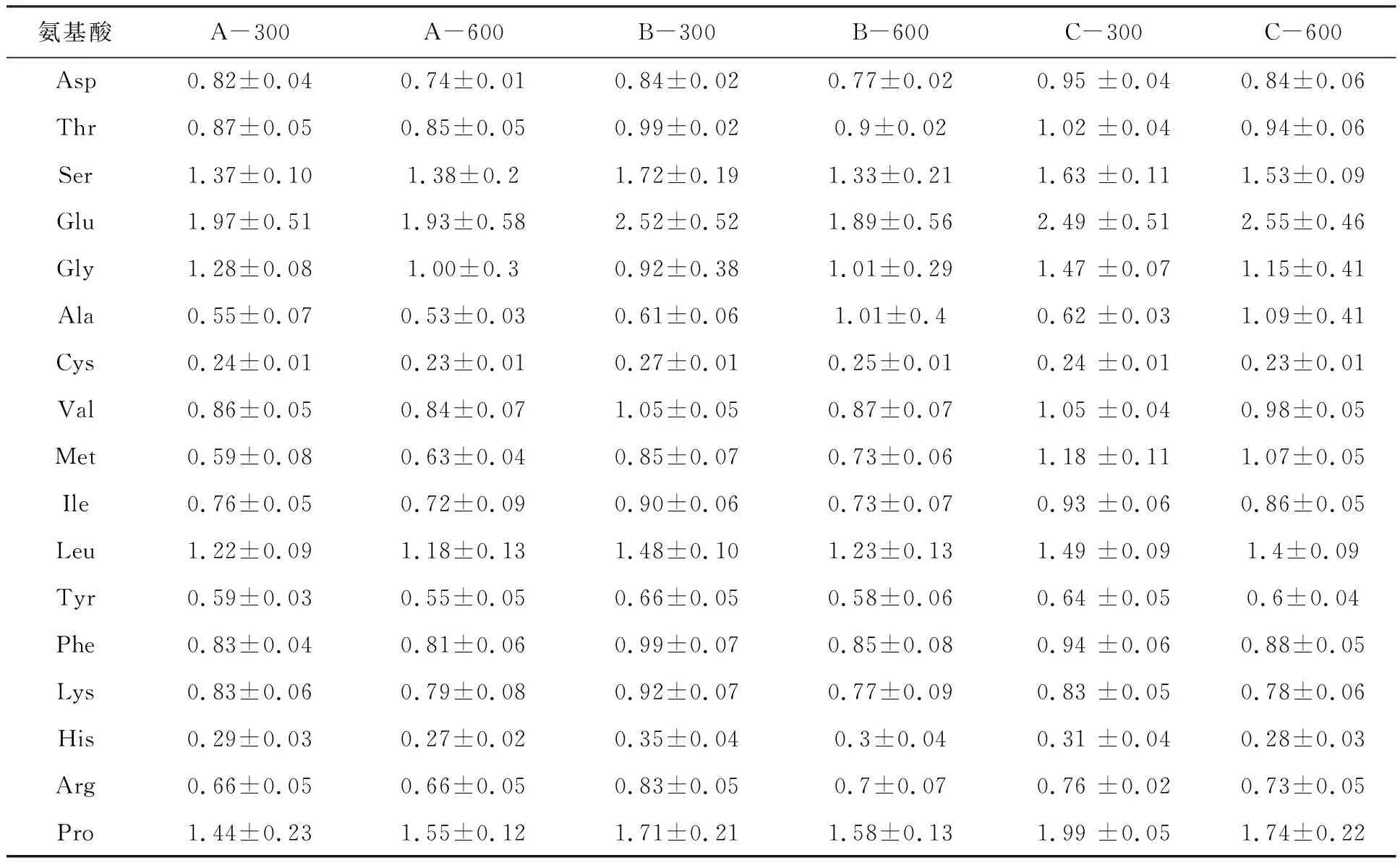
表4 各组生物絮团17种氨基酸相对含量(%干重)Tab.4 The contents of 17 amino acids in the bioflocs of the experimental groups (Dry weight %)
除Ser、Gly、Lys、His以外,B.subtilis添加量为105CFU/mL组(B-300,B-600)的絮团氨基酸含量均高于B.subtilis添加量为104CFU/mL组(A-300,A-600)。
3 讨论
3.1 絮团浓度和枯草芽孢杆菌添加量对絮团氨氮去除速率的影响
生物絮团系统中滞留了绝大部分未被养殖对象利用的氮、磷等营养物质,再加上絮团的絮状结构[4],可为多种微生物的生长提供适宜环境,进而为无机氮的多种代谢通路提供可能性[11]。生物絮团系统中的氨氮可被异养同化为有机氮,也可能会被自养硝化或异养硝化成硝酸盐氮[1];产生的硝酸盐氮可能被反硝化为氮气、同化为有机氮或异化还原成氨氮[12];水体中的亚硝酸盐氮可能来源于不完全硝化、不完全反硝化、硝酸盐异化还原(DNRA)等过程[4]。因此,生物絮团可能同时具有高效的氨氮同化、自养硝化、反硝化等功能。在按照C/N=15补充有机碳源的条件下,各组添加的10 mg/L氨氮均在3~ 9 h降至0.5 mg/L以下(图1a),说明本试验使用的生物絮团氨氮处理能力良好[13-15]。试验过程汇总亚硝酸盐氮浓度的增加可能是因为发生了不完全的硝化过程、不完全的反硝化过程或/和不完全的DNRA过程[4,16]。A-300组硝酸盐氮浓度增加,但总氮浓度降低(图1c、d),这说明A-300组可能有较明显的硝化过程和反硝化过程。A-600组硝酸盐氮浓度降低但总氮浓度增加(图1c、d),这说明可能发生了明显的同化过程。
芽孢杆菌具有良好的水质净化能力,能够有效修复受污染水体,在水产养殖过程中,常用芽孢杆菌去除水体中氨氮[17]。Oliveira等[18]在活性污泥中加入芽孢杆菌能够优化活性污泥的菌群结构,提高了水处理性能。刘属彬等[19]研究了B.subtilis在养殖废水和模拟废水去除氨氮的效果,表明B.subtilis是净化水质的良好微生物。本研究中B.subtilis添加量对生物絮团去除氨氮的效率有显著影响,添加量为106CFU/mL的组的TAN去除速率显著高于B.subtilis添加量为104CFU/mL和105CFU/mL (P<0.05)。这说明本研究构建的生物絮团反应环境能够满足B.subtilis生长需求。后续应开展关于更高B.subtilis添加量对生物絮团TAN去除效率影响的研究。生物絮团附着的微生物能够有效去除水体中的氨氮、硝酸氮等,絮团浓度越高,附着的微生物数量越多,氨氮处理能力越强。本研究中絮团质量浓度为600 mg/L处理组的氨氮处理效率明显高于絮团质量浓度为300 mg/L的处理组,这和Chen等[20]和Luo 等[21]的研究结果相同。
3.2 絮团浓度和枯草芽孢杆菌添加量对氮素代谢相关功能基因的影响
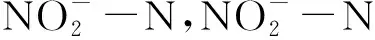
3.3 絮团浓度和草芽孢杆菌添加量对絮团营养组成的影响
生物絮团优势菌群的组成情况会影响絮团营养组成,这可能是因为不同细菌分泌的胞外聚合物性质不同,导致絮团营养成分组成的差异[26-28]。本研究中B.subtilis添加量为106CFU/mL时,生物絮团中各氨基酸浓度高于B.subtilis添加量分别为104CFU/mL和105CFU/mL的试验组。其可能原因是B.subtilis添加量为106CFU/mL时,B.subtilis添加剂在絮团中富集生长,形成优势菌,影响了絮团营养成分。生物絮团水体中异养细菌含量的提高,水体中氨氮、硝酸盐氮等营养物质能够更加高效地被生物絮团利用[29-30],与本研究结果一致。研究方案设计时考虑到实际操作成本,本研究没有设计更高浓度的B.subtilis添加量,这不排除添加量越高、粗蛋白提高效果越明显的可能性,需要进一步确认。
4 结论
添加枯草芽孢杆菌能够提高生物絮团中各氨基酸含量和粗蛋白含量以及氨氮去除效率。在按照C/N=15补充有机碳源条件下,生物絮团质量浓度为600 mg/L时添加106CFU/mL枯草芽孢杆菌,可取得较好的生物絮团氨氮去除速率和营养价值。

