消瘀止痛合剂联合骨髓间充质干细胞对股骨颈骨折兔骨愈合的影响及机制
韦志豪,袁振中,胡耶芳,陈炜坚,钟 健,郭诗雯,唐刚健
(1. 广西中医药大学,广西 南宁 530200;2. 桂林市中医医院,广西 桂林 541002)
股骨颈骨折是一种常见的创伤性损伤,老年股骨颈骨折患者2年内病死率约为37.1%[1]。 股骨颈骨折的治疗方案分为保守治疗和手术治疗,随着手术技术的进步,多学科配合,股骨颈骨折更加倾向于手术治疗,但有部分患者术后骨折愈合时间较长,且伴随着各种并发症发生。骨髓间充质干细胞(BMSCs)是存在于机体结缔组织和间质中具有多向分化潜能的一种干细胞,具有增殖分化能力极强的特点,目前研究证实BMSCs治疗能促进骨折修复,治疗骨不连等[2-4]。近几年来研究表明,一些中药具有诱导成骨分化、增加骨密度、促进骨折愈合的作用[5-6]。消瘀止痛合剂为桂林市中医医院院内制剂,是在桃红四物汤基础上加血竭、姜黄、木香、郁金、苏木等多味中药而成,具有活血化瘀、消肿止痛作用,临床应用效果较好。本实验通过建立兔股骨颈骨折模型,观察消瘀止痛合剂联合BMSCs对骨折愈合的影响,同时通过转录组测序技术探讨了其可能作用机制,旨在为股骨颈骨折的临床治疗提供新思路。
1 实验材料和方法
1.1实验动物 新西兰大白兔36只,3月龄,体重1.5~2.0 kg,由湖南太平生物科技有限公司提供,动物许可证号:SCXK(湘)2020-0005。单笼适应性饲养1周后用于实验,实验通过桂林医学院实验中心动物保护伦理委员会批准(GLMC-IACUC-2022008),于桂林医学院科学实验中心及动物实验中心完成。
1.2细胞及药物 大白兔BMSCs购于武汉普诺赛生命科技有限公司(CP-Rb007);消瘀止痛合剂由桂林市中医医院提供(由桃仁、红花、赤芍、当归、血竭、生地、川芎、延胡索、木香、郁金、苏木、姜黄、泽兰、木通、甘草组成,桂药制字Z20190032000)。
1.3主要试剂与仪器 DMEM培养基、胰蛋白酶-EDTA、青霉素/链霉素双抗、胎牛血清(美国Gibco公司),PBS缓冲液(北京索莱宝科技有限公司),3%戊巴比妥钠(桂林医学院实验室提供),兔碱性磷酸酶(ALP)ELISA检测试剂盒、兔骨钙素(OCN) ELISA检测试剂盒(上海酶联生物科技有限公司),苏木素伊红染色试剂盒(北京索莱宝科技有限公司),TRIzol试剂(美国Invitrogen公司),SYBR Green荧光定量PCR检测试剂盒(美国Roche Diagnostics公司),PrimeScript RT reagent kit反转录试剂盒(日本Takara公司),RNA Nano 6000检测试剂盒(美国安捷伦技术公司),NEB Next®UltraTMRNA文库制备试剂盒(美国NEB公司)。Thermo细胞培养箱(美国Electron公司),AV-100型超净台(西班牙Telstar公司),RT-6100酶标分析仪(美国Rayto公司),光学显微镜(美国莱卡公司),7900HT实时荧光定量PCR仪(美国ABI公司),K5500分光光度计(北京凯奥科技发展有限公司),摆锯,克氏针,黏附载玻片,显微镜载玻片。
1.4实验方法
1.4.1细胞培养 待兔BMSCs生长至80%~90%时进行传代,将细胞从培养箱中取出,置于超净台中,舍弃培养基,使用PBS进行洗涤,然后加入经37 ℃预热的胰酶消化。当显微镜下观察细胞回缩为圆形时,加入3 mL完全培养基终止消化,将细胞悬液转移至15 mL离心管中,1 000 r/min离心3 min,弃上清,加入完全培养基制备悬液,然后接种培养瓶,放入37 ℃、5% CO2培养箱中培养。培养至第三代细胞待用。
1.4.2股骨颈骨折模型制备及分组干预 根据文献[7],采用3%戊巴比妥钠(1 mL/kg)耳缘静脉注射麻醉白兔,固定于手术台上,左后肢髋关节手术区备皮。取髋后外侧手术入路,无菌条件下在髋关节后外侧做3~4 cm的切口,钝性分离肌肉,暴露关节囊,切开关节囊露出股骨颈,自大转子向股骨头打1枚无菌克氏针(直径2 mm),X射线透视见克氏针位置良好,退出部分克氏针,用摆锯造成股骨颈骨折,在股骨头上钻一个孔,将骨折复位,用缝线经孔固定,最后继续打入克氏针,再次行X射线透视见骨折复位及克氏针位置良好后分层缝合切口。术后分笼饲养,自由活动,肌肉注射青霉素8万IU/d,连用3 d。以生命体征稳定、正常进食、无感染、内固定无明显移位及脱落为造模成功。将造模成功后的36只白兔随机分为空白组、BMSCs组、消瘀止痛合剂组、消瘀止痛合剂+BMSCs组,每组9只。BMSCs组、消瘀止痛合剂+BMSCs组于造模后第1天在骨折端周围注射1 mL BMSCs悬液(BMSCs 5×106个/mL),其他组局部注射等剂量DMEM[8]。于术后第2天开始,消瘀止痛合剂组及消瘀止痛合剂+BMSCs组给予消瘀止痛合剂4.2 mL/kg灌胃,空白组、BMSCs组给予等量生理盐水灌胃,均1次/d,连续干预4周。
1.5检测指标及方法
1.5.1血清ALP及OCN水平 干预结束后耳缘静脉抽取静脉血4 mL,离心处理后吸取上层透明的血清,按照ELISA检测试剂盒说明书进行操作,借助酶标仪检测光密度值,获取标准曲线及标准方程,计算出样本血清ALP、OCN水平。
1.5.2造模侧股骨组织变化及病理学形态 取血后采用空气栓塞法处死白兔,取造模侧股骨颈骨组织,观察骨缺损区骨质变化、表面形态及骨痂形成等情况。然后将其放入10%福尔马林溶液中固定24~48 h,取出后进行常规脱钙、冲洗、梯度脱水、透明、浸蜡、包埋,制作成5~6 μm厚切片;再将切片进行常规脱蜡、梯度脱水,HE染色,晾干后用中性树胶封片,光镜下观察骨组织病理形态。
1.5.3骨组织中ALP、OCN mRNA表达情况 利用TRIzol试剂提取骨组织中总mRNA。实时荧光定量PCR,Takara反转录试剂盒反转录,生成得到cDNA,使用SYBR Green荧光定量PCR检测试剂盒反应体系行Real-time PCR。利用相对定量2-ΔΔCT法检测标本中目的基因相对内参基因的表达量。实时荧光定量PCR引物由武汉金凯瑞生物工程有限公司设计及合成,见表1。
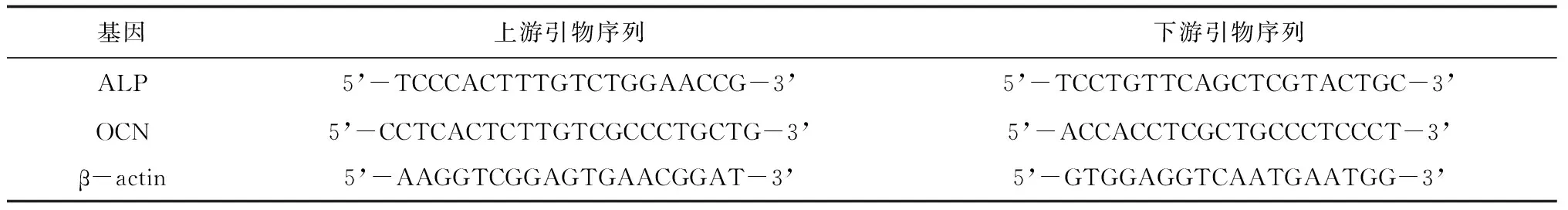
表1 引物序列
1.6转录组测序及生物信息学分析空白组和消瘀止痛合剂+BMSCs组差异基因
1.6.1转录组测序 提取空白组3只和消瘀止痛合剂+BMSCs组3只白兔的骨痂总RNA,使用K5500分光光度计评估RNA纯度,并使用生物分析仪2100系统的RNA Nano 6000检测试剂盒测量RNA完整性和浓度。每个样品中总共2 μg的RNA被用作RNA样品制备的输入材料。使用NEB Next®UltraTMRNA文库制备试剂盒生成Illumina®测序文库,并进行文库分析,使用Illumina HiSeq X Ten测序平台完成RNA-seq,并获得配对的末端序列读数。使用FastQC工具v0.11.9(https://www.biologistics.babraham.ac.uk/)对原始测序数据进行质量控制。使用默认设置的HISAT v2.1.0将干净的RNA-seq读数与参考基因比对,然后使用Samtools v1.9处理对齐的文件,并使用Feature Counts v1.6.3量化与基因组编码区对齐的读取次数。最后,DESeq2 v1.22.2与R/Bioconductor软件包一起使用,以P<0.05、∣log2FC∣>2为标准,读取计数并鉴定差异表达基因。利用微生信(http//www.bioinformatics.com.cn)绘制火山图。
1.6.2生物信息学分析 为了分析差异表达基因的功能作用,使用clusterProfiler, pathview等R语言软件包进行GO和KEGG信号通路富集分析。运用STRING11.5数据库(https://cn.string-db.org/)得到蛋白相互作用关系的数据,条件限定为研究物种为兔,相互作用阈值设为0.4,然后导入CytoScape3.9.0,利用内置“Network analyzer”功能分析靶点的拓扑参数,并以连接度为条件筛选关键基因,构建PPI网络图。
2 结 果
2.1各组血清骨代谢标志物水平比较 消瘀止痛合剂+BMSCs组血清ALP、OCN水平均明显高于其他3组(P均<0.05),消瘀止痛合剂组血清ALP、OCN水平均明显高于空白组(P均<0.05),空白组、消瘀止痛合剂组与BMSCs组比较差异均无统计学意义(P均>0.05)。见表2。
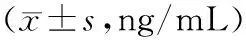
表2 各组股骨颈骨折白兔血清ALP、OCN水平比较
2.2各组造模侧股骨组织变化及病理学形态 空白组骨折线模糊不清,骨折断端周围有骨痂形成伴随的轻微凸起;HE染色显示骨小梁纤细,间隙较宽。BMSCs组骨折端有骨痂生成,可见凸起;HE染色显示骨小梁排列紊乱,密集程度低。消瘀止痛合剂组及消瘀止痛合剂+BMSCs组骨折端及周围有大量骨痂生成,可见明显凸起,伴肥大增生;HE染色见骨小梁宽度、骨小梁密集程度及钙化程度均优于其余2组,其中消瘀止痛合剂+BMSCs组更优。见图1及见图2。
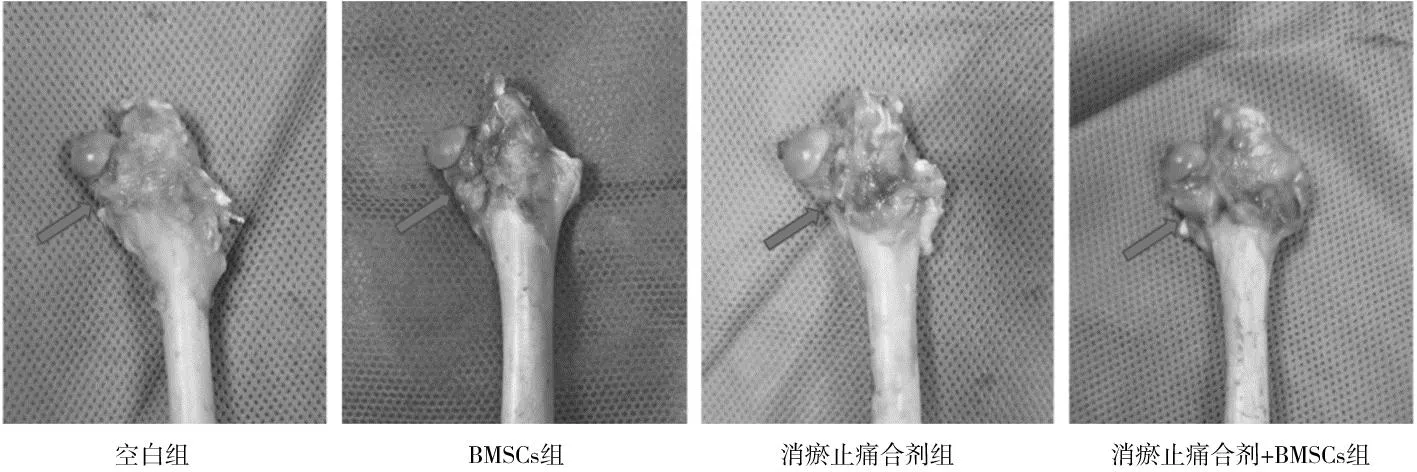
图1 各组股骨颈骨折白兔术后4周骨痂形态
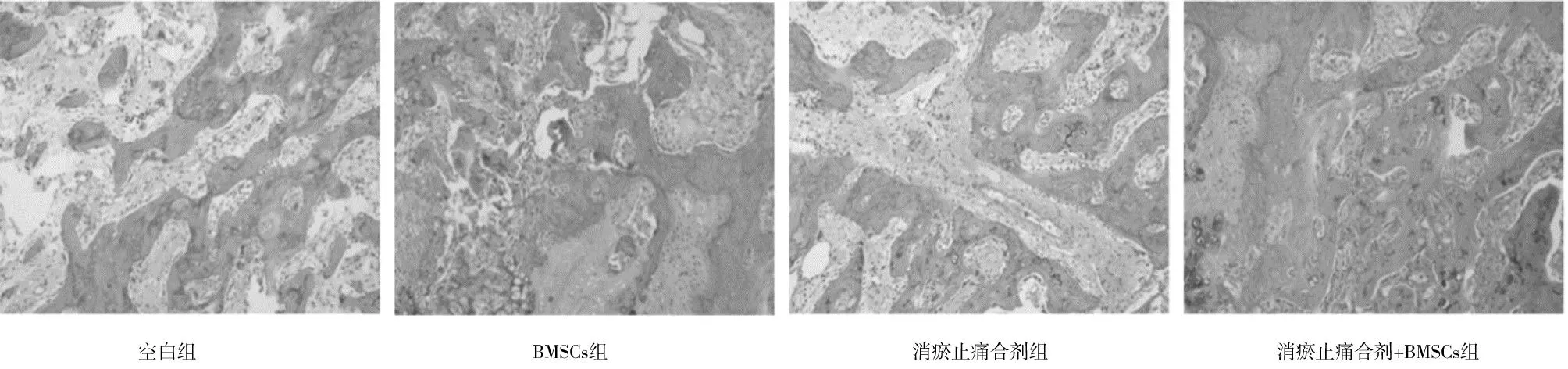
图2 各组股骨颈骨折白兔术后4周造模侧股骨组织HE染色病理形态(×100)
2.3各组骨组织中ALP、OCN mRNA表达情况比较 消瘀止痛合剂+BMSCs组ALP、OCN mRNA相对表达量均明显高于空白组及BMSCs组(P均<0.05),消瘀止痛合剂组ALP、OCN mRNA相对表达量均明显高于空白组(P均<0.05),其余组间两两比较差异均无统计学意义(P均>0.05)。见图3。
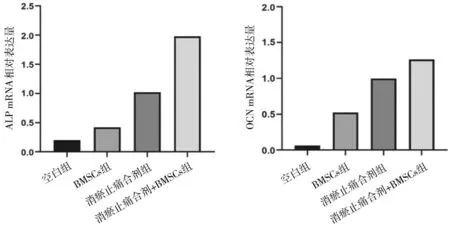
图3 各组股骨颈骨折白兔骨组织中ALP、OCN mRNA相对表达量
2.4空白组和消瘀止痛合剂+BMSCs组差异表达基因 与空白组比较,联合组差异表达基因共589个,其中390个基因表达上调,199个基因表达下调。见图4。
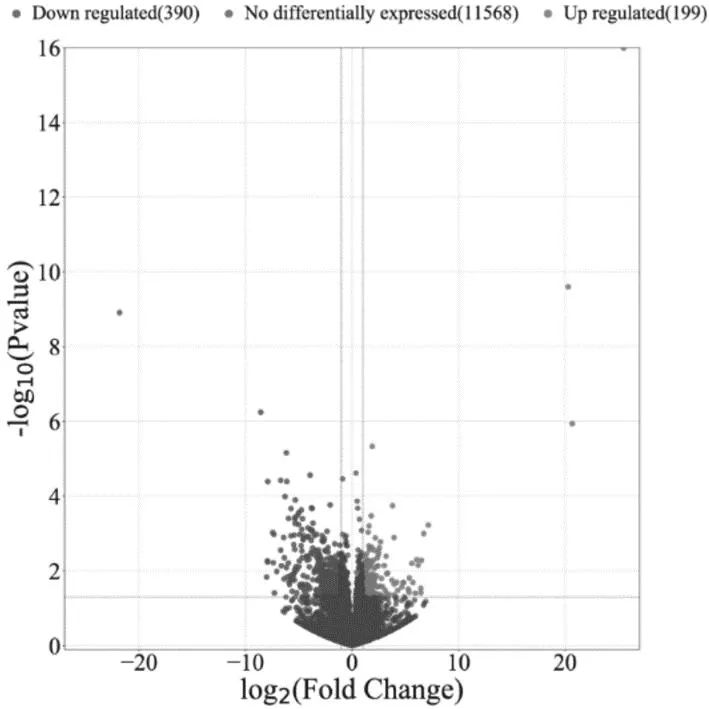
图4 空白组和消瘀止痛合剂+BMSCs组股骨颈骨折白兔差异表达基因火山图
2.5空白组和消瘀止痛合剂+BMSCs组差异表达基因GO富集分析 GO富集生物过程分析得到5 168个, BP主要与B细胞受体信号通路(B cell receptor signaling pathway)、细胞内信号转导(intracellular signal transduction)、炎症反应(inflammatory response)、化学突触传递(chemical synaptic transmission)、碳水化合物代谢过程(carbohydrate metabolic process)等有关;CC主要包括膜筏(membrane raft)、质膜的外侧(external side of plasma membrane)、基底外侧质膜(basolateral plasma membrane)、细胞外间隙(extracellular space)、核内体膜(endosome membrane)等;MF主要包括水解酶活性(hydrolase activity)、水解O-糖基化合物h(ydrolyzing O-glycosyl compounds)、钙离子结合(calcium ion binding)、碳水化合物结合(carbohydrate binding)、肝素结合(heparin binding)、胶原蛋白结合(collagen binding)等。见图5。
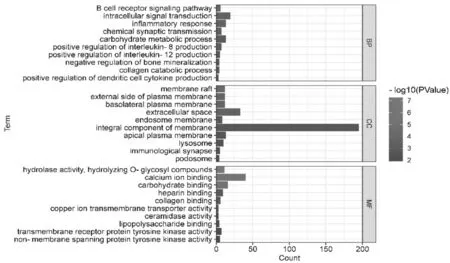
图5 空白组和消瘀止痛合剂+BMSCs组股骨颈骨折白兔差异表达基因GO富集分析(前10个)
2.6空白组和消瘀止痛合剂+BMSCs组差异表达基因KEGG信号通路富集分析 KEGG通路分析共得到292条通路,其中消瘀止痛合剂联合BMSCs治疗股骨颈骨折主要涉及通路有钙离子信号通路(Calcium signaling pathway)、Ras信号通路(Ras signaling pathway)、破骨细胞分化(Osteoclast differentiation)、趋化因子信号通路(Chemokine signaling pathway)、Toll样受体信号通路(Toll- like receptor signaling pathway)。见图6。

图6 空白组和消瘀止痛合剂+BMSCs组股骨颈骨折白兔差异表达基因KEGG信号通路富集分析(前20个)
2.7空白组和消瘀止痛合剂+BMSCs组差异表达基因PPI分析 将589个差异表达基因导入STRING数据库进行分析。经Cytoscape软件分析得知,连接度排名前列的蛋白有可能与调控Toll 样受体 4 (TLR4)、TYRO 蛋白酪氨酸激酶结合蛋白 (TYROBP)、集落刺激因子-1受体(CSF1R)、基质金属蛋白酶-9(MMP-9)等,这些靶点可能是消瘀止痛合剂联合BMSCs治疗股骨颈骨折的关键作用靶点。见图7。
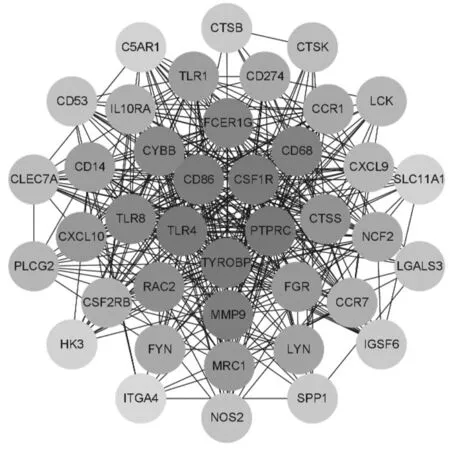
图7 空白组和消瘀止痛合剂+BMSCs组股骨颈骨折白兔差异表达基因PPI分析
3 讨 论
随着社会的发展、人们社会活动多元化及老龄化社会的到来,股骨颈骨折发病率呈上升趋势。由于股骨颈特殊的解剖结构和脆弱的血液循环给股骨颈骨折治疗带来极大的挑战。在骨折骨重建过程中有多种细胞参与,如成骨细胞、BMSCs、破骨细胞等,其中BMSCs发挥着重要作用。BMSCs可以维护骨结构稳定和平衡骨代谢,在一定条件下经诱导后可向软骨细胞和成骨细胞转化,通过促进成骨和血管生成,从而促进骨愈合[9-11]。屈宗斌等[12]报道,自体BMSCs移植治疗陈旧性胫骨中下1/3骨折能有效促进骨愈合。
消瘀止痛合剂是在中医骨伤“瘀去、新生、骨合”及骨折三期用药原则等理论指导下,由桃红四物汤加减而成。方中桃仁、红花、赤芍活血化瘀,当归养血补血,生地滋阴补血,血竭、苏木活血消肿止痛,川芎、延胡索、郁金、姜黄活血行气、通经止痛,木香行气止痛,泽兰、木通消肿止痛,甘草调和诸药。全方具有活血化瘀、养血补血行气、消肿止痛的功效。本实验结果显示,消瘀止痛合剂组及消瘀止痛合剂+BMSCs组骨折端及周围有大量骨痂生成,且消瘀止痛合剂+BMSCs组骨小梁宽度、密集程度及钙化程度均优于其他组。说明消瘀止痛合剂联合BMSCs促进骨折愈合作用优于单独使用消瘀止痛合剂及BMSCs。
骨折愈合的过程受局部骨生长因子调控[13]。OCN来源于成熟的成骨细胞,是骨基质钙化的必需物质,可反映骨生成和骨代谢情况,血清OCN水平与骨内OCN含量成正相关[14]。ALP在骨骼、肝、脾、肾上腺等处合成[15],骨骼中的ALP主要由成骨细胞合成和分泌,当骨骼损伤时,机体成骨细胞活动增加,使成骨细胞分泌的ALP渗入血液中,血清ALP水平增高,骨形成能力增强[16]。本实验结果显示,消瘀止痛合剂+BMSCs组血清中ALP、OCN水平和骨组织中ALP、OCN mRNA表达量均高于其他组,说明消瘀止痛合剂与BMSCs联合使用可促进ALP、OCN表达,加快骨痂形成,促进骨折愈合。
转录组测序结果分析显示,消瘀止痛合剂联合BMSCs治疗股骨颈骨折主要涉及钙离子信号通路、Ras信号通路、破骨细胞分化、趋化因子信号通路、Toll样受体信号通路等,可能与调控TLR4、TYROBP、CSF1R、MMP-9等基因有关。炎症是骨折愈合的重要阶段之一,在骨折早期炎症细胞的增殖和迁移可以促进骨折愈合,但炎症也是骨折延迟愈合或不愈合的重要原因。相关研究发现,TLR4可以介导骨骼中的炎症反应,敲除TLR4基因可以激活Wnt/β-catenin信号通路,减少破骨细胞数量,抑制炎症反应,从而促进骨折愈合[17-18]。TYROBP又名DAP12,其表达缺陷可以导致骨折愈合延迟,可能与DAP12调控骨折早期炎症反应和促进骨重建作用相关[19]。CSF1R对破骨细胞的增殖和分化有一定促进作用[20]。MMP-9是基质金属蛋白酶(MMP)家族的一员,在破骨细胞中高度表达,可以促进破骨细胞生长基因表达[21]。以上研究结果提示,消瘀止痛合剂联合BMSCs通过调控破骨细胞分化及炎症相关信号通路来促进骨愈合。
综上所述,消瘀止痛合剂联合BMSCs可能通过调控破骨细胞分化及炎症相关信号通路及基因表达来促进股骨颈骨折愈合,但骨折愈合机制复杂,消瘀止痛合剂与BMSCs联合应用的相关作用机制、作用通路仍需进一步探讨验证。
利益冲突:所有作者均声明不存在利益冲突。

