血府逐瘀胶囊联合顺铂对小鼠Lewis肺癌移植瘤血管新生及VEGFA、VEGFR2表达的影响
王一铮,高 冬,王 鹤,苏孙益,秦崇涛,王 虹,林 凡
(1. 福建中医药大学中西医结合学院,福建 福州 350122;2. 福建省立医院,福建 福州 350001)
血管新生是指在原已存在的毛细血管网基础上,通过内皮细胞增殖、迁移和出芽形成新的毛细血管的过程。血管新生不仅是机体正常发育、生殖和组织修复等生理过程的基础,而且还能影响多种病理过程。然而在疾病治疗中,血管新生是把双刃剑,单纯的促进或抑制血管新生都不是理想的选择。例如在肿瘤治疗中,抑制血管新生可阻断肿瘤组织的营养供应,从而抑制其生长和转移[1];但过度抑制血管新生可能导致药物与免疫细胞无法向肿瘤组织输送,从而影响药效,且有利于肿瘤细胞的免疫逃逸[2-3]。中医学认为,活血化瘀不仅包含“疏其气血,令其条达”的“祛瘀”层面, 还包含“复其真气、化旧生新”的“生新”层面,因此活血化瘀中药在理论上具有促血管新生作用[4-5]。但临床中活血化瘀中药也可用于肿瘤治疗[6],如活血化瘀经典方剂——血府逐瘀汤联合化疗应用于肺癌治疗,不仅有助于改善患者生活质量,还可缓解和控制病灶的发展[7-10]。如果活血化瘀药物在肿瘤环境中只是单纯地促进血管新生,则与肿瘤治疗中的抑制血管新生策略相违背。因此,活血化瘀药在肿瘤环境中与化疗药物联用时调控血管新生的行为和机制还需进一步阐明。本研究通过构建Lewis肺癌荷瘤小鼠模型,探讨血府逐瘀胶囊联合顺铂对小鼠Lewis肺癌移植瘤生长、肿瘤血管新生的影响及可能作用机制,为活血化瘀药物在肿瘤治疗中的应用提供一定的理论依据。
1 实验材料与方法
1.1动物及细胞 SPF级雌性C57BL/6小鼠75只,5~6周龄,体重(20±2)g,购于北京华阜康生物科技股份有限公司,实验动物合格证号:SCXK(京)2019-0008,饲养于福建中医药大学实验动物中心SPF级实验室,动物实验通过福建中医药大学动物福利伦理审查(批准文号:FJTCM IACUC2021038)。小鼠Lewis肺癌(LLC)细胞购于中国科学院细胞库。
1.2药物 血府逐瘀胶囊,天津宏仁堂药业有限公司,批号:BA03310,规格:0.4 g/粒;顺铂注射液,江苏豪森药业集团有限公司,批号:601200904,规格:5 mg/mL。
1.3试剂与仪器 兔源CD34一抗(批号:GR3240236-24)、小鼠源血管内皮生长因子A(VEGFA)一抗(批号:GR3200812-4)、兔源血管内皮细胞生长因子受体2(VEGFR2)一抗(批号:GR3220838-3),美国Abcam公司;辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗(批号:090322221028)、辣根过氧化物酶(HRP)标记山羊抗鼠IgG二抗(批号:031722221010),上海碧云天生物技术有限公司;小鼠VEGFA ELISA试剂盒(批号:202105)、小鼠碱性成纤维细胞生长因子(bFGF)ELISA试剂盒(批号:202208),酶免公司;DAB显色试剂(批号: G1211),武汉赛维尔生物科技有限公司;快速转膜液(批号:20201021)、快速封闭液(批号:20210820),新赛美生物科技有限公司;ECL化学发光检测试剂盒(批号:092922220930),上海碧云天生物技术有限公司。IX70型倒置相差显微镜及摄像装置(日本Olympus公司);Eclipse Ci正置荧光显微镜(日本尼康公司);Tecan Infinite 200 Pro多功能酶标仪(瑞士Tecan公司);RM2016型病理切片机(上海徕卡仪器有限公司);Power PacTMBasic型电泳仪、Universal Hood III型化学发光成像系统,美国Bio-Rad公司。
1.4实验方法 随机取15只小鼠作为正常组,不予任何药物处理,其余小鼠建立Lewis肺癌荷瘤模型。造模方法:采用含10%胎牛血清的DMEM高糖培养基,于37 ℃、5% CO2条件下培养LLC细胞。取生长状态良好的对数生长期细胞,用生理盐水调节其密度为1×107个/mL,每只小鼠右侧腋下皮下注射0.1 mL细胞悬液。接种7 d后,造模小鼠右侧腋下可触及米粒大小瘤块即为造模成功。将造模成功的60只荷瘤小鼠耳标编号录入Excel 2019表格,生成一组随机数,将随机数按照升序排列后依次分成血府逐瘀胶囊联合顺铂组、血府逐瘀胶囊组、顺铂组和模型组,每组15只。按照血府逐瘀胶囊药品说明书,成年人剂量为每次6粒(2.4 g),2次/d,因此血府逐瘀胶囊组小鼠每次灌胃0.36 g/kg血府逐瘀胶囊制备的溶液[剂量=2.4 g(成人一次用量)÷60 kg(成人体重)×9(小鼠与人每公斤体重剂量折算系数),加入生理盐水加热溶解配制],模型组给予生理盐水灌胃,灌胃体积均为0.1 mL/10 g体重,2次/d;顺铂组给予2 mg/kg的顺铂腹腔注射,2 d 1次;血府逐瘀胶囊联合顺铂组灌胃给予血府逐瘀胶囊(药物配制、给药方法、剂量同血府逐瘀胶囊组)和腹腔注射顺铂(方法及剂量同顺铂组)。各组均连续干预15 d。
1.5检测指标及方法
1.5.1存活率和瘤重、抑瘤率 末次干预后24 h,统计各组小鼠存活率,存活率=给药第15天小鼠只数÷给药第0天小鼠只数×100%;称量小鼠体重,摘眼球采血后脱颈椎处死,于冰上将皮下移植瘤完全剥离,称量记录瘤重,计算抑瘤率,抑瘤率=(模型组平均瘤重-用药组平均瘤重)÷模型组平均瘤重×100%。
1.5.2肿瘤微血管数量 采用免疫组化法检测:将肿瘤组织放入4%多聚甲醛中固定,乙醇脱水,石蜡包埋,切成厚4 μm切片。常规方法脱蜡、水化,抗原修复,阻断内源性过氧化物酶,3% BSA封闭30 min,滴加CD34一抗(1:4 000),4 ℃孵育过夜,滴加二抗,室温孵育50 min,DAB室温下显色。苏木精复染,脱水、透明、中性树胶封片。CD34定位于血管内皮细胞膜及细胞质,CD34标记阳性微血管可见棕黄色管腔样结构。先在100倍光镜视野下选取3个微血管最丰富的区域,每个区域分别随机选取3个400倍视野,计数每个视野中的微血管数量,取其平均值。计数时,无论是否形成管腔,任何与周围微血管、肿瘤细胞或周围结缔组织分界清晰的CD34阳性内皮细胞或内皮细胞簇均计为一个微血管,肿瘤内坏死区的微血管不纳入计数。
1.5.3血浆VEGFA、bFGF水平 眼球采血,EDTA抗凝,4 ℃下3 000 r/min离心5 min,吸取上层血浆于EP管中,采用ELISA法检测各组小鼠血浆中VEGFA、bFGF水平。
1.5.4移植瘤组织中VEGFA、VEGFR2蛋白表达情况 采用蛋白印迹法检测:提取移植瘤组织总蛋白,BCA法检测提取蛋白浓度,聚丙烯酰胺凝胶电泳后快速湿转至PVDF膜,快速封闭液封闭10 min,VEGFA一抗(1:1 000)、VEGFR2一抗(1:1 000)、β-actin一抗(1:5 000)孵育,4 ℃过夜。洗膜后以辣根过氧化物酶标记的二抗(1:5 000)孵育1 h后洗膜,ECL化学发光法显影,化学发光成像系统 Universal Hood Ⅲ曝光显像,Image Lab 3.0软件分析蛋白条带灰度值。
2 结 果
2.1各组小鼠存活率、瘤重、抑瘤率比较 顺铂组和血府逐瘀胶囊联合顺铂组小鼠均存活,血府逐瘀胶囊组和模型组各有9只(60%)存活,顺铂组和血府逐瘀胶囊联合顺铂组小鼠存活率明显高于模型组和血府逐瘀胶囊组(P均<0.05)。血府逐瘀胶囊联合顺铂组瘤重明显低于其他3组(P均<0.05),抑瘤率明显高于顺铂组和血府逐瘀胶囊组(P均<0.05);顺铂组瘤重明显低于模型组和血府逐瘀胶囊组(P均<0.05),抑瘤率明显高于血府逐瘀胶囊组(P<0.05);血府逐瘀胶囊组瘤重与模型组比较差异无统计学意义(P>0.05)。见表1。
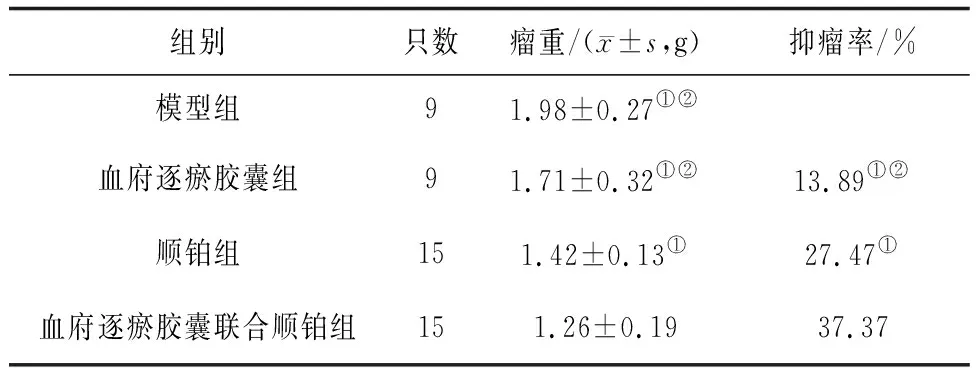
表1 Lewis肺癌移植瘤各组小鼠瘤重、抑瘤率比较
2.2各组小鼠肿瘤组织微血管数量比较 模型组、血府逐瘀胶囊组、顺铂组、血府逐瘀胶囊联合顺铂组肿瘤组织的微血管数量分别为(41.00±8.18)个、(36.50±8.19)个、(22.25±5.78)个、(30.00±6.65)个, 顺铂组微血管数量明显少于其他3组(P均<0.05), 血府逐瘀胶囊联合顺铂组明显少于模型组和血府逐瘀胶囊组(P均<0.05),血府逐瘀胶囊组与模型组比较差异无统计学意义(P>0.05)。见图1。

图1 Lewis肺癌移植瘤各组小鼠肿瘤组织微血管形态(免疫组化染色,×400,箭头所指为微血管)
2.3各组小鼠血浆VEGFA、bFGF水平比较 模型组血浆VEGFA、bFGF水平均明显高于正常组(P均<0.05);顺铂组血浆VEGFA、bFGF水平和血府逐瘀胶囊联合顺铂组bFGF水平均明显低于模型组(P<0.05),血府逐瘀胶囊组血浆VEGFA、bFGF水平和血府逐瘀胶囊联合顺铂组VEGFA水平与模型组比较差异均无统计学意义(P均>0.05),各药物组间血浆VEGFA、bFGF水平比较差异均无统计学意义(P均>0.05)。见表2。
表2 Lewis肺癌移植瘤各组小鼠血浆VEGFA、bFGF水平比较
2.4各组小鼠肿瘤组织中VEGFA和VEGFR2蛋白表达情况比较 顺铂组肿瘤组织中VEGFA蛋白相对表达量和血府逐瘀胶囊组、顺铂组、血府逐瘀胶囊联合顺铂组VEGFR2蛋白相对表达量均明显低于模型组(P均<0.05),血府逐瘀胶囊组和血府逐瘀胶囊联合顺铂组VEGFA 蛋白相对表达量与模型组比较差异均无统计学意义(P均>0.05);各药物组间VEGFA和VEGFR2蛋白相对表达量比较差异均无统计学意义(P均>0.05)。见图2及表3。
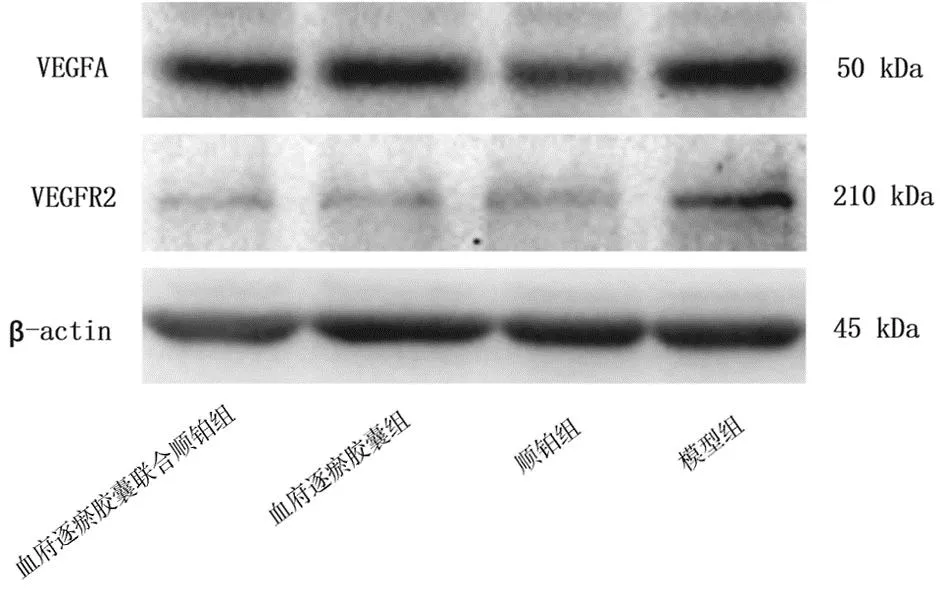
图2 Lewis肺癌移植瘤各组小鼠移植瘤组织中VEGFA、VEGFR2蛋白电泳图
表3 Lewis肺癌移植瘤各组小鼠移植瘤组织中VEGFA、VEGFR2蛋白相对表达量比较
3 讨 论
中医学认为,血瘀是肿瘤形成发展的主要病机之一。清代医家王清任在《医林改错》中提及“气无形不能结块,结块者,必有形之血也”,指岀结块必是有形之血,即血瘀。由于邪毒结聚、气血不畅、经络阻塞等因素,气滞血瘀也是肺癌的常见证型[11]。《素问·阴阳应象大论》记载:“血实宜决之,气虚宜掣之。”《血证论》曰:“凡治血者,必先以祛瘀为要。”因此,理论上认为活血化瘀是中医药治疗肿瘤的重要治则之一[4]。活血化瘀代表方血府逐瘀汤主治胸中血瘀证,该方主要由桃红四物汤和四逆散组成,其中桃红四物汤主要起活血养血作用,而四逆散主要起疏肝理气的功效,再配以桔梗、牛膝一升一降使气机通畅。临床研究数据显示,血府逐瘀汤联合顺铂等化疗药物治疗气滞血瘀型肺癌,不仅能够通过中药活血祛瘀、疏通经络等功效改善患者血液高凝状态,预防静脉血栓栓塞形成,改善生活质量,而且比单独化疗更能有效地缓解和控制病灶的发展[6-8]。本研究发现血府逐瘀胶囊无论是单独用药还是与顺铂联合用药,均有一定的抑瘤效果,联合用药比单纯使用血府逐瘀胶囊或顺铂具有更显著的疗效。以上现象进一步证明了以血府逐瘀汤为代表的活血化瘀方可在特定的时机用于肺癌的治疗。但研究结果也显示,血府逐瘀胶囊组小鼠的存活率和抑瘤率都明显低于顺铂组和血府逐瘀胶囊联合顺铂组。因此,血府逐瘀汤是否可单独用于肿瘤治疗还需再进一步进行研究和探讨。
肿瘤血管与肿瘤的生长和转移密切相关,当肿瘤生长体积大于2 mm3时,必须依靠血管新生汲取更多营养维持生长[1]。因此,抗肿瘤血管新生成为肿瘤治疗的重要策略。肿瘤血管靶向药主要包括大分子单抗药物(贝伐单抗、帕尼单抗等)和小分子靶向抑制剂(舒尼替尼、安洛替尼等)[12]。顺铂等化疗药物可通过破坏细胞的DNA结构、影响核酸合成或转录等方式,抑制肿瘤细胞增殖。由于化疗药物对肿瘤细胞的特异性选择作用不强,常常也会抑制血管内皮细胞等其他组织细胞的增殖,从而抑制肿瘤血管新生[13]。这些抗血管生成药物在肿瘤治疗中虽取得一定疗效,然而单纯的抗血管新生作用可能导致肿瘤组织出现更明显的乏氧和低pH值,影响放化疗效果,且肿瘤血管的一味减少也将使化疗药物更难到达肿瘤细胞[2-3]。目前,血府逐瘀汤等活血化瘀方调控血管新生的研究主要在缺血性疾病模型中进行,大量数据表明此类方剂在缺血性疾病中表现出显著的促血管新生作用[14-15]。但也有证据表明,活血化瘀方在特定的环境中能够抑制血管新生[16-18]。本研究结果显示,血府逐瘀胶囊单独用药对小鼠肿瘤组织的微血管数无显著影响,联合用药时与模型组相比微血管数有所减少,但联合用药与单独使用顺铂相比,微血管数有所增加。上述结果表明血府逐瘀汤调控血管新生的效应与周围环境相关,虽然其在缺血性疾病模型中可促进血管新生,但在肿瘤环境中,血府逐瘀汤并不一定会促进血管新生。本研究也表明,顺铂可抑制肿瘤血管新生,而血府逐瘀胶囊与顺铂联合用药则减弱了顺铂的抑制血管新生作用,可能正是通过这种对血管新生的适度抑制作用,使得血府逐瘀胶囊增强了化疗的疗效。
肿瘤血管新生过程受促血管生长因子和抑血管生长因子共同调控。目前已知的促血管生长因子主要包括VEGF、bFGF等。VEGFA是VEGF家族中发现最早、作用最强的因子,VEGFA可选择性作用于血管内皮细胞,从而促进内皮细胞增殖、迁移,形成新的血管;另外,VEGFA也可提高血管通透性,使纤维蛋白原等大分子蛋白外渗,并沉着于细胞外的基质,形成纤维凝胶,促进毛细血管网的形成。VEGFA主要通过与其受体VEGFR2结合发挥作用,VEGFR2主要表达于血管内皮细胞,具有很强的酪氨酸激酶活性,是影响血管新生过程的重要因素[19]。bFGF可调节血管内皮细胞的分裂和趋化,刺激内皮细胞胶原酶及纤维蛋白酶的活化,诱导血管内皮细胞形成血管芽,促进肿瘤血管生成。bFGF和VEGF在血管新生过程中具有协同作用,VEGF可刺激内皮细胞分泌bFGF,VEGF也需要bFGF的存在才能发挥其促血管生成作用[20]。本研究结果显示,仅顺铂组小鼠血浆VEGFA水平明显低于模型组,在肿瘤组织中VEGFA蛋白的表达也有同样的趋势,表明血府逐瘀胶囊在Lewis肺癌荷瘤小鼠模型中并不是通过影响VEGFA的表达量来发挥作用的。本研究结果还显示,血府逐瘀胶囊联合顺铂组和顺铂组血浆bFGF水平和肿瘤组织中VEGFR2蛋白表达量均明显低于模型组,可能正是缺乏bFGF的协同作用以及VEGFR2的受体作用,使得VEGFA无法正常发挥其促血管新生功能,联合用药和顺铂单独用药才表现出显著的抑制血管新生效应。其中顺铂能同时下调VEGFA、bFGF和VEGFR2的表达,因此能表现出较强的抑制血管新生效应;联合用药不能下调VEGFA表达,故抑制血管新生效果不如顺铂。但可能正是由于这种适度的抑制血管新生作用,更有利于化疗药物输送至肿瘤组织,从而增强化疗的疗效。
综上所述,血府逐瘀胶囊联合顺铂对Lewis肺癌荷瘤小鼠具有显著的抑瘤作用,但是联合用药的抑制肿瘤血管新生效果不如单独使用顺铂显著,单独使用血府逐瘀胶囊的抑瘤和抑制肿瘤血管新生的效果均不显著。在Lewis肺癌环境中,血府逐瘀胶囊联合顺铂治疗可能通过抑制肿瘤组织中VEGFR2的表达,在一定程度上抑制肿瘤血管新生,但其对VEGFA的表达无显著影响。血府逐瘀汤作为活血化瘀方剂,在Lewis肺癌移植瘤小鼠模型中表现出与缺血疾病模型不同的调控血管新生作用,且在不同的模型环境中,该方对VEGF信号通路的调控也不相同。这些环境如何影响血府逐瘀汤对VEGF信号通路和血管新生的调控?其中关键的靶点和开关是什么?这些问题都还需进一步研究和探讨。
利益冲突:所有作者均声明不存在利益冲突。

