远隔缺血后适应对卒中后疲劳患者的临床疗效及影响因素
叶素贞 王晓阳 白弘照 周雪珍 李海燕
1温州医科大学附属第一医院康复医学科(浙江温州 325015);2武警浙江省总队医院康复科(杭州 310051)
卒中后疲劳(post stroke fatigue,PSF)表现为自我感觉躯体或精神上的能量缺乏不愿从事日常活动,是脑卒中患者的常见并发症,文献报道其发病率为29%~77%[1]。PSF严重影响脑卒中患者的生理功能、语言思维能力、社交能力和心理情绪控制能力等[2]。目前临床上对PSF的治疗,包括药物与非药物干预,其中药物治疗又包括抗抑郁或抗精神兴奋性药,而非药物干预包括心理干预、体能训练和传统中医疗法等;然而,不管是药物或是非药物干预,其疗效都不确切[3-4]。远隔缺血后适应(remote ischemic postconditioning,RIPostC)通过短暂的缺血或缺氧刺激远离器官或组织的部位,增强机体抗缺血、缺氧能力,减轻缺血再灌注损伤,保护重要脏器,如心脏、脑、肝脏及脊髓等功能[5]。文献报道[6-7],RIPostC在改善脑卒中患者的神经功能、提高生活质量方面有重要作用。但RIPostC能否影响PSF患者的疲劳症状,尚未见报道。本研究采用RIPostC的方法干预PSF患者,观察其临床疗效,探讨其对疲劳症状的影响因素。
1 资料与方法
1.1 研究对象选取2020年6月至2022年1月在温州医科大学附属第一医院康复医学科住院治疗的卒中后疲劳患者,总共入组80例,通过随机数字表分为试验组和对照组,每组各40例,其中男50例(62.5%),女30例(37.5%);年龄40~60岁,平均(64.06 ± 12.08)岁;病程30~55 d,平均(40.06 ±5.56)d。入组脑卒中患者诊断标准均符合2018版《中国急性缺血性脑卒中诊治指南》[8]与2014版《中国脑出血诊治指南》[9],并经头颅 MRI或CT等影像学检查证实。PSF患者的纳入标准:(1)年龄>18周岁且<85周岁;(2)病程在6个月内;(3)符合De Groot等提出的PSF诊断标准[10-11]:(4)疲劳严重度量表(fatigue severity scale,FSS)评分≥ 4分;(5)患者及家属同意并签署知情同意书。排除标准:(1)认知功能障碍不能配合治疗患者;(2)发病前存在疲劳症状患者;(3)精神疾病、酒精或药物成瘾患者;(4)合并肿瘤、重症感染、重要脏器功能不全患者。本研究经过温州医科大学附属第一医院伦理委员会批准(编号:2022-037)。
1.2 方法
1.2.1 常规药物治疗入组患者均接受脑卒中常规药物治疗,缺血性卒中接受常规二级预防药物治疗(如抗血小板聚集/抗凝、调脂稳定斑块、降压、降糖等)及其他对症支持治疗;出血性卒中患者接受二级预防药物(如降压、降糖等)及其他对症支持治疗。
1.2.2 常规康复训练入组的PSF患者均接受常规康复训练。根据不同患者的临床表现制定相应的康复运动训练内容和适应的训练强度,同时根据患者的肢体功能和日常生活能力改善情况适时调整训练方案。
1.2.3 RIPostC试验组患者接受RIPostC干预,患者端坐位或仰卧位,在健侧上肢绑缚无创血压袖带,对远端肢体进行短暂反复的加压模拟缺血处理,采用自定义模式,具体方案为:加压持续性时间 5 min,施加压力 160 mmHg,每个循环间隔5 min,共接受5 个循环,模拟远端肢体缺血再循环的效应,此操作每周5天,每天1次,连续治疗4 周。
1.3 评估方法两组患者分别完成治疗前、治疗后量表评估,包括:汉密尔顿焦虑量表(hamilton anxiety scale,HAMA)评估其焦虑状态,汉密尔顿抑郁量表(hamilton depression scale,HAMD)评估其抑郁状态,简易智力状态检查量表(mini-mental state examination,MMSE)评估其认知功能,疲劳严重度量表(fatigue severity scale,FSS)评估其疲劳严重程度,美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评估其神经功能缺损程度,Barthel指数(barthel index,BI)评估其日常活动能力缺损程度。
1.4 统计学方法采用SPSS 26.0 软件进行统计学分析。计量资料均符合正态分布,以()表示,组间比较采用独立样本t检验,组内治疗前后比较采用配对样本t检验。计数资料以频数表示,组间比较采用χ2检验。影响因素分析采用logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较两组患者一般资料比较,差异均无统计学意义(P>0.05)。见表1。
表1 两组患者一般资料比较Tab.1 Comparison of general data ±s

表1 两组患者一般资料比较Tab.1 Comparison of general data ±s
组别对照组试验组χ2/t值P值例数40 40性别(男/女,例)24/16 26/14 0.214 0.644年龄(岁)64.35 ± 12.26 63.78 ± 12.04 0.212 0.833病程(d)39.75 ± 7.75 40.38 ± 5.41-0.501 0.618病变类型(梗死/出血)(例)25/15 29/11 0.912 0.340
2.2 对照组治疗前后组内各量表评分比较对照组患者治疗后NISS评分、HAMA评分、HAMD评分和FSS评分均较治疗前明显降低,差异有统计学意义(P<0.001);治疗后的BI评分、MMSE评分均较前治疗前明显升高,差异有统计学意义(P<0.001),见表2。
表2 对照组治疗前后组内各量表评分比较Tab.2 Comparison of scores before and after treatment in control group ±s,分

表2 对照组治疗前后组内各量表评分比较Tab.2 Comparison of scores before and after treatment in control group ±s,分
组别治疗前治疗后t值P值例数40 40 NIHSS 4.78 ± 2.326 3.88 ± 2.30 11.473<0.001 BI 44.88 ± 24.56 52.25 ± 24.39-11.898<0.001 MMSE 22.65 ± 3.51 23.53 ± 3.37-7.306<0.001 HAMA 7.00 ± 3.96 6.40 ± 3.78 7.649<0.001 HAMD 6.45 ± 3.53 5.85 ± 3.27 7.649<0.001 FSS 46.45 ± 4.41 41.15 ± 4.25 55.164<0.001
2.3 试验组治疗前后组内各量表评分比较试验组患者治疗后NIHSS评分、HAMA评分、HAMD评分和FSS评分均较治疗前明显降低,差异有统计学意义(P<0.001);治疗后的BI评分、MMSE评分均较治疗前明显升高,差异有统计学意义(P<0.001),见表3。
表3 试验组治疗前后组内各量表评分比较Tab.3 Comparison of scores before and after treatment in treatment group ±s,分
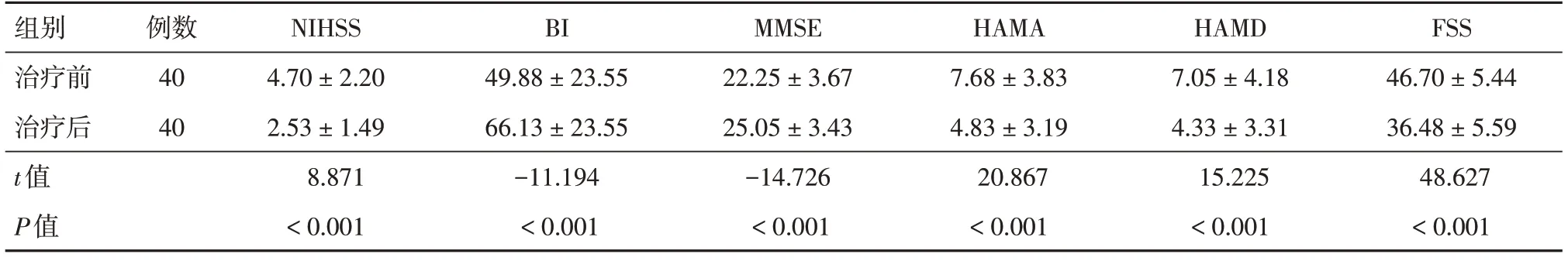
表3 试验组治疗前后组内各量表评分比较Tab.3 Comparison of scores before and after treatment in treatment group ±s,分
组别治疗前治疗后t值P值例数40 40 NIHSS 4.70 ± 2.20 2.53 ± 1.49 8.871<0.001 BI 49.88 ± 23.55 66.13 ± 23.55-11.194<0.001 MMSE 22.25 ± 3.67 25.05 ± 3.43-14.726<0.001 HAMA 7.68 ± 3.83 4.83 ± 3.19 20.867<0.001 HAMD 7.05 ± 4.18 4.33 ± 3.31 15.225<0.001 FSS 46.70 ± 5.44 36.48 ± 5.59 48.627<0.001
2.4 FSS评分多因素分析多元线性回归分析显示,构建的多元线性回归模型具有统计学意义(F=18.197,P<0.01),因变量FSS评分差值变异的66.2%可以由MMSE评分差值和HAMA评分差值来解释,见表4。
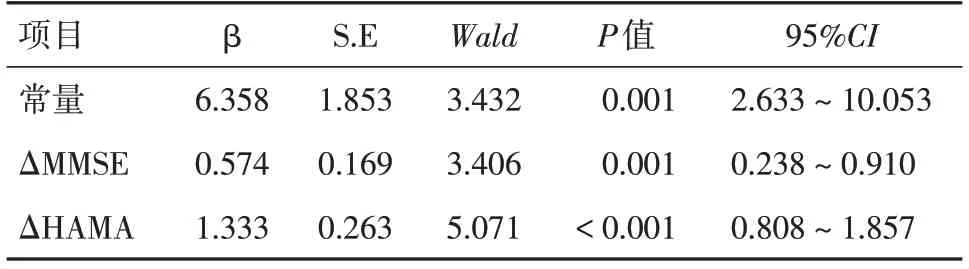
表4 治疗前后FSS评分差值的多元回归分析Tab.4 Multiple regression analysis of the difference FSS scores before and after treatment
3 讨论
PSF患者表现为一种自我感觉身体疲劳和缺乏力量,而且不能通过休息得到缓解,极大影响患者的日常生活质量、康复训练效果及心理预期[3]。PSF在脑卒中患者中常见,而且可以长期伴随。文献报道[12],在脑卒中患者发病6个月内,约50%的患者会出现疲劳症状,而且会直接影响患者日常生活的独立性和康复锻炼的依从性。一项为期1年的随访研究[13]发现,虽然经过康复训练后卒中患者的肢体功能得到恢复,但仍有高达60%的患者出现PSF。研究[2]发现,PSF患者难以融入社会,疲劳会降低患者的身体机能和日常活动能力,并且严重影响卒中患者的康复潜力和远期生存质量。
PSF的病因及发病机制尚不明确。PEDERSEN[14]研究发现,脑卒中7年后仍有80%患者发生了PSF,而且PSF的发生与性别、疾病严重程度、神经功能、认知功能、抑郁、焦虑、失眠和低活动强度相关。即使是中青年脑卒中患者,如果合并疲劳症状、认知功能损害和抑郁状态,往往预示着更糟糕的日常生存质量[15]。ALMHDAWI发现[16],日常生活质量、认知功能障碍、运动减少等都是PSF的危险因素,并以此构建了PSF的预测模型。多项研究[17-18]证实,PSF患者的疲劳症状与焦虑、抑郁呈正相关,通过患者家属鼓励及社会支持系统可以减轻疲劳程度,可以改善患者生活质量。此外,脑卒中患者存在全身性的炎症反应,PSF可能与IL-1β、IL-1ra、IL-9等炎症因子及CRP相关[19]。
药物和非药物干预是治疗PSF的主要方法,但各种方法的疗效不确切[3-4]。RIPostC是通过对远隔器官或组织实施重复而短暂性的非致死性缺血再灌注干预,激发体内抗缺血损伤保护机制,减轻重要器官或组织对缺血再灌注损伤程度,可以改善认知功能、脑灌注水平、减少脑卒中再发,具有很强的临床可行性和安全性[20]。
RIPostC动物模型的荟萃发现[21],RIPostC与梗死面积、治疗循环周期、闭塞/释放时间相关,最佳疗效参数为每次治疗3个周期,每个闭塞/释放循环(缺血再灌注时间)8~10 min,但这也与疗效评估方法及干预后开展评估的时间有关。而临床上RIPostC常用治疗参数为4~5个治疗循环周期,每个循环缺血5 min,再灌注时间5分钟,治疗急性脑卒中患者的病程为数小时至数周不等[22-24]。研究发现[25],RIPostC可以改善急性脑卒中溶栓治疗患者的神经功能及预后。联合RIPostC治疗可以有效降低脑血管病手术患者的神经系统并发症,以及缩短住院时间[26]。RIPostC的保护机制可能与其减轻脑水肿、减轻氧化应激反应、抑制炎症以及调节自噬等相关[27]。
在本研究结果中,经过治疗后两组患者的BI评分、MMSE评分均较治疗前明显升高,NIHSS评分、HAMA评分、HAMD评分和FSS评分均较治疗前降低,而且联合RIPostC治疗后症状改善更加显著。联合RIPostC治疗后FSS评分降低更显著,表明疲劳症状改善更加明显,进一步提示RIPostC可以改善患者的疲劳状态。此外,经过多因素回归相关性分析发现,联合RIPostC治疗后的脑卒中患者的疲劳改善情况与患者的认知功能改善及焦虑症状改善明显相关。匡祖颖等[28]通过CT灌注成像技术发现,RIPostC治疗2周后患者的NIHSS评分下降、BI评分较前升高,而且相对脑血流量与NIHSS评分和Barthel指数改善程度正相关有关,证实RIPostC在改善急性缺血性脑卒中患者的神经功能缺损方面有重要的应用价值。赵海霞[7]证实,RIPostC相比于常规治疗可以明显降低HAMD评分、NIHSS评分,同时提高BI评分,并可以缓解卒中后抑郁、提高患者日常生活能力。
多项Meta分析显示[5,29],RIPostC可以通过改善脑组织再灌注,降低脑卒中患者的NIHSS评分和MRS评分,提高患者MoCA评分,从而改善患者神经功能和认知功能。此外,LI等[30]证实,通过RIPostC早期干预存在神经认知功能缺损的急性脑卒中患者,改善脑卒中后90 d和180 d的MoCA评分,从而改善急性脑卒中患者的神经认知功能缺损。CHEN等[24]的临床随机对照研究发现,经过半个月的RIPostC治疗,可以明显改善急性脑卒中患者90 d后的神经功能缺损。另一项临床随机对照研究发现[20],经过1个月的RIPostC可以改善急性期缺血性脑卒中患者的RR间期及矫正后的RR间期,增强自主神经总活性和迷走神经活性,明显改善脑卒中患者的自主神经功能。文献报道[31],RIPostC可以改善脑卒中患者6个月后的认知功能缺损,如视觉空间、执行功能和注意力等,并与改善大脑中动脉血流相关。KHAN等[32]研究发现,RIPostC可以通过抑制炎症反应,阻止细胞死亡,减少Aβ的产生和积累,进而改善脑卒中患者的认知功能。由此,我们推测RIPostC可以改善PSF患者疲劳症状,其作用可能是与改善认知功能和焦虑症状相关。
综上所述,联合RIPostC及常规康复训治疗都可以改善PSF患者的疲劳症状、神经功能、日常生活能力、认知功能和焦虑抑郁状态,而且联合RIPostC干预后其临床疗效改善更加显著;同时我们发现,RIPostC改善PSF患者的疲劳症状可能是通过改善认知功能和缓解焦虑症状,这可能与RIPostC改善脑组织灌注、减轻炎症反应有关。本研究的局限性在于PSF患者样本量偏小,没有选择单一病种,影响因素较多。此外,具体的病理生理机制也需要进一步深入研究加以明确。

