特应性皮炎患者血清C型凝集素结构域家族4成员G水平及其意义
陈祥 蒋最明 李胜 顾敏 周喜桃 罗文辉 林慧 唐满玲
株洲市中心医院1检验医学中心,2肾内科,3皮肤科(湖南株洲 412007)
特应性皮炎(atopic dermatitis,AD)是一种以皮肤炎症和皮肤屏障缺陷为特征的慢性复发性皮肤病。AD发病机制复杂,主要与免疫、遗传、感染和环境等因素相互作用有关,病理机制尚未阐明[1]。为此,探索发病机制,寻找合适治疗靶点,研发新型药物至关重要[2]。C型凝集素结构域家族4成员G(C-type lectin domain family 4 member G,CLEC4G)是一类含有Ca2+依赖糖识别域的蛋白超家族中的一员,是固有免疫系统中重要的模式识别受体,在维持机体稳态以及感染、炎症和肿瘤免疫等疾病过程中发挥重要作用,是重要的免疫检查节点[3-4]。TENGVALL等[5]对9只德国牧羊犬AD病变皮肤进行mRNA测序,发现CLEC4G是犬AD免疫失调的重要分子,但暂无文献报道CLEC4G是否参与人AD的发生发展。因此,本研究旨在探讨CLEC4G与AD之间的关系,为AD发病机制及诊疗提供数据支撑。另外,AD以Th1/Th2细胞分化失衡为基本特征[6],IL-33是IL-1家族成员,其通过结合特异性受体转硫酶同系物(homolog of sulfotransferase,ST)2发挥作用,能有效驱动Th2细胞因子的产生[7],在多种自身免疫性疾病的发病中起着重要作用。分析CLEC4G与IL-33间的相关性,可为AD病理生理过程提供理论依据,对了解AD发生的分子机制及其上下游信号通路具有重要意义。
1 资料与方法
1.1 研究对象观察组:收集2020年6-10月在株洲市中心医院皮肤科确诊的60例AD患者,根据中国特应性皮炎诊疗指南(2020版)[6]将AD分为儿童期(2~12岁)、青少年与成人期(12~60岁),其中男32例,女28例,年龄(16.6 ± 10.7)岁。所有患者均符合Williams诊断标准[8]。
对照组:选取同期在株洲市中心医院体检中心和儿保中心体检的29例健康者,其中男15例,女14例,年龄(16.5 ± 9.4)岁,排除过敏性疾病史,近期均未使用糖皮质激素和免疫抑制剂。两组在性别和年龄两方面差异均无统计学意义(P>0.05)。本研究经株洲市中心医院伦理委员会批准(2021161-01),并获得免除患者知情同意。
1.2 方法
1.2.1 血液样本的收集空腹时抽取受试者3~5 mL静脉血,室温下2 000 ×g离心10 min,吸取上清至无菌离心管中,-70 ℃冰箱保存用于后续检测。
1.2.2 血清CLEC4G、IL-33水平检测采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)定量测定血清CLEC4G、IL-33水平。人CLEC4G、IL-33试剂盒购于上海江莱生物科技有限公司,按照试剂盒说明书严格进行实验操作。
1.2.3 血清IgE水平检测采用Allergy Screen变应原定量免疫综合组试剂条(德国Mediviss公司)检测血清IgE水平,实验操作严格按照试剂盒说明书进行。选取的过敏原包括8种常见吸入性过敏原:户尘螨、猫毛皮屑、狗毛皮屑、蟑螂、桑树、柳、蒿、屋尘;8种常见食入性过敏原:牛奶、牛肉、芒果、腰果、蟹、贝、虾、鸡蛋白。sIgE结果为定量数据,tIgE结果为分类数据,以≤ 100 kU/L、100~200 kU/L、≥ 200 kU/L表示。
1.2.4 外周血嗜酸性粒细胞水平检测所有受试者均空腹下采用EDTA-2K抗凝管抽取2 mL静脉血,采用XN-2800全自动血液分析仪(日本Sysmex公司)检测嗜酸性粒细胞水平。
1.2.5 疾病严重程度评分根据欧洲特应性皮炎评分指数(scoring atopic dermatitis index,SCORAD)评估AD的严重程度,将60例AD患者分为轻度组(29例,0~24分),中度组(20例,25~50分),重度组(11例,>50分)。
1.3 统计学方法采用SPSS 25.0和Graphpad Prism 8.0软件进行统计学分析并绘图;计量资料以均数±标准差表示;两样本均数比较采用t检验;多组间均数比较采用单因素方差分析;采用Pearson检验对数据进行相关性分析;采用logistic回归分析评估AD发病的危险因素,均以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者外周血中CLEC4G和嗜酸性粒细胞水平与对照组相比,观察组CLEC4G水平显著降低(P<0.001),观察组内,儿童期、青少年与成年期及男、女性患者之间,血清CLEC4G水平差异无统计学意义(P>0.05)。此外,嗜酸性粒细胞水平在观察组与对照组间差异无统计学意义(P>0.05)。见表1。
表1 AD组与对照组外周血中CLEC4G及嗜酸性粒细胞水平比较Tab.1 Comparison of CLEC4G and eosinophils in peripheral blood between AD group and control group ±s

表1 AD组与对照组外周血中CLEC4G及嗜酸性粒细胞水平比较Tab.1 Comparison of CLEC4G and eosinophils in peripheral blood between AD group and control group ±s
注:与对照组比较,*P<0.001
组别AD组儿童期青少年与成人期男性女性对照组嗜酸性粒细胞(× 1012个/L)0.26 ± 0.23 0.27 ± 0.18 0.23 ± 0.20 0.30 ± 0.21 0.24 ± 0.30 0.22 ± 0.20例数60 29 31 28 32 29年龄(岁)16.6 ± 10.7 8.3 ± 1.9 25.2 ± 9.3 13.3 ± 7.3 17.7 ± 11.3 16.5 ± 9.4 CLEC4G(ng/L)359.4 ± 57.3*361.0 ± 64.3 357.9 ± 50.4 353.0 ± 55.3 363.4 ± 58.9 521.8 ± 48.1
2.2 AD患者血清CLEC4G水平与tIgE相关性分析60例AD患者中有41例sIgE阳性,阳性率为68.3%;38例tIgE阳性,阳性率为63.3%,其中tIgE水平≥ 200 kU/L者20例,CLEC4G水平为(351.5 ±56.6) ng/L;100~200 kU/L者18例,CLEC4G水平(337.9 ± 57.5)ng/L;tIgE ≤ 100 kU/L者22例,CLEC4G水平(384.3 ± 50.5) ng/L。tIgE ≤ 100 kU/L组CLEC4G水平显著高于tIgE 100~200 kU/L和tIgE ≥ 200 kU/L组(P=0.010,P=0.038),但CLEC4G水平在tIgE ≥ 200 kU/L组和100~200 kU/L组间差异无统计学意义(P=0.439)。
2.3 轻度、中度和重度AD患者CLEC4G和嗜酸性粒细胞水平比较与轻度组比较,中度组CLEC4G水平显著降低(P<0.05),但重度组CLEC4G水平与中度组、轻度组间差异无统计学意义(P>0.05);嗜酸性粒细胞水平在各组间差异无统计学意义(P>0.05)。见表2。
表2 不同严重程度AD患者血清CLEC4G和嗜酸性粒细胞水平Tab.2 Serum CLEC4G and eosinophils levels in AD patients with different severity ±s
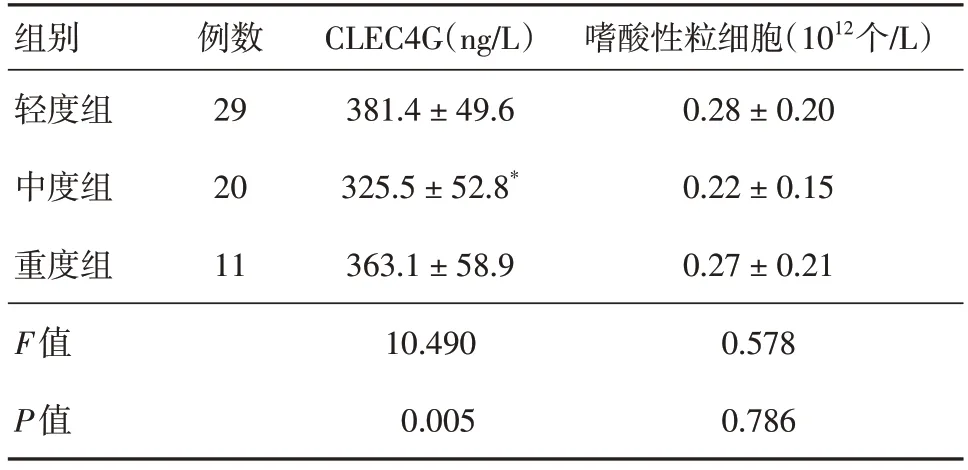
表2 不同严重程度AD患者血清CLEC4G和嗜酸性粒细胞水平Tab.2 Serum CLEC4G and eosinophils levels in AD patients with different severity ±s
注:与轻度组相比,*P<0.05
组别轻度组中度组重度组F值P值嗜酸性粒细胞(1012个/L)0.28 ± 0.20 0.22 ± 0.15 0.27 ± 0.21 0.578 0.786例数29 20 11 CLEC4G(ng/L)381.4 ± 49.6 325.5 ± 52.8*363.1 ± 58.9 10.490 0.005
2.4 AD患者血清CLEC4G与IL-33水平比较与对照组[(221.2 ± 47.4)ng/L]相比,观察组[(358.1± 51.1)ng/L]血清IL-33水平显著升高(P<0.001)。AD患者血清CLEC4G与IL-33之间并无显著相关性(r=0.090,P=0.495)。
2.5 AD发病的危险因素分析以AD发病为自变量,以年龄、性别、CLEC4G、IL-33为协变量,采用logistic回归分析评估AD发病的危险因素。结果显示,年龄<14岁和IL-33为AD发病的危险因子,OR值分别为2.584、1.241,95%可信区间(confidenceinterval,CI)分别为1.004~6.647、1.030~1.495;而CLEC4G为AD的保护因子(OR=0.890,95%CI:0.809~0.979)。见表3。

表3 AD发病的危险因素分析Tab.3 Analysis of risk factors for the incidence of AD
3 讨论
AD是一种异质性皮肤疾病,因免疫因子表达不同,其症状和疗效存在差异[9]。大多数轻中度AD患者接受外用药物、润肤剂和口服药物等将会获得较好的疗效,但部分中度至重度AD患者的治疗效果不佳,通常需使用免疫抑制剂和生物制剂。因此,了解AD免疫失调的分子机制,根据临床症状和免疫因子制定个体化治疗具有重要意义[10]。
CLEC4G是固有免疫系统中重要的模式识别受体,在笔者先前的研究中,CLEC4G被发现是维持肝脏正常免疫功能重要的宿主因子,随着肝脏免疫系统的失调,其表达减少[11-12]。因此,探讨CLEC4G是否也参与AD免疫功能失调,引起了笔者极大的兴趣。研究发现,AD患者血清CLEC4G水平显著降低,表明CLEC4G可能是AD发病的宿主保护因子,但这与TENGVALL[5]等在德国牧羊犬病变皮肤中的检测结果相反,可能与不同物种,不同组织等有关,尚需在AD患者病变皮肤中进一步确认。研究发现儿童期和青少年与成人期AD及男、女性AD患者血清中CLEC4G水平无显著差异,可能与CLEC4G作为固有免疫系统分子,均参与不同类型AD的发病。但由于本研究入组AD患者数量较少,也没收集到婴儿及老年期患者标本,需要在更多样AD人群中验证CLEC4G水平。
嗜酸性粒细胞、血清tIgE及sIgE检测是中国AD实验室检测指标[6],部分病例会随AD病情加重而升高,对AD诊断有重要参考价值。研究发现嗜酸性粒细胞在儿童期和青少年与成人期AD及男、女性AD患者中无显著差异。另外,60例AD患者血清tIgE阳性率为63.3%,sIgE阳性率为68.3%,表明本地区大多数为外源性AD患者,这与前人报道结果一致[13]。此外,研究发现CLEC4G水平在tIgE ≤ 100 kU/L组中显著升高,但在tIgE ≥200 kU/L组和100~200 kU/L组间无显著区别,这表明一定程度上,CLEC4G可作为外源性AD辅助诊断指标。
AD根据SCORAD评分可分为轻、中、重三组,评估与疾病严重程度之间的关系是临床应用价值重要的研究内容。本研究发现,与轻度组比较,中度组CLEC4G水平显著降低,但重度组CLEC4G水平与中度组、轻度组间无显著差异,这可能与实验样本量不够有关,也可能与AD免疫失调后触发负反馈机制有关[14]。
另一方面,IL-33是驱动AD发病时Th1/Th2细胞分化失衡的细胞因子[7],本研究也验证了IL-33在AD患者血清中的水平,与QIU等[15]研究结果一致,IL-33在AD患者血清中水平显著升高,IL-33是AD发病的危险因子,但CLEC4G与IL-33之间并无显著负相关关系,表明CLEC4G可能是独立于IL-33介导AD发病的保护因子。
最后,本研究对AD发病的危险因素进行了分析。研究发现,年龄小于14岁和IL-33为AD发病的危险因子,年纪大于14岁和CLEC4G为AD的保护因子,性别与AD发病风险无关。这与AD好发于儿童期的事实一致,但其中生物学依据有待进一步探究。
综上所述,本文初步探讨了AD患者血清CLEC4G水平及其临床意义,虽然样本量不大,但入组对象均有典型的临床症状,所以具有一定的代表性和可信度,为AD发病新机制及诊疗提供了新的数据。

