药物洗脱支架治疗股腘动脉硬化闭塞症的效果分析
郑浩哲 王兵 牛晓阳 崔文军 王岭 吕正佐
郑州大学第五附属医院血管外科(郑州 450052)
股腘动脉硬化闭塞症是血管外科的常见疾病,该病导致下肢跛行、静息痛,甚至截肢,严重危害生命健康[1]。治疗方法主要围绕重建病变段动脉的血流而展开。近年来腔内治疗技术突飞猛进,已成为重建下肢血运的首选方法。
经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)和腔内植入金属裸支架(bare metal stent,BMS)可以通过球囊或支架的扩张作用解除血管狭窄、闭塞,但是术后中短期通畅率与再狭窄率均不理想[2]。随着治疗理念的更新与技术的不断发展,药物洗脱支架(drug-eluting stents,DES)打开了将载药技术与支架结合的新思路。它具备支架对管腔的支撑作用与负载药物的抗增殖作用,能够达到维持管腔长期通畅的目的,已经在临床股腘动脉硬化闭塞症治疗上得到应用[3]。本研究通过对近年于郑州大学第五附属医院接受DES治疗与BMS治疗的股腘动脉硬化闭塞症患者进行分析,了解其近中期的治疗效果。
1 资料与方法
1.1 一般资料及分组收集2020年10月至2021年6月收治入院的47例股腘动脉闭塞患者临床资料,平均年龄(68.4 ± 8.2)岁。患者资料分为DES组(n=24)和BMS(n=23),所有患者接受治疗前均进行影像学检查,包括多普勒超声、CT血管成像(CTA)及数字减影血管造影(DSA)。
纳入标准:(1)经下肢动脉超声或 CTA检查显示股腘动脉狭窄或闭塞,经数字减影血管造影(DSA)证实病变血管狭窄程度≥ 50%;(2)有明确临床症状如患肢麻、凉,跛行,静息痛和破溃,或Rutherford 分级为2~5级;(3)初发病例,此前未接受过血管外科介入及手术治疗;(4)参照血管直径为≥ 4 mm 且≤ 7 mm;(5)患肢远端流出道状况良好。排除标准:(1)拒绝血管支架和/或不同意参与随访;(2)对紫杉醇及抗凝抗血小板等药物有严重过敏反应;(3)严重的凝血功能障碍;(4)合并有严重心、肺、肾等重要器官功能衰竭无法耐受手术。
两组患者一般情况、高危因素、血管病变情况比较差异无统计学意义(均P>0.05,表1)。本研究获医院伦理委员会批准(编号:KY2023029)。
表1 两组患者一般情况Tab.1 Comparison of the general situation between the two groups ±s

表1 两组患者一般情况Tab.1 Comparison of the general situation between the two groups ±s
因素年龄(岁)男性[例(%)]合并症[例(%)]高血压高血脂糖尿病肾功能不全脑梗死冠心病吸烟[例(%)]ABI病变长度[例(%)]≤ 10 cm>10 cm~≤ 20 cm>20 cm~≤ 30 cm闭塞性病变 [例(%)]参考血管直径(cm)病变钙化[例(%)]无钙化或轻度钙化中度钙化重度钙化Rutherford分级[例(%)]2 3 4 5 DES组(n=24)69.13 ± 7.69 15(62.5)BMS组(n=23)67.57 ± 8.87 13(56.5)χ²/t /z值0.645 0.174 P 值0.522 0.676 12(50.0)16(66.7)16(66.7)6(25.0)5(20.8)6(29.2)18(75.0)0.36 ± 0.14 16.13 ± 3.45 8(33.3)10(41.7)6(25.0)12(50.0)4.81 ± 0.85 13(56.5)14(60.9)12(52.2)8(34.8)6(26.1)3(13.0)14(60.9)0.37 ± 0.13 15.27 ± 3.08 10(43.5)9(39.1)5(21.7)10(43.5)4.75 ± 0.93 0.201 0.171 1.024 0.537 0.181 0.104 1.079 0.331 0.899 0.654 0.679 0.312 0.464 0.671 0.747 0.299 0.742 0.373 0.201 1.513 0.344 0.654 0.317 0.731 11(45.8)6(25.0)7(29.2)11(47.8)7(30.4)5(21.7)1.298 0.767 4(16.7)6(25.0)6(25.0)8(33.3)6(26.1)4(17.4)4(17.4)9(39.1)
1.2 手术方法患者术前均进行血管超声及CTA检查,明确病变情况,选择穿刺点及入路。在局麻下,使用改良Seldinger法穿刺患侧或健侧股动脉。穿刺成功后置入5F血管鞘,行下肢动脉造影确认病变范围和程度。如需“翻山”操作,在超选入对侧股总动脉后更换6F或7F“翻山”鞘,通过造影确认股浅动脉、股深动脉及远端的通畅情况。静脉推注肝素(80 U/kg)使全身肝素化后,使用导丝配合导管开通闭塞段,造影确认导管导丝位于真腔。必要时更换加硬导丝,配合支持导管向下开通。在正向开通困难时,采用超声及透视引导下逆穿技术,逆行开通病变段通路。根据病变狭窄情况,两组病例在植入支架前,均选择合适的球囊进行预扩张。对于长段病变,可以使用2个重叠支架覆盖病变,重叠区域约1 cm。共植入支架60枚,其中DES支架31枚(Eluvia,波士顿科学公司);BMS支架29枚(11枚Innova支架,波士顿科学公司;15枚Lifestent支架,碧迪公司;3枚Supera支架,雅培公司),支架释放后根据造影情况使用球囊进行适度后扩张,使支架完整的贴附于血管内膜。所有患者支架均成功释放,造影观察未见支架倾斜或展开不良,股腘动脉段及远端动脉显影良好,手术成功。术后即刻给予患者抗凝治疗(低分子肝素钠,0.1 mL/kg,q12h,连用3 d),同时单药抗血小板治疗(阿司匹林100 mg/d或氯吡格雷75 mg/d)。3 d后停用抗凝治疗,改为双重抗血小板治疗3个月。之后在无禁忌证前提下长期单药抗血小板治疗,并服用瑞舒伐他汀降脂治疗。
1.3 随访及观察指标术后通过门诊或电话对患者进行随访,主要随访指标包括ABI、Rutherford分级、靶血管通畅率等。患肢踝肱指数(ABI):分别测量并记录患者术前、术后7 d及术后3、6、12、24个月的ABI,ABI ≥ 0.9为正常。Rutherford分级变化:分别记录患肢在术前、术后7 d及术后3、6、12、24个月时的Rutherford 分级。靶血管一期通畅率定义为靶血管维持通畅,术后复查血管彩超及CTA,未出现明显的再狭窄或闭塞且没有临床症状,不需要再次干预治疗者。靶病变血运重建率(target lesion revascularizition,TLR):术后病变段出现血管再狭窄或闭塞,需要再次手治疗所占百分率。
1.4 统计学方法采用SPSS 26.0软件分析和处理数据。计量资料呈正态分布以均数±标准差表示,两组比较采用独立样本t检验,组内治疗前后比较采用配对t检验,计数资料以例(%)表示,两组比较采用χ²检验,等级资料组间比较采用秩和检验。Kaplan-Meier生存分析用于表示两组一期通畅率,采用Log-rank检验组间有无差异。P<0.05为差异有统计学意义。
2 结果
2.1 手术情况47例患者手术均取得成功,未发生与手术相关的重大不良事件(截肢、死亡),技术成功率100%。DES组24例患者,其中20例术中经真腔下开通病变段,4例经内膜下开通病变段,5例采用逆穿逆行开通病变段。24例患者术后临床症状均较术前明显改善。术后1例患者出现肺部感染,经抗菌药物治疗后痊愈。2例患者出现穿刺点血肿,经超声明确病情后,停用抗凝治疗,对穿刺点压迫止血后血肿消失。BMS组23例患者,21例患者经真腔下开通病变段,2例经内膜下开通病变段,2例采用逆穿逆行开通病变段。术后症状改善率95.7%(22/23)。术后1例患者穿刺点假性动脉瘤形成,在超声引导下行瘤腔内注射凝血酶、局部加压治疗后痊愈,1例患者术后3 d突发急性左心衰竭,给予镇静、吸氧、利尿、扩血管治疗后好转。
2.2 随访结果47例患者均获得随访,随访时间20~27个月,平均随访(24.18 ± 2.65)个月。
2.2.1 两组患者ABI及Rutherford分级比较术前、术后7 d、3个月两组患者ABI比较差异均无统计学意义(P>0.05),术后6、12、24个月DES组患者ABI增长值均高于BMS组(P<0.05,表2)。术后DES组和BMS组各有 1 例患者症状改善不明显,其余患者均达到轻度间歇性跛行水平,术后6、12 、24个月比较中,两组患者 Rutherford 分级变化差异均无统计学意义(P>0.05,图1)。

图1 两组患者随访期间Rutherford 分级分布Fig.1 Rutherford grading distribution during follow-up between the two groups
表2 两组患者随访期间ABI对比Tab.2 Comparison of the ABI between the two groups during follow-up ±s

表2 两组患者随访期间ABI对比Tab.2 Comparison of the ABI between the two groups during follow-up ±s
时间术前术后7 d术后3个月术后6个月术后12个月术后24个月术后6个月较术前增长术后12个月较术前增长术后24个月较术前增长DES组0.36 ± 0.14 0.88 ± 0.12 0.86 ± 0.19 0.82 ± 0.23 0.80 ± 0.21 0.75 ± 0.25 0.48 ± 0.16 0.45 ± 0.18 0.42 ± 0.09 BMS组0.37 ± 0.13 0.83 ± 0.22 0.78 ± 0.21 0.65 ± 0.33 0.61 ± 0.27 0.57 ± 0.23 0.31 ± 0.17 0.26 ± 0.13 0.18 ± 0.11 t值0.331 0.614 0.501 2.088 2.517 3.156 2.739 3.014 3.739 P值0.742 0.653 0.127 0.043 0.014 0.029 0.031 0.017 0.015
2.2.2 Kaplan-Meier生存分析DES组术后3、6、12、24个月一期通畅率分别为100%、95.8%、91.7%、83.3%;BMS组术后3、6、12、24个月一期通畅率分别为95.7%、91.3%、65.2%、56.5%。两组患者术后3、6个月通畅率对比差异无统计学意义(P=0.975、0.525),两组患者术后12、24个月通畅率对比差异有统计学意义(P=0.027、0.045)。Log-rank检验显示DES组12、24个月一期通畅率均高于BMS组(P=0.031,图2)。
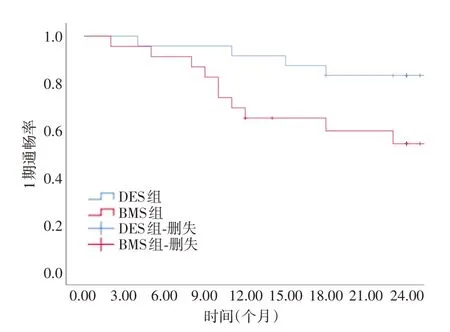
图2 两组患者术后一期通畅率对比Fig.2 Comparison of primary patency rate in two groups
TLR 对比:DES组术后24个月发现4 例患者靶血管再狭窄>50%,其中1例合并房颤的患者在术后4个月突发下肢动脉栓塞,明确诊断后给予抽栓治疗后血流恢复通畅。3例患者下肢缺血症状不明显,给予抗凝、扩血管、活血化瘀等对症治疗后症状消失。BMS组术后24个月发现10例患者靶血管再狭窄>50%,4 例患者保守治疗,6例患者对病变血管再次干预,给予抽栓及支架内球囊扩张后血流部分通畅。对比两组患者的TLR,DES组较BMS组有明显的优势(4.0%vs.26.1%,P<0.05)。
3 讨论
腔内治疗因其创伤小、恢复快、易耐受、可重复等优点,逐渐成为股腘动脉闭塞症血运重建治疗的首选方法[4]。PTA和BMS曾是治疗股腘动脉硬化闭塞症的主要手段,但是血管弹性回缩、扩张产生限流性夹层以及血管内膜增生等问题,导致治疗后血管再狭窄,严重影响管腔长期通畅[5]。紫杉醇作为抑制平滑肌细胞增殖的细胞毒性药物,能够有效减轻腔内治疗后血管内膜增生,降低治疗后血管再狭窄风险[6]。DES将支架与抗细胞增殖药物结合,从理论上讲,可以发挥支架对管腔的支撑作用,同时利用携载的药物抑制支架植入后的内膜增生,降低支架内再狭窄的风险。将DES应用于股腘动脉闭塞症血运重建治疗有望达到长期维持管腔通畅的目标。
1代DES(Zilver PTX,COOK公司)尝试在支架上喷涂紫杉醇药物,单位面积的载药剂量3 μg/mm2,KICHIKAWA等[7]研究显示,在平均病变长度146 mm,CTO病变占41.5% 的患者群体中使用ZilverDES,2年一期通畅率为70.3%,免于CD-TLR发生率为83.7%。这初步说明了将紫杉醇与支架结合而成的DES在股腘动脉病变的治疗中的有效性。但是也有研究质疑,使用直接喷涂方式的DES在长段、严重钙化病变中抑制再狭窄的能力欠佳[8-10]。本研究使用的2代DES,载药方式为将紫杉醇混入聚合物后附着在支架上,单位面积载药量更小(0.167 μg/mm2),并且通过聚合物载药方式实现药物缓慢释放,使组织中的有效药物浓度维持12~15个月,覆盖股腘动脉病变再狭窄进程的最高峰时期[11]。此外,聚合物良好的生物兼容性也减小了支架对血管内膜的刺激。MAJESTIC试验对接受2代DES治疗的患者进行了长达3年随访,其表现出了优异的长期通畅率及免于TLR率,并且未发现支架断裂和主要靶肢体截肢[12]。在随后的IMPEARIAL试验[13-14]中也发现,使用聚合物涂层载药的2代DES在通畅率、TLR及临床改善方面的表现也均优于无聚合涂层的1代DES。
在国外关于DES的多项研究中已报道了DES与BMS在股腘动脉硬化闭塞症治疗上的疗效对比,在随访结果中均发现DES在提高长期通畅率及降低再狭窄率方面优于BMS,国内相关临床报道目前较少[15]。本研究分析对比了DES和BMS治疗股腘动脉硬化闭塞症的中短期临床疗效,结果显示:术后6、12、24个月DES组患者ABI增长值均高于BMS组。DES组术后12、24个月一期通畅率分别为91.7%、83.3%,术后24个月TLR为4.0%,各项指标均优于BMS组(均P<0.05),表明了DES治疗股腘动脉硬化闭塞症的有效性和优越性。在术后并发症方面,DES组与BMS组,组间差异无统计学意义,且两组均未见明显贫血、白细胞和血小板计数减少、肝肾功能损伤、过敏反应等不良事件,也进一步证明紫杉醇治疗外周血管疾病的安全性。GOUËFFIC等[16]研究中观察到,接受DES与BMS治疗的患者12个月免于支架内再狭窄率无差异,在24个月的随访中,也未观察到DES较BMS在通畅率方面的优势,考虑原因可能为其研究使用的DES载药方式是支架表面直接喷涂紫杉醇,而在支架内再狭窄超过1年的进程中,药物并不能达到持续释放。在随后GOUËFFIC等[17]进行的EMINENT试验中,对比了BMS和聚合物涂层载药的新一代DES在治疗股腘动脉病变的临床疗效,结果显示接受DES治疗的患者12个月时一期通畅率显著高于BMS,这说明相较于BMS,采用聚合物涂层载药技术后的DES治疗股腘动脉硬化闭塞症具有更加显著且持久的优势。
在此前的研究中,受到支架内再狭窄的困扰,在股腘动脉病变中使用支架变得越来越谨慎[18]。药物涂层球囊(drug-coated balloon,DCB)因其无支架植入和抑制内膜增生的优势,在临床股腘动脉硬化闭塞症治疗上取得较为满意的效果[19]。但是,针对长段、CTO、严重钙化等复杂病变,应用DCB的结果并不理想[20-22]。而DES依靠支架载药维持管腔,支架具备优异的抗压缩能力和径向外扩力,可以抵抗由于生物机械应力而造成的血管弹性回缩,维持长段困难病变的管腔开通。在支架上涂附的聚合物载药涂层能够缓慢持续地释放紫杉醇药物,延长药物的抗内膜增生作用时间,有助于克服由于病变钙化而导致的药物生物利用度降低[12],更加适应复杂病变。STAVROULAKIS等[23]对使用DES治疗的137处靶病变进行了2年随访,病变长度为(194 ± 108)mm,其中74%为CTO病变,72%存在明显钙化,24个月一期通畅率为71%,二期通畅率及免于TLR为80%,免于大截肢率为98%,显示了DES治疗长段、CTO、钙化性病变优势显著。BAUSBACK等[24]研究还对比了DES与DCB在复杂病变中的长期疗效,结果发现DES组和DCB组的12个月一期通畅率分别为 79%和80%(P=0.96),36个月时分别降至54%和38%(P=0.17),在长达36个月的时间内观察到了使用DES的优势。在本研究中,DES应用于复杂性股腘动脉病变获得了令人满意的一期通畅率。特别是本研究DES组纳入病例病变长度(16.13 ±3.45)cm,中长段病变占比66.7%,闭塞性病变占比45.8%,中重度钙化性病变占比54.2%。同时发现在短段病变与中长段病变、轻中度钙化与重度钙化病变的12、24个月一期通畅率均无差异。
通过本组临床研究结合既往研究报道笔者对DES有以下治疗经验可供参考:(1)DES植入前需要进行血管准备和预扩张,对于钙化严重病变使用高压球囊或巧克力球囊预扩张进行适当的血管准备,有利于支架的展开于贴合。支架释放后为了支架和血管壁充分贴合,必要时进行后扩,防止贴壁不良可能导致的支架内血栓。(2)参考血管直径(RVD)的选择建议≥ 4.5 mm,目前所能使用的DES支架最小直径为6 mm,虽然适度的超尺寸支架有利于与血管壁充分贴合,发挥抑制内膜增生的效果,但是过大的超尺寸支架会对靶血管产生不利影响,CAPSICUM研究也将参考血管直径(RVD)<4.5 mm列为再狭窄危险因素[25],所以在4.5 mm以上病变管径应用DES支架是相对安全的。(3)应用DES应避免延长到腘动脉P2段。金属支架在跨关节病变处容易发生支架弯折断裂,避免DES远端延伸至P2段,可以降低由此引起的支架内再狭窄的风险。(4)尽量避免内膜下开通,减少其所导致的管径增粗、瘤样变性等血管退行性病变的风险。对于无法避免的内膜下开通,应减少过度的血管准备。
本研究的不足之处在于单中心回顾性分析,临床应用及研究样本量较少,此外研究未纳入覆膜支架、DCB等其他类型治疗方式进行对照,未来需要进一步临床应用和多中心大样本多亚组的研究、验证。
综上所述,笔者认为DES作为一种新型腔内治疗手段,在股腘动脉病变,特别是复杂性病变的治疗中有优异的表现。遗憾的是DES目前仍存在部分缺陷,例如在处理跨关节病变时,关节运动挤压血管弯折扭曲,而造成支架断裂。此外,有研究表明[25]虽然DES可以抑制内膜增生降低再狭窄风险,但是药物技术增加了血栓形成的风险进而导致闭塞性再狭窄,仍需要进一步研究,避免出现血栓性不良事件。

