基于内质网应激应答的胶质瘤风险模型构建
帕拉沙提·斯然 王涛 陈珂 周嘉懿 徐健蓉 李宁宁
1西南科技大学生命科学与工程学院(四川绵阳 621010);2中山大学附属第七医院托马斯·林达尔诺奖科学家实验室(广东深圳 518107)
胶质瘤作为原发性中枢神经系统肿瘤,发病率高[1-3]。现行诊断标准主要依据IDH分型,治疗以手术为主,辅以放化疗,但匮乏靶向药物[4]。在颅外肿瘤中,取得显著疗效的药物受限于对胶质瘤患者响应亚群难以精准识别的问题[5-6]。因此,亟需新型精准诊断判别体系,以辅助锚定高度响应的患者。
在胶质瘤恶性演进过程中,压力刺激可能会诱发内质网应激应答(ERS),重塑细胞表型,并促进浸润性生长[7]。但当ERS超过负荷时,会导致细胞凋亡[8]。这提示,靶向ERS可能成为胶质瘤精准诊疗的一种新思路。因此,本研究的目标是建立基于ERS分级预后风险模型,以精准判别预后和恶性进展表型,为胶质瘤靶向药物的研发提供新方向。
1 材料与方法
1.1 数据集和数据收集从癌症基因组图谱(TCGA)数据库(xena.ucsc.edu)和中国脑胶质瘤基因组图谱(CGGA)数据库(www.cgga.org.cn/index.jsp)中,筛选和选取具有完整临床信息的测序数据(TCGA,n=683;CGGA,n=517)。将TCGA数据(IDHmt:IDHwt=508:175)和CGGA数据(CGGA325:IDHmt:IDHwt=101:175;CGGA693:IDHmt:IDHwt=176:65)分别作为训练集和验证集。通过使用Limma数据包,进行差异基因分析(|logFC|>1.5,P<0.005),并在与HALLMARK_UNFOLDED_PROTEIN_RESPONSE基因集交集中筛选显著差异基因。接下来,运用单基因生存期分析、蛋白互作、Lasso-Cox风险回归分析和Spearman相关性分析,构建一个包含7个ERS相关基因的胶质瘤风险回归模型。最后,通过Kaplan-Meier分析和ROC曲线,明确该模型对于高、低风险与患者生存期差异的相关性与预测准确性。
在表达数据进行Log2和Z-score标准化后,明确7个ERS风险因子表达与经典胶质瘤病理分级、分子分型之间的相关性,并使用Pheatmap包和ggplot2包分别创建相关热图和箱图展示这些相关性。
使用诊断性ROC分析,明确CD44(恶性进展)或GPR158(有利预后)与风险评分的相关性。在整合训练集和验证集的数据,采用ggplot2绘制点图和热图分别展示CD44/GPR158与ERS风险因子表达的相关性。
1.2 mRNA和蛋白质表达验证实验胶质瘤临床样本20例(IDHwt:IDHmt=10:10)取自中山大学附属第七医院和中山大学肿瘤防治中心,标本通过病理学评估,并附有详细的临床病理资料。所有患者均签署知情同意书,本课题由中山大学附属第七医院伦理研究委员会批准(编号:KY-2021-065-01)。
胶质瘤临床标本(IDHwt:IDHmt=5:5),进行实时荧光定量分析。检测基因的引物序列见表1。同时,另外10例患者(IDHwt:IDHmt=5:5)标本被制作成石蜡切片,并通过免疫组化方法检测HSP90B1(Cell Signaling Technology,4874)、HSP5A(Cell Signaling Technology,3177)和CD44(Cell Signaling Technology,37295)的表达情况。实验采用DAB染色,阳性结果显色为黄褐色。

表1 引物序列Tab.1 Primer sequences
1.3 统计学方法在本研究中,R语言和Graph Pad Prism 9.4.1作为统计分析工具。按中位风险评分分类后,使用χ2检验确定样本间的临床特征差异。t检验被用于进行组间比较。此外,Pearson相关分析用来评估相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 利用显著高表达的7个ERS相关基因构建胶质瘤分级预后风险模型首先,根据IDH基因型并利用TCGA转录组数据进行差异表达分析(|LogFC|>1.5,P<0.05),并与Hallmark_Unfolded_Protein_Response(UPR)基因集进行交集分析,筛选出在IDHmt型胶质瘤中显著表达的41个UPR/ERS基因以及在IDHwt型胶质瘤样本中显著高表达的50个UPR/ERS基因(图1A)。接着,通过单变量Cox风险回归分析,发现有33个UPR/ERS基因与胶质瘤不良预后之间存在显著相关性(图1B)。最后,通过Lasso + Cox生存分析方法(图1C和D)筛选出7个关键基因,用以构建ERS分级预后风险模型。风险系数计算公式为:风险系数=(0.128 4 *KDELR3)+(0.529 5 * SHC1)+(0.004 3 * DNAJC3)+(0.890 3 * PDIA6)+(-0.119 9 * CALR)+(0.496 4 *HSP90B1)+(-0.752 1 * HSPA5)(图1C-D)。

图1 构建基于7个UPR基因的Cox风险模型以预测胶质瘤的预后Fig.1 Characterization of 7 ERS risk signature genes to predict the prognosis of glioma
2.2 ERS模型风险评分与胶质瘤患者预后的关联分析及预测准确性评估Kaplan-Meier分析显示,高风险组(高于中位风险分数)的患者预后明显不如低风险组患者(图2A-B)。时间依赖性ROC曲线评估显示,在1年时,预后的预测准确性超过0.7(TCGA:0.74;CGGA:0.82),在3年时超过0.76(TCGA:0.77;CGGA:0.80),在5年时超过0.62(TCGA:0.63;CGGA:0.75)(图2C-D)。这些结果表明,与ERS相关的风险因子在预测神经胶质瘤患者的预后方面表现出较高的准确性。

图2 评估ERS相关风险因子预测预后的能力Fig.2 Assessment of the prognostic prediction ability of the ERS-related risk signature
2.3 ERS相关风险因子与胶质瘤经典分子分型和病理级别的关联性分析ERS相关风险因子是否与神经胶质瘤患者的临床病理分级存在关联?针对训练集(TCGA)和验证集(CGGA)的数据分析显示,以IDH基因型分组,这7个ERS风险基因在IDHwt组中呈现显著高表达(图3A-B)。进一步,在根据WHO病理分级进行的分组中,与Grade 2相比,这7个ERS相关风险因子在Grade 3胶质瘤中均呈现显著高表达(图3C-D)。通过上述分析结果的验证,ERS相关风险因子能够有效区分不同胶质瘤患者的经典分子分型和病理分级特征。

图3 ERS相关风险因子在胶质瘤患者中根据WHO分级划分的诊断价值Fig.3 Diagnostic values of ERS risk signature genes in glioma patients based on WHO grade classification.
2.4 ERS相关风险因子与胶质瘤恶性进展表型的关联性分析在胶质瘤恶性进展过程中,CD44在促进细胞间质亚型转化方面发挥着重要作用,并与胶质瘤的病理分级和预后密切相关[9-12]。Pearson相关性分析显示,CD44与ERS风险评分显著正相关(图4A)。此外,箱图显示,在ERS高风险组中CD44表达显著升高(图4B)。进一步分析显示,在将患者根据CD44表达的中位数分为高表达组和低表达组后,ERS相关风险因子在CD44低表达的患者中也呈现低表达(图4C和D)。
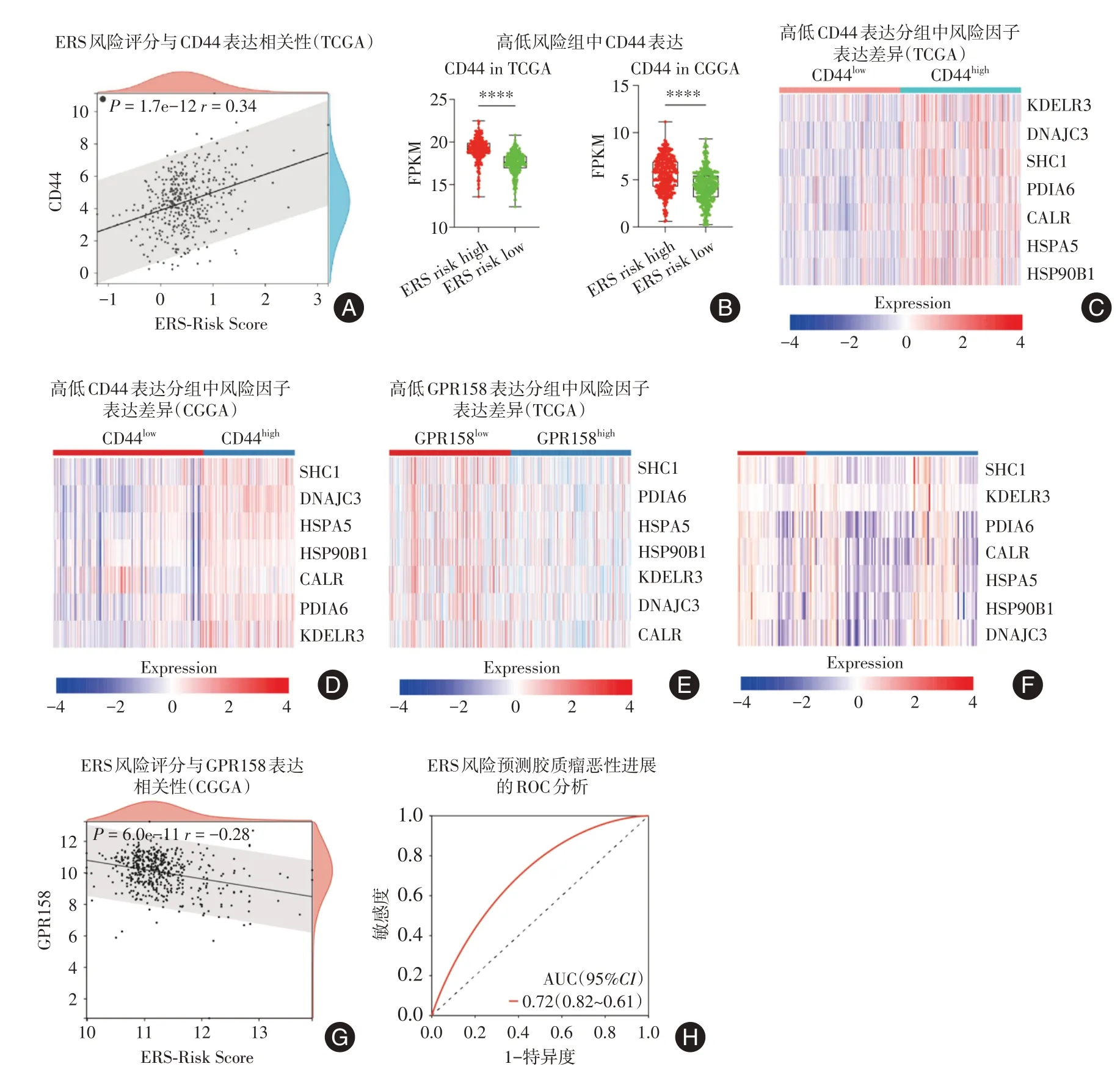
图4 ERS相关风险因子与胶质瘤恶性进展表型的关系Fig.4 The correlation between ERS-related risk signatures and malignant phenotypes of glioma.
G蛋白偶联受体GPR158的表达随胶质瘤级别升高而逐级显著降低,可作为分级预后标志物;此外,GPR158的高表达能够有效抑制胶质瘤的恶性进展[13-14]。为进一步验证ERS风险模型对胶质瘤级别和恶性进展表型评估的独立性,研究根据GPR158的表达中位数将TCGA和CGGA数据库数据分为高表达组和低表达组,然后比较这两组中ERS风险因子的表达趋势。热图分析显示,在GPR158低表达组中,ERS高风险因子的表达水平显著增加(图4E-F)。此外,Pearson相关性分析结果提示GPR158与ERS风险评分之间呈显著负相关(图4G)。最后,诊断性ROC曲线显示,ERS风险评分预测胶质瘤恶性进展表型的准确性超过0.7(图4H)。综上所述,这些研究结果强调了ERS风险因子在准确预测胶质瘤恶性进展表型方面的重要能力。
2.5 ERS风险因子在不同IDH基因型临床胶质瘤样本中的表达差异分析经临床样本的qRT-PCR分析显示,在IDHwt胶质瘤样本中,7个ERS相关风险因子的表达显著高于IDHmt样本(IDHwt∶IDHmt=10 ∶ 10),差异均有统计学意义(P<0.05)(图5A)。鉴于DNAJC3、CALR、PDIA6、SHC1和KDELR3缺乏适用于免疫组化级别的抗体,因此选取ERS风险因子(HSP90B1和HSPA5)与恶性表型标志物(CD44)一同作为免疫组化实验的指标(图5B)。免疫组化结果表明,在IDHwt胶质瘤样本中,风险因子HSP90B1和HSPA5以及CD44的表达明显高于IDHmt胶质瘤样本(IDHwt∶IDHmt=5∶5),差异均有统计学意义(P<0.05)(图 5C)。
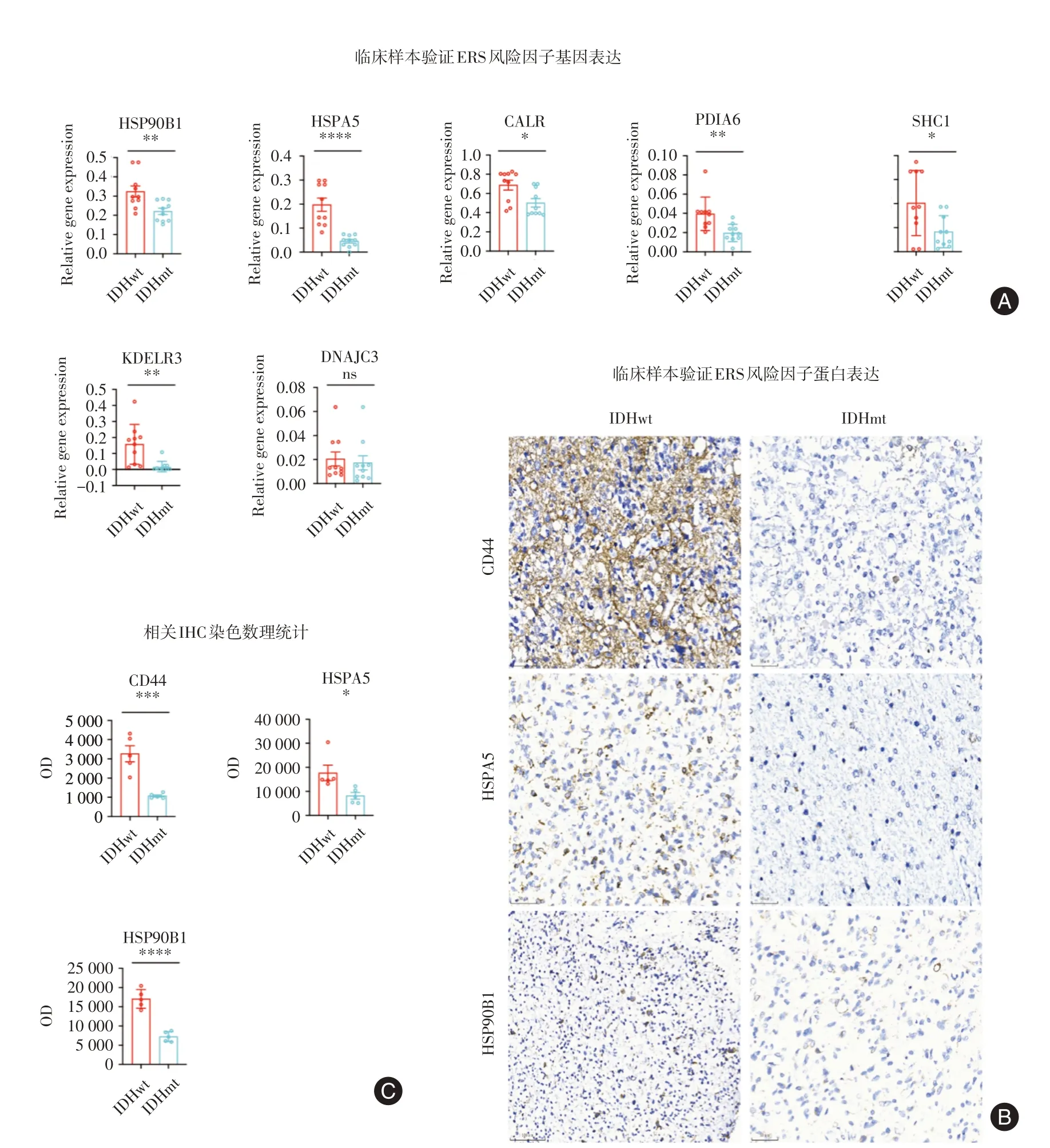
图5 ERS相关风险因子因子在不同IDH基因型临床胶质瘤样本中的表达比较Fig.5 Comparison of the expression of UPR risk signature factors in clinical glioma samples with different IDH genotypes
3 讨论
本研究基于美中两国公共胶质瘤数据库(TCGA和CGGA)的RNA-seq数据,成功筛选出7个ERS相关风险基因,并建立了一个具备病理分级和预后预测功能的风险回归模型。该模型在预测胶质瘤患者的短期生存期(1年和3年)方面表现出较高的准确性(AUC>0.74)。此外,通过生物信息学分析和临床样本验证,发现ERS高风险组与胶质瘤恶性进程标志物CD44呈显著正相关,而与代表有利预后的前神经元标志物GPR158之间呈显著负相关。这些发现提示,该模型能够较为准确地指征胶质瘤的恶性进展表型。
目前,现行的临床诊断体系分类器在与胶质瘤靶向药物相匹配方面存在挑战,例如,尽管IDH突变抑制剂在急性髓细胞性白血病的靶向治疗中取得显著疗效[15],但在胶质瘤治疗方面仍处于临床试验阶段[16-18]。这可能是由于IDHmt以及代谢产物D2HG对胶质瘤细胞的表观遗传调控以及代谢重编程产生重要影响,使得精确的靶向治疗变得困难[19]。同样,针对胶质瘤的治疗尝试了多种与现行临床诊断分类系统相对独立的靶向策略[20-23]和免疫疗法[24-25]。然而,由于缺乏适应于临床诊断分类的准确分类器,上述努力均难以确定高度响应的患者亚群。这也成为当前胶质瘤靶向治疗和未来特异性靶向药物开发所面临的重要限制因素。
在新版的《Hallmarks of Cancer:New Dimensions》一文中,表型可塑性被提升为肿瘤标志性事件之一,强调了深入探索和验证其机制的重要性[26],也提示未来在研究肿瘤的发生、发展、复发以及耐药时,需要从基因型和细胞表型的综合角度进行考虑。当肿瘤细胞受到内部或微环境压力刺激时,会触发ERS,从而改变转录、翻译和表观修饰水平,重新塑造肿瘤细胞表型,以适应潜在的致死性压力,增强其浸润性生长能力[7]。因此,推测ERS或是调控肿瘤表型可塑性的重要源头途径。有学者[27-28]证实ERS可以驱动结直肠癌细胞表型可塑性;同时,WANG等[29]发现IDH突变介导的ERS调控胶质瘤微环境中肿瘤相关小胶质细胞极性可塑性。这些研究提示,ERS信号通路元件可能是调控胶质瘤实质及其微环境表型可塑性的关键组分。因此,在本研究中,构建了一个ERS风险回归模型,并通过生物信息学分析和临床样本验证,发现该模型高风险组与恶性进展表型标志物如CD44呈显著正相关,与良好预后标志物GPR158呈显著负相关。这些结果提示,ERS风险特征能准确预测胶质瘤恶性进展表型,为未来临床靶向治疗提供新的方向。
ERS是肿瘤细胞应对外界和内在压力的重要调控通路,对肿瘤生长、存活、分化和蛋白质稳态提供关键保障[16-18]。然而,它是一个双刃剑,压力过度亦会导致肿瘤细胞凋亡。多项研究表明,IDHmt提高胶质瘤细胞对于ERS的敏感性,激活PERK/ATF4信号轴,从而抑制肿瘤的增殖和侵袭能力,促进凋亡[8,30-31]。例如,JOHNSON等[32]发现ERS诱导剂毒胡萝卜素(Thapsigargin)可以促进胶质瘤细胞凋亡。Hallahan团队也报道ERS增强GBM对于放疗敏感性[33]。近期,WANG等[29]发现激活胶质瘤细胞PERK通路推动肿瘤相关小胶质瘤细胞抗癌极化激活。基于这种机制,针对ERS进行靶向治疗可能成为一种新的方法,通过杀伤胶质瘤细胞来抑制肿瘤的恶性进程,为开发全新的药物靶向策略提供了潜在的方向。
综上所述,本研究建立了一套新型的脑胶质瘤(除GBM外)分级预后体系,不仅能够准确识别胶质瘤恶性进展表型,还能有效地桥接现行脑胶质瘤临床分子诊断体系与靶向治疗所涉及的内在分子机制。前期报道指出IDHwt和IDHmt这两类胶质瘤本质上属于内质网应激耐受和敏感型肿瘤,基于这一发现,本研究中合理猜测:未来设计和开发与ERS相关的靶向药物可能会从这个新型风险模型中受益,从而弥补IDH分子分型无法精准锁定响应患者亚群的不足。此外,还认为:围绕分子靶点或信号通路开展的靶向药物设计或可借鉴本研究的模型方法,即构建临床诊断体系与待开发靶向机制的融合模型,从而更为有效地提高靶向药物的适配度。

