四氢生物蝶呤对胰腺癌细胞增殖、迁移及凋亡的影响
马文婷,张晨,谢青
1.新乡医学院三全学院临床学院,河南 新乡 453003; 2.新乡医学院三全学院,河南 新乡 453003
胰腺癌是一种发病隐匿、恶性程度极高的消化系统肿瘤,是癌症相关死亡的第4 大因素,且患者死亡率以每年1%的速度上升,患者总体的5 年生存率为10%,晚期患者5 年生存率不足3%[1]。由于胰腺癌起病隐匿、早诊困难,大多患者就诊时已是晚期而失去手术机会,主要靠药物治疗。目前胰腺癌治疗的一线用药是吉西他滨,然而其单独用药的缓解率不足10%,吉西他滨与其他药物组成的二联疗法或5-氟尿嘧啶+奥沙利铂+伊立替康+亚叶酸钙(FOLFIRINOX)四联化疗药物疗效稍有改善但副反应也大大增加[2,3],其有限的疗效与难以避免的毒副反应促使研究者寻找新的药物以提高治疗效果,改善患者预后。四氢生物蝶呤(tetrahydrobiopterin,BH4)属于芳香族氨基酸羟化酶的辅酶,是一氧化氮合成的辅因子,参与NO合成等许多生理过程,也参与炎症、心血管疾病等病理过程[4~6]。墨蝶呤(sepiapterin)为四氢生物蝶呤的前体,其可通过促进NO 产生而促进乳腺癌细胞凋亡,抑制乳腺癌细胞增殖,抑制肿瘤生长[7,8],墨蝶呤通过下调p70s6k依赖的血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)表达来抑制卵巢癌细胞的增殖和迁移[9]。BH4 处理黑色素瘤细胞使NO 浓度升高,可降低肿瘤细胞活力、细胞增殖能力和肿瘤细胞形成黑色素瘤球形体的能力[10],然而,BH4 在人胰腺癌细胞(human pancreatic cancer cells,HPAC)中的作用及可能机制尚未见报道。本文初步研究BH4 对HPAC 与人原位胰腺腺癌细胞(biopsy xenograft of pancreatic carcinoma line-3,BxPC-3)增殖、凋亡和迁移等生物学特性的影响,为胰腺癌的临床治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞培养 HPAC 细胞株,BxPC-3 细胞株购自中国典型培养物保藏中心细胞库。培养液分别为DMEM 与RPMI-1640(含10% FBS,100 U/L 青霉素及100 μg/mL 链霉素),37 ℃、5% CO2恒温培养箱,每2~3 d 传代1 次,对数生长期的细胞用于实验。
1.1.2 主要试剂 四氢生物蝶呤(tetrahydrobiopterin)购自上海芮晖化工科技有限公司,RPMI-1640 培养基,DMEM 高糖培养基,胎牛血清(Fetal Bovine Serum,FBS)购自美国Hyclone 公司,CCK-8 细胞增殖及细胞毒性检测试剂盒,细胞凋亡-Hoechst 染色试剂盒购自上海碧云天生物技术有限公司,E-cadherin 抗体,N-cadherin 抗体,GAPDH 抗体购自武汉三鹰生物科技有限公司。
1.2 实验方法
1.2.1 CCK-8 检测 对数生长期的HPAC 与BxPC-3接种于96 孔中培养12 h,细胞分为对照组与实验组,对照组正常培养,实验组分别加入终浓度为2、4、8、12 µmol/L 的BH4 培养24 h,每孔加入100 μL CCK-8,37 ℃培养2 h 后,酶标仪450 nm 处测OD。
1.2.2 Hoechst 染色 分别将对数生长期的HPAC 与BxPC-3 接种于6 孔板中(内含无菌盖玻片)培养12 h,对照组正常培养,实验组分别加入终浓度为2、4、8、12 µmol/L 的BH4 培 养24 h,按 照 使 用 说 明 书 进 行Hoechst 染色,封片,显微镜下选择视野,观察染色结果并拍照,每组设置5 个副孔,计算凋亡指数,凋亡指数=凋亡细胞数/细胞总数×100%。
1.2.3 划痕实验 分别将对数生长期的HPAC 与BxPC-3 接 种 于6 孔 板 中,培 养12 h 后 用1 mL 无 菌 蓝色吸头在孔的中间划痕,尽量保证划痕的宽度一致,弃去培养液,每孔加入1 mL 无血清培养液以洗去悬浮的细胞,培养24 h 镜下观察细胞愈合面积,利用Image J 软件测量愈合面积。
1.2.4 RT-qPCR 检测 提取对照组与实验组细胞的总RNA,Trizol Reagent 裂解细胞利用三氯甲烷,异丙醇及75%乙醇提取RNA,无RNA 酶水溶解RNA,检测RNA 浓度及纯度(OD 260/280 应为1.9~2.1),将提取的RNA 逆转录为cDNA,以cDNA 为模板,应用qRT-PCR 检测试剂盒进行PCR 扩增反应,最后以2-ΔΔCt法对获取的相应数据实施相对定量分析。PCR 反应按照说明书采用两步法进行,反应条件:94 ℃30 s;94 ℃5 s;56 ℃15 s;72 ℃10 s,设置40 个循环。Notch1 引物序列正向:5'-CAATGTGGATGCC GCAGTTGTG-3',反向:5'-CAGCACCTTGGCGGTCT CGTA-3',内参引物正向:5'-GGCACCACACCTTCTA CAAT-3',反向:5'-GTGGTGGTGAAGCTGTAGCC-3'。
1.2.5 Western blotting 检测 培养24 h 的对照组与实验组细胞(12 µM BH4 培养),弃去培养液,每皿加入500 μL RIPA 裂解液裂解细胞,提取总蛋白。常规SDS-PAGE 电泳、转膜,5%脱脂奶粉室温封闭1 h,ECadherin 抗 体(1:500),N-cadherin 抗 体(1:500)及GAPDH 抗体(1:10000)4 ℃孵育过夜,荧光二抗室温孵育2 h 后,ECL 显影、曝光,Image J 软件分析灰度。
1.3 统计学分析
利用SPSS19.0 软件进行数据分析,计量资料以均数±标准差()表示,两组之间比较利用t检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 BH4 对HPAC 及BxPC-3 细胞活力影响
CCK-8 测定不同浓度的BH4 对胰腺癌细胞HPAC 和BxPC-3 细胞活力的影响,结果如表1 所示,随着BH4 浓度的增加,细胞的活力逐渐降低,与对照组相比,8 μmol/L 和12 μmol/L 的BH4 处理的HPAC细胞活力下降明显,具有统计学意义(P<0.05,P<0.05);8 μmol/L 和12 μmol/L 的BH4 处理的BxPC-3 细胞活力下降明显,具有统计学意义(P<0.01,P<0.05)。提示BH4 可降低胰腺癌细胞的活力。
表1 BH4 对HPAC 和BxPC-3 细胞活力的影响(OD)Tab.1 The effect of BH4 on the viability of HPAC cells and BxPC-3 cells (OD, )
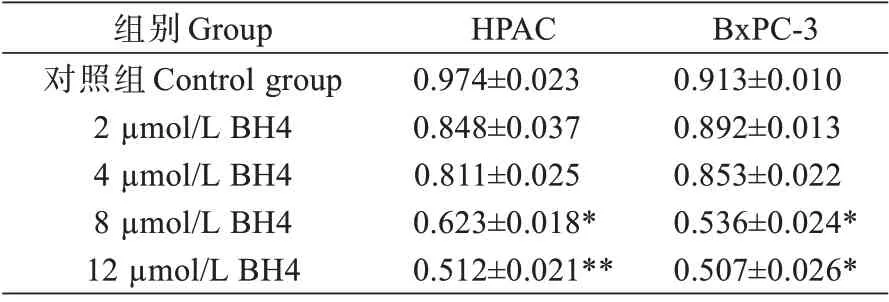
表1 BH4 对HPAC 和BxPC-3 细胞活力的影响(OD)Tab.1 The effect of BH4 on the viability of HPAC cells and BxPC-3 cells (OD, )
注:*P<0.05,**P<0.01,与对照组比较Note:*P<0.05, **P<0.01, vs control group
BxPC-3 0.913±0.010 0.892±0.013 0.853±0.022 0.536±0.024*0.507±0.026*组别Group对照组Control group 2 µmol/L BH4 4 µmol/L BH4 8 µmol/L BH4 12 µmol/L BH4 HPAC 0.974±0.023 0.848±0.037 0.811±0.025 0.623±0.018*0.512±0.021**
2.2 BH4 对HPAC 和BxPC-3 细胞凋亡影响
Hoechst 法检测不同浓度的BH4 对胰腺癌细胞HPAC 和BxPC-3 细胞凋亡的影响,结果如图1、表2 所示,随着BH4 浓度的增加,细胞的凋亡率逐渐增加,与对照组相比,8 μmol/L 和12 μmol/L 的BH4 处理的HPAC 细胞凋亡率显著升高(P<0.05,P<0.05);8 μmol/L 和12 μmol/L 的BH4 处 理 的BxPC-3 细 胞 凋 亡 率 显著升高(P<0.05,P<0.01)。提示BH4 可促进胰腺癌细胞凋亡。
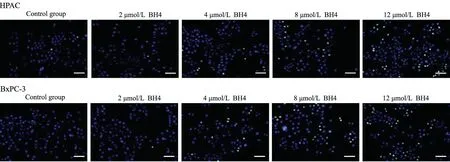
图1 BH4 对HPAC 和BxPC-3 细胞凋亡影响Bar=50 μmFig.1 The effect of BH4 on the apoptosis of HPAC cells and BxPC-3 cells (Bar=50 μm)
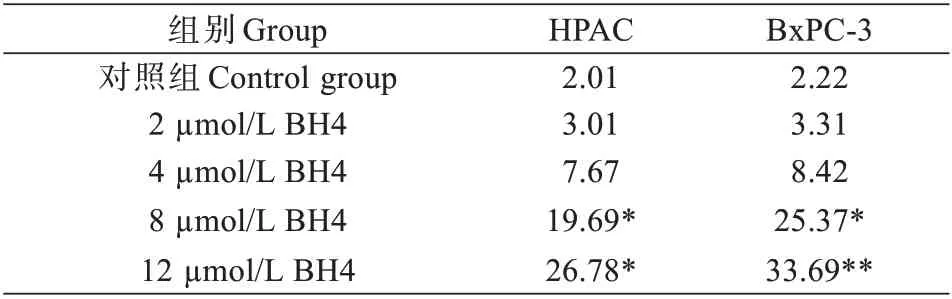
表2 BH4 对HPAC 和BxPC-3 细胞凋亡影响(%)Tab.2 The effect of BH4 on apoptosis of HPAC cells and BxPC-3 cells (%)
2.3 BH4 对HPAC 及BxPC-3 细胞迁移能力影响
利用划痕实验检测BH4 对胰腺癌细胞HPAC 和BxPC-3 细胞迁移的影响,结果如图2,表3 显示,与对照组细胞的愈合面积(55.46%)相比较,8 μmol/L 与12 μmol/L 的BH4 处理的HPAC 愈合面积下降明显(P<0.05,P<0.01);与对照组细胞的愈合面积(50.75%)相比较,8 μmol/L 与12 μmol/L 的BH4 处理的BxPC-3愈合面积下降明显(P<0.05,P<0.05)。提示BH4 可降低胰腺癌细胞的迁移能力。

图2 BH4 对HPAC 和BxPC-3 细胞迁移影响Bar=50 μmFig.2 The effect of BH4 on migration ability of HPAC cells and BxPC-3 cells (Bar=50 μm)

表3 BH4 对HPAC 和BxPC-3 细胞迁移影响(%)Tab.3 The effect of BH4 on migration ability of HPAC cells and BxPC-3 cells (%)
2.4 BH4 对Notch1 mRNA 表 达 影 响
检测细胞活性,发现随着BH4 浓度的增加,细胞活性逐渐降低,在8 µmol/L 与12 µmol/L 细胞活性显著降低,利用RT-qPCR 检测12 μmol/L BH4 对胰腺癌细胞HPAC 和BxPC-3 中Notch1 mRNA 的影响,结果如图3 所示,与对照组相比较,12 μmol/L BH4 诱导24 h,细胞中Notch1 mRNA 的表达均显著降低,具有统计学意义(P<0.05)。

图3 BH4 对HPAC 与BxPC-3 细 胞 中Notch1 mRNA 表达影响 注:*P<0.05,与对照组比较Fig.3 The effect of BH4 on Notch1 mRNA expression in HPAC cells and BxPC-3 cells Note: *P<0.05, vs control group
2.5 BH4 对E-cadherin 与N-cadherin 蛋白表达影响
利用Western blotting 检测BH4 对胰腺癌细胞HPAC 和BxPC-3 细 胞 中E-cadherin 与N-cadherin 蛋 白表达的影响,结果如图4,表4 所示,与对照组相比较,12 μmol/L 的BH4 处 理 的HPAC 和BxPC-3 细 胞 中Ecadherin 蛋白的相对表达量均升高(P<0.05,P<0.01),而N-cadherin 蛋白的相对表达量均降低(P<0.05,P<0.05)。提示BH4 可抑制胰腺癌细胞上皮间质转化,降低胰腺癌细胞的恶性表型。

图4 BH4 对HPAC 与BxPC-3 细 胞 中E-cadherin 与N-cadherin 表 达 影 响Fig.4 The effect of BH4 on the expression of E-cadherin and N-cadherin in HPAC and BxPC-3 cells

表4 BH4 对HPAC 与BxPC-3 细 胞 中E-cadherin 与N-cadherin 表 达 影 响Tab.4 The effect of BH4 on the expression of E-cadherin and N-cadherin in HPAC and BxPC-3 cells
3 讨论
胰腺癌的生存率是所有实体肿瘤中最差的,近40 年来胰腺癌5 年生存率仅从3%上升至10%,生存率如此低的原因主要包括其恶性程度高、起病隐匿、无典型症状、切除率低、复发率高、现有治疗方法不足等[2,11]。研究者进行了大量的研究,胰腺癌仍然是一种致命的疾病,只有少数患者有机会进行手术切除,获得较好的治疗效果。
传统的吉西他滨或5-氟尿嘧啶(5FU)化疗只有0~10%的缓解率,尽管吉西他滨加白蛋白-紫杉醇或吉西他滨联合放疗或FOLFIRNOX 四联疗法在临床得以应用[12],患者的生存率并没有得到较大的提高,且其毒副作用较大,患者的预后没有较大改善。因此,寻找新的药物期能提高治疗效果,改善患者预后,具有极其重要的意义。
BH4 是一氧化氮合酶(包括内皮型一氧化氮合酶eNOS,神经元型一氧化氮合酶nNOS,诱导型一氧化氮合酶iNOS)的辅助因子,生理状态下,充足的BH4参与NO 合成,当其利用度不足时,可引起一系列的病理变化。
近年研究显示,BH4 及BH4 的前体墨蝶呤在肿瘤的生长中发挥重要作用。补充墨蝶呤可使精氨酸代谢正常,促进NO 合成,提高乳腺肿瘤免疫原性,抑制乳腺肿瘤细胞生长[8]。墨蝶呤通过下调p70s6k依赖的VEGFR-2 表达抑制卵巢癌细胞的增殖和迁移[9]。补充外源性BH4 可显著提高肝癌细胞内BH4 水平,抑制细胞活力,降低Ki-67 表达,促进细胞凋亡[13]。外源性BH4 处理黑色素瘤细胞可使细胞内NO 浓度升高,超氧负离子水平降低,进而降低细胞活力与增殖能力,增强黑素瘤细胞对凋亡的敏感性,降低黑色素瘤细胞形成黑色素瘤球形体的能力[10]。提高BH4 水平可以增强免疫,抑制肿瘤生长[14]。然而,BH4 对胰腺癌细胞的作用尚未见报道。
本研究选取2 种胰腺癌细胞株,检测BH4 对其作用,CCK-8 结果显示,随着BH4 浓度增加,癌细胞的活力逐渐降低;Hoechst 染色结果显示,随着BH4 浓度增加,癌细胞的凋亡数目逐渐增多,凋亡率提高;划痕实验结果显示,BH4 可降低两种癌细胞的愈合面积;上皮细胞间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程,在肿瘤的发生和侵袭转移中起关键作用。E-cadherin 为上皮组织的标记物,N-cadherin 为间叶组织的标记物,E-cadherin 表达下调,N-cadherin 表达上调与肿瘤的发生与转移密切相关[15~17]。本 研 究 中Western blotting 结 果 显 示,BH4 可促进癌细胞中E-cadherin 表达,抑制N-cadherin 表达,提示BH4 可抑制胰腺癌细胞上皮间质转化,降低癌细胞的恶性表型,从而降低癌细胞迁移侵袭的能力。Notch 受体家族(Notch 1~4)在细胞的增殖,分化,凋亡和干细胞维护等活动中发挥重要作用[18],Notch 受体已被证实是几种类型癌症的致癌基因,Notch1 在胰腺癌组织表达升高,参与胰腺癌的进展[19~21]。本研究中RT-qPCR 结果显示,使用12 µM BH4 诱导24 h,可显著降低细胞中Notch1 mRNA 的表达,这就提示BH4可能通过调节Notch1信号通路的激活而发挥作用。
综上所述,本文首次探讨BH4 对胰腺癌细胞的影响,BH4 可抑制胰腺癌细胞增殖活力和细胞迁移的能力,促进细胞凋亡,抑制癌细胞上皮间质转化,从而降低癌细胞的恶性表型,这些作用可能是通过抑制Notch1 信号通路激活而发挥,其作用机制需要进一步研究。