新型冠状病毒相关儿童急性坏死性脑病2例
李婕,章瑜,严志汉
1.温州医科大学附属第二医院育英儿童医院 放射科,浙江 温州 325027;2.宁波市妇女儿童医院 放射科,浙江 宁波 315012
新型冠状病毒(SARS-CoV-2)主要侵犯呼吸系统,随着临床数据积累,中枢神经系统受累的报道逐渐增多[1],在儿童和成人中类似。研究[2]发现,大部分感染SARS-CoV-2的儿童神经系统症状较轻,主要表现为头痛、头晕、嗅觉和味觉异常等。然而,也有一部分患儿出现了癫痫、昏迷和脑膜炎甚至坏死性脑病等严重神经系统症状[3]。其中急性坏死性脑病(acute necrotizing encephalopathy, ANE)是一种继发于系统性病毒感染的罕见并发症,目前国内外有关儿童感染SARS-CoV-2后并发ANE的报道甚少[1,3],但一旦发生往往病情进展非常迅速,预后差,大多数患儿可伴有不同程度的神经系统后遗症,甚至死亡,目前尚无针对ANE的特异性治疗方法[4]。本文报告2例SARS-CoV-2相关儿童ANE,以丰富本病临床数据,为早期诊断ANE和其治疗提供参考。
1 病例资料
病例1,患者,女,13岁,因发热、呕吐1 d后出现神志不清在乐清市第三人民医院就诊后病情进展,伴四肢强直抽动,随即转入温州医科大学附属第二医院育英儿童医院。入院查体:体温37.5 ℃,格拉斯哥评分7分,瞳孔对光反射迟钝,咽部查体不配合,颈软,巴氏征(+),四肢肌力下降,克氏征(-),布氏征(-)。辅助检查:白细胞计数(white blood cell count, WBC)23.83×109/L,中性粒细胞计数(neutrophil count, NEUT)% 91.1%,IL-6 5.60×10-8mg/mL,IL-10 1.54×10-8mg/mL,CRP 20.13 mg/L,均明显升高。谷草转氨酶(aspertate aminotransferase, AST)186 IU/L,肌酸激酶 (creatine kinase, CK)232 IU/L,乳酸脱氢酶(lactic dehydrogenase, LDH)607 IU/L,心肌肌钙蛋白I(cardiac troponin, cTn I)1.96× 10-7mg/mL,氨基端前脑钠素(N-terminal probrain natriuretic peptide, NT-proBNP)1.94× 10-7mg/mL,降钙素原(procalcitonin, PCT)4.38×10-5mg/mL,风疹病毒IgG抗体192.00 IU/mL, 巨细胞病毒IgG抗体>500.00 IU/mL,单纯疱疹病毒1 型IgG抗体9.57 COI。脑脊液蛋白水平升高。头颅MRI平扫显示脑内多发异常信号(图1):主要为两侧额顶颞叶、半卵圆中心、侧脑室旁、基底节区、丘脑、脑干及小脑,临床符合ANE诊断。诊治经过:患儿住院后给予大剂量甲泼尼龙冲击治疗后减量维持抗炎,大剂量丙球封闭抗体,血浆置换3次,辅以降颅压、抗感染、保肝护胃、静脉营养等支持治疗。激素冲击治疗第14天时患儿神志稍好转,至第21天时患儿情绪稍稳定,逐渐好转,住院1个月余后出院。出院1个月后遗留四肢活动不利、智力下降等,至我院康复科进行康复治疗,诊断为“ANE恢复期、不完全性瘫痪、边缘智力可能”。予运动疗法、有氧训练、经颅磁治疗等康复治疗后,记忆力较前稍有好转,肢体力量有所改善。出院3个月后肢体活动基本自如,记忆力较前明显改善。
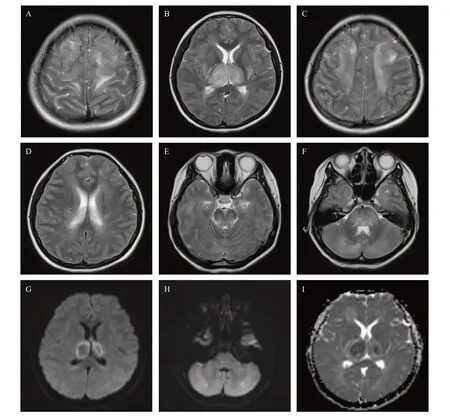
图1 病例1:13岁女性患者头颅T2WI、DWI及ADC序列上的表现
病例2,患者,女,2岁,因发热1 d后出现惊厥于温州滨海医院就诊后精神差转至温州医科大学附属第二医院育英儿童医院就诊。入院查体:体温38.0 ℃,颈软,肌力5级,肌张力正常,脑膜刺激征(-),双侧巴氏征(-)。辅助检查:WBC 46.33× 109/L,NEUT% 76.1%、CRP 16.40 mg/L,明显升高。AST 98 IU/L、LDH 324 IU/L,NT-proBNP 2.65× 10-7mg/mL,PCT 1.4×10-7mg/mL,风疹病毒IgG抗体90.50 IU/mL,D-D二聚体1.59×10-3mg/mL;脑脊液检查:氯118.0 mmol/L,余阴性。头颅MRI平扫检查显示脑内多发异常信号(图2):主要为双侧额顶枕叶、胼胝体、左侧基底节区、双侧丘脑及脑干,临床符合ANE诊断。诊治经过:患儿入院后给予甲泼尼龙冲击治疗后减量维持抗炎,同时予大剂量静脉丙球封闭抗体,期间抗感染、保肝护胃、心肌营养等支持治疗同时进行。至激素冲击治疗第3天时患儿能自发睁眼,刺激下能哭,至第9天时神志好转,住院半月余后出院。出院时遗留语言表达欠佳、肢体无力、站立不稳等障碍,出院1周后肢体乏力有所改善,出院1个月复查脑电图显示正常,肢体活动基本自如。
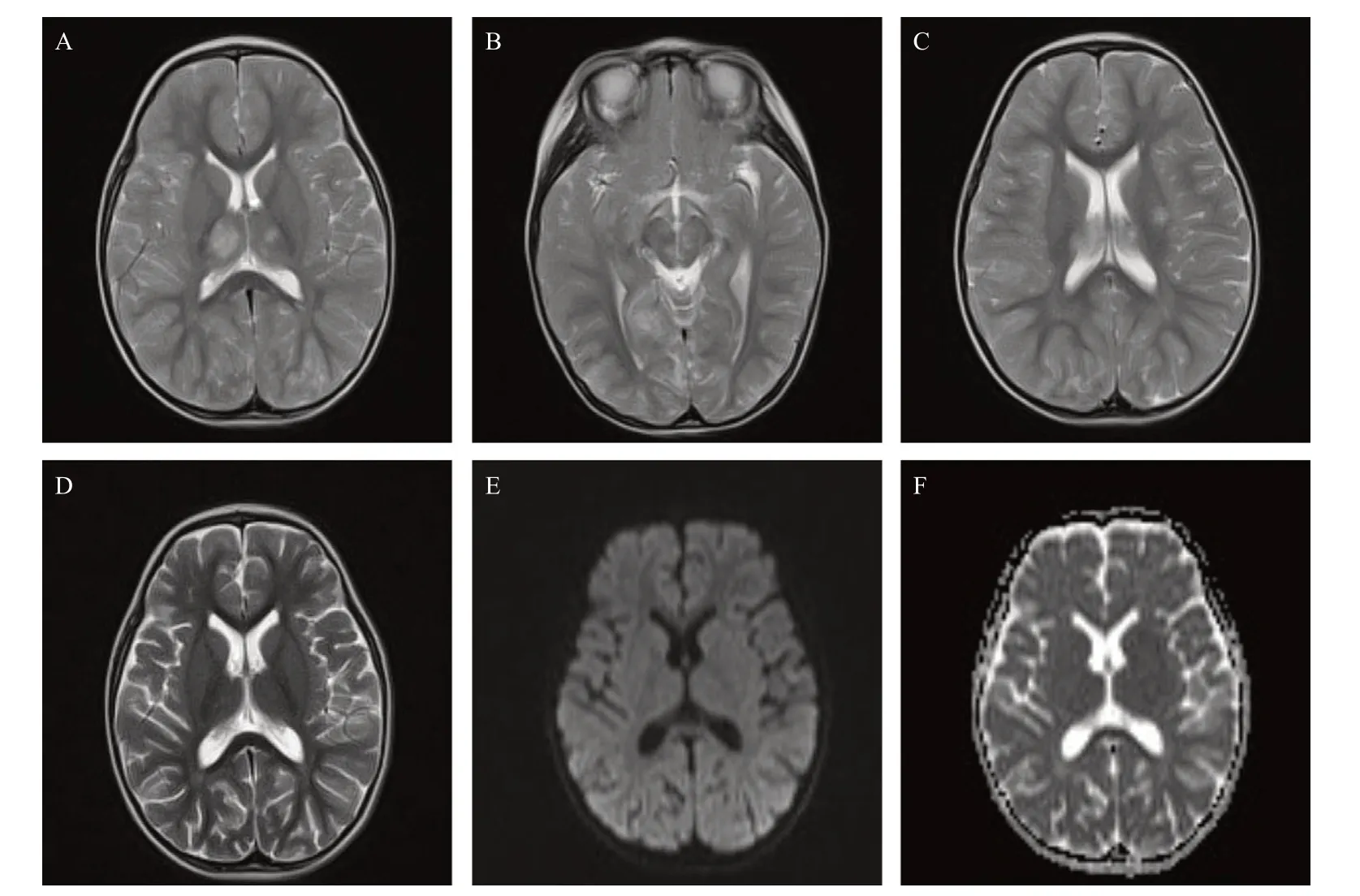
图2 病例2:2岁女性患者治疗前后头颅MRI对比
2 讨论
本文以2022 年12 月至2023 年1月温州医科大学附属第二医院育英儿童医院收治的2例感染SARSCoV-2的ANE患儿为研究对象。2例患儿SARS-CoV-2核酸检测均为阳性且均行1.5T MRI或CT头颅平扫检查。纳入的诊断标准采用MIZUGUCHI等[5]提出,由NEILSON等[6-7]补充的诊断标准:①病毒所致发热性疾病1~3 d后快速出现意识障碍或惊厥等急性脑病症状。②家族中有相似神经系统感染症状者。③复发性脑病伴发热者。④头颅影像学检查(CT或MRI)提示对称性、多发性病灶,必需部位是双侧丘脑;支持部位包括侧脑室周围白质、内囊、壳核、脑干、小脑。⑤脑脊液中无细胞数升高,蛋白水平升高常见。⑥血清转氨酶不同程度升高,血氨正常。⑦排除其他疾病,如脑内感染性、代谢性、中毒性、线粒体病、自身免疫性疾病。
在过去的3 年,新型冠状病毒肺炎(corona virus disease 2019, COVID-19)在全球范围内大流行,除了显著的呼吸道表现外,还可能导致各种神经系统并发症,包括头痛、味觉和嗅觉改变、脑病、脑血管疾病、肌病、精神疾病和眼部疾病等[8],成人和儿童类似。由SARS-CoV-2感染引起的儿童ANE作为其中一种罕见的脑病,目前仅有国外少数病例报道。
ANE是一种急性爆发性重症脑病,病程进展迅速,预后差。临床上以高热、惊厥、意识障碍(迅速进展至昏迷)和多器官功能衰竭为主要表现。ANE主要继发于病毒感染,常见的包括甲型流感、乙型流感、H1N1流感、人类疱疹病毒、水痘、轮状病毒、风疹病毒等,以流感病毒和人类疱疹病毒6为主[9]。本研究依据诊断标准确诊的2 例ANE患儿与常见的病毒感染引起的ANE类似,均为前驱感染后出现高热,并迅速出现意识障碍或惊厥等急性脑病症状。2例患儿血液学检查均有WBC升高,以NEUT上升显著,CRP、IL亦升高明显。在许丹等[10]报道的10例其他病毒引起的ANE患儿病例中,所有患儿的WBC和超敏CRP均未明显升高,这与本研究不一致;但LAZARTERANTES等[11]报道的1例COVID-19相关的ANE患儿也存在WBC升高,我们考虑是由于SARS-CoV-2感染快速进展后合并其他的细菌感染所致。由于感染,其中1例患儿D-D二聚体升高,2例患儿部分Torch抗体升高。ZHOU等[12]报道指出,入院时D-D二聚体升高 (>1 μg/L)是成人COVID-19患者死亡的风险因素。在一组COVID-19儿童患者中也报道了D-D二聚体升高。此外,D-D二聚体水平升高在婴儿(0至1岁)中比其他年龄组更常见,这可能表明婴儿比年龄较大的儿童受到COVID-19的影响更严重[13]。2例患儿血生化检查肝酶、NT-proBNP均有升高,提示多脏器损害。其中1例患儿脑脊液蛋白水平升高,其余指标无明显异常。这些表现与先前文献报道一致[14]。另外,本组1 例患儿PCT明显升高,1 例轻度升高。在我国台湾省13例COVID-19患儿合并脑炎报道[15]中,提示PCT明显升高,张涛等[16]报道的中国医科大学附属盛京医院的13例ANE患儿也显示PCT普遍升高,提示COVID-19感染并发脑病或脑炎可以引起PCT升高,但是否可以用PCT的检测值来评估脑病的严重程度还需要进一步研究。
COVID-19 并发ANE的发病机制尚不完全明确。有研究[12]认为,SARS-CoV-2 通过与血管紧张素转换酶受体结合进入人体细胞,因此表达该受体的细胞最容易受到损伤,比如神经元和神经胶质细胞,以及脑内的内皮和动脉平滑肌细胞,进入机制可能是通过内皮细胞或筛板和嗅球进行血源性播散[17]。然而,中枢神经系统受累也可能是由于类似于噬血细胞性淋巴组织细胞增多症的“细胞因子风暴”机制[18],即先前的系统性感染引发的强烈全身免疫反应,产生大量炎性细胞因子,使血脑屏障受损,随后出现水肿、出血及坏死,从而影响了神经系统的功能。此外,研究[19-20]表明ANE有遗传易感性,RANBP2基因突变与急性坏死性脑病I型相关,更多的证据表明,RanBP2与不同的病毒相互作用以调节病毒感染。因此,目前将ANE分为散发性/孤立性ANE及家族性/复发性ANE,而大部分病例为散发 性[21]。
神经影像学检查是诊断ANE的重要手段,其特征性影像学表现为多灶性、对称性脑损害[14]。在MRI上表现为多发性T2WI高信号病灶,主要累及侧脑室旁白质、丘脑、壳核、小脑和脑干被盖,偶见脊髓受累。ANE可见双侧丘脑ADC序列特征性“同心圆结构”、“三色模式”或“靶样征”:最外层渗出为高信号,反映血管源性水肿,中间层反映细胞毒性水肿为低信号,中心区反映血管周围出血、神经元坏死为高信号,提示血脑屏障破坏[22]。本组2例患儿均出现了双侧丘脑ADC序列“同心圆样”异常信号。另有文献[11]指出,MRI病变的范围与预后不良相关,特别是累及脑干时,病灶内如果有出血或组织缺损的通常提示预后不良。SARS-CoV-2感染伴神经系统表现的儿童患者最常见的MRI表现包括胼胝体压部信号改变,包括胼胝体压部T2高信号病变伴或不伴扩散受限,最有可能继发于多系统炎症综合征,累及胼胝体膝部和半卵圆中心也有报道。
SARS-CoV-2导致的儿童ANE目前尚缺乏有效的特异性治疗手段,主要以对症支持治疗为主,由于ANE主要发病机制考虑为“细胞因子风暴”,因此,治疗主要用激素冲击、免疫球蛋白以及血浆置换等免疫调节疗法。本研究的2例患儿均早期运用糖皮质激素及人免疫球蛋白治疗,1例行血浆置换治疗,余治疗差异不大。有研究[23]表明,起病24 h内或者早期应用抗生素能使患者有更好的预后,本研究中的2例患儿在早期激素冲击和丙种球蛋白治疗下最终好转出院,但目前激素使用剂量、疗程及是否联用未有共识,需要扩大样本量开展对照试验进一步研究。此外,亚低温技术(深部体温35 ℃)治疗ANE也有较好的疗效,对儿童的预后结局比较重要,尤其是在发病12 h内采用后效果更加显著[24-25]。早期运用连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)于ANE患儿直至意识清醒,出院后随访的1年中没有显示认知障碍,因此认为及时和持续的CRRT可能有助于ANE取得更好的疗效和预后[26]。
ANE多数预后不良,文献报道病死率为30%~70%,存活者多遗留不同程度的神经系统后遗症[27]。本研究的2例患儿,随访1例出院后1周大致恢复同健康儿童,有1例留有神经系统后遗症,表现为不完全性瘫痪及智力下降。年龄<2岁、血清天冬氨酸转移酶显著升高、脑脊液蛋白显著升高以及脑干受累通常预示预后不良[4]。朱红敏等[28]报道的41例ANE,有7例(17.1%)死亡,存活的34例平均随访2年(7个月至5.7年),都出现了神经功能障碍,其中轻度8例(23.5%)、中度12例(35.3%)、重度14例(41.2%)。CLEUZIOU等[29]报道的12 家法国医院儿童重症监护室的41例流感相关性脑病(influenzaassociated encephalopathy, IAE)中,1/3为ANE,最后死亡7 例(17%),留有神经系统后遗症20 例(49%),留有严重残疾11例(27%)。可见ANE致残率极高,因此,幸存患儿后遗症的康复治疗也需引起重视。有研究[4]认为,ANE患儿的神经系统后遗症可能随时间推移逐渐减轻甚至消失,遗留神经系统后遗症的患儿积极进行康复治疗可能会逐步改善生存质量。本研究中的病例1患儿采用的康复治疗方法主要有运动疗法、有氧训练、作业训练、生物反馈治疗、踩车训练、单人舱治疗、经颅磁治疗、言语认知训练等相应的功能恢复治疗手段,在两次康复治疗后,言语、运动和认知功能恢复较好。目前对ANE患儿后期康复治疗手段及效果研究较少,将来可以展开更多的研究。
综上所述,ANE是一种罕见的神经系统危重症,SARS-CoV-2感染可引起ANE的发生,死亡和伤残率较高,因此临床医师应加强对该病的早期识别能力。当患儿前期感染后迅速出现脑病表现,且影像学有特征的对称性多发病灶或丘脑“同心圆样”结构改变,我们应当考虑ANE的可能,并积极予以免疫治疗,有助于获得更好的预后。本研究的局限性在于样本量过小,且样本均来自同一地区,将来可以运用脑功能结构成像技术对患儿进行长期随访,纵向观察患儿的细微脑功能结构变化,并且加强对康复治疗的研究也是未来的方向。

