血清sST2联合MELD评分等多指标在ALSS治疗前预测乙型肝炎病毒相关慢加急性肝衰竭患者治疗结局*
强 锐,朱 莉,胥 萍,3,朱传武,陈 洁,刘轩妙,徐俊驰,3△
1.苏州大学苏州医学院附属传染病医院,江苏苏州 215000;2.苏州大学附属传染病医院肝病科,江苏苏州 215000;3.苏州大学附属传染病医院检验中心,江苏苏州 215000
慢加急性肝衰竭(ACLF)是一组在慢性肝病基础上由多种因素(细菌感染、病毒激活、酒精中毒、药物等)诱发导致的肝功能严重急性受损的临床症候群,其病情重、进展快、病死率高[1]。目前,东西方研究协会对于ACLF定义具有争议,主要表现在急性诱发因素、诊断或排除标准、肝功能损伤类型和肝病分期等方面[2-3],而针对ACLF的治疗主要集中在内科支持治疗、人工肝系统支持(ALSS)治疗和肝移植等[4]。致瘤抑制蛋白2(ST2)是Toll样受体超家族的成员,分为两种亚型,其膜型ST2表达于多种免疫细胞表面,可溶性ST2(sST2)分布于血清中。白细胞介素(IL)-33是IL-1超家族的成员,作为ST2的配体,主要由内皮细胞、上皮细胞和成纤维细胞等合成,是炎症时期组织来源的核细胞因子[5]。有研究表明,IL-33/ST2轴在促进伤口愈合和组织修复中起关键作用,然而,过度激活的炎症反应会使其失去平衡,导致细胞或组织向坏死方向发展[6]。当细胞或组织发生损伤或坏死时,IL-33由细胞内释放,通过细胞膜表面ST2定位于多个器官如肝、肾、肺等[7];或被多种蛋白酶裂解成具有更高生物活性的成熟IL-33,进而激活下游细胞通路以增强多种免疫细胞功能,介导下游的炎症反应[8],而sST2的存在与IL-33结合,可减少炎症细胞浸润,证明血清sST2可以阻断IL-33的功能,以防止IL-33发挥作用[9]。相反,VOLAREVIC等[10]研究发现,通过激活IL-33/ST2轴可减轻由伴刀豆球蛋白A诱导的肝功能损伤。现阶段鲜有ACLF患者血清sST2与ALSS治疗效果的相关研究,本研究通过收集ALSS治疗前ACLF患者血清,试图进一步弄清楚血清sST2是否可作为ACLF患者ALSS治疗疗效及预后检测的可靠生物标志物,这将有助于更进一步阐明ACLF的发展和预后。
1 资料与方法
1.1一般资料 选取2017年10月至2021年7月于苏州大学附属传染病医院接受过ALSS治疗的乙型肝炎病毒(HBV)相关慢加急性肝衰竭(HBV-ACLF)患者30例为HBV-ACLF组,HBV相关肝硬化(HBV-LC)患者20例为HBV-LC组。HBV-ACLF患者纳入标准:患者符合《肝衰竭诊治指南(2018年版)》诊断标准[1],且感染HBV超过6个月。HBV-LC患者纳入标准:患者均符合《肝硬化诊治指南》[11]。排除标准:(1)严重的免疫缺陷或接受免疫抑制剂治疗;(2)合并自身免疫性疾病;(3)合并其他肝炎病毒感染导致的肝脏疾病;(4)败血症、哮喘或过敏反应等全身系统性疾病。所有入组HBV-ACLF患者在住院期间都接受了相同的标准治疗方案,给予支持性治疗、对症治疗、病因治疗(包括抗病毒治疗),同时所有HBV-ACLF患者均进行了血浆置换型ALSS治疗,并长期随访,得到患者ALSS治疗后结局(好转或死亡)。同期选取苏州大学附属传染病医院体检中心的体检健康者25例为对照组,纳入标准:既往无糖尿病、冠心病、高血压、传染性疾病等病史,血常规、肝肾功能检查均正常。本研究得到了苏州大学附属传染病医院伦理审查和科学调查委员会的批准(2020院伦理审字010号),并且所有参与者均知情同意。
1.2方法
1.2.1检测方法 所有研究对象抽取外周静脉血,2 000 r/min离心15 min后分离得到1~2 mL血清转移至EP管,长期于-80 ℃冰箱冻存。HBV-ACLF组标本是在ALSS治疗前48小时内采集接受ALSS治疗的患者的血清标本,以测量血清sST2、IL-2、IL-12、IL-17和干扰素(IFN)-γ水平。对照组和HBV-LC组的血清标本,收集后同样保存于-80 ℃备用。酶联免疫吸附试验(ELISA)操作均按照R&D公司Human ST2/IL-33 ELISA试剂盒(DST200)、优宁维公司Human IL-2 ELISA试剂盒(abs510001)、优宁维公司Human IL-12 ELISA试剂盒(abs510011)、优宁维公司Human IL-17 ELISA试剂盒(abs510019),dldevelop公司Human IFN-γ ELISA试剂盒(DL-IFNG-Hu)说明书进行测量。
1.2.2数据采集 除了实验测得的各种指标外,还收集了患者ALSS治疗前48 h的相关临床数据。血清总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和肌酐(Cr)水平由日立7600全自动临床生化分析仪测量,国际标准化比值(INR)、凝血酶原时间(PT)和凝血酶原活动度(PTA)由自动凝血分析仪(法国斯塔戈诊断)测量。通过瑞士罗氏荧光定量PCR仪Light cycler 480检测血清HBV-DNA。通过美国雅培A3600免疫自动化仪器检测乙型肝炎e抗原(HBeAg)。使用国际修正标准公式计算终末期肝病模型(MELD)评分:R=3.8×ln[TBIL(mg/dL)]+11.2×ln[INR]+9.6×ln[Cr(mg/dL)] +6.4×(胆汁性或酒精性原因记为0,其他原因记为1)。
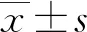
2 结 果
2.1各组一般资料比较 各组性别比较,差异无统计学意义(P>0.05),但HBV-ACLF组和HBV-LC组平均年龄均高于对照组(P=0.001),且HBV-ACLF组TBIL、DBIL、IBIL、ALT、AST水平明显高于对照组和HBV-LC组(P<0.001),见表1。
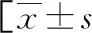
表1 各组一般资料比较或n(%)或M(P25,P75)]
2.2各组血清sST2水平比较 HBV-ACLF组血清sST2水平为[387 000(181 500,943 500)] pg/mL,HBV-LC组血清sST2水平为[23 522(18 127,28 755)] pg/mL,对照组血清sST2水平为[17 202(13 725,19 916)] pg/mL,HBV-ACLF组血清sST2水平明显高于对照组和HBV-LC组,HBV-LC组血清sST2水平高于对照组,差异均有统计学意义(P<0.05),见图1。
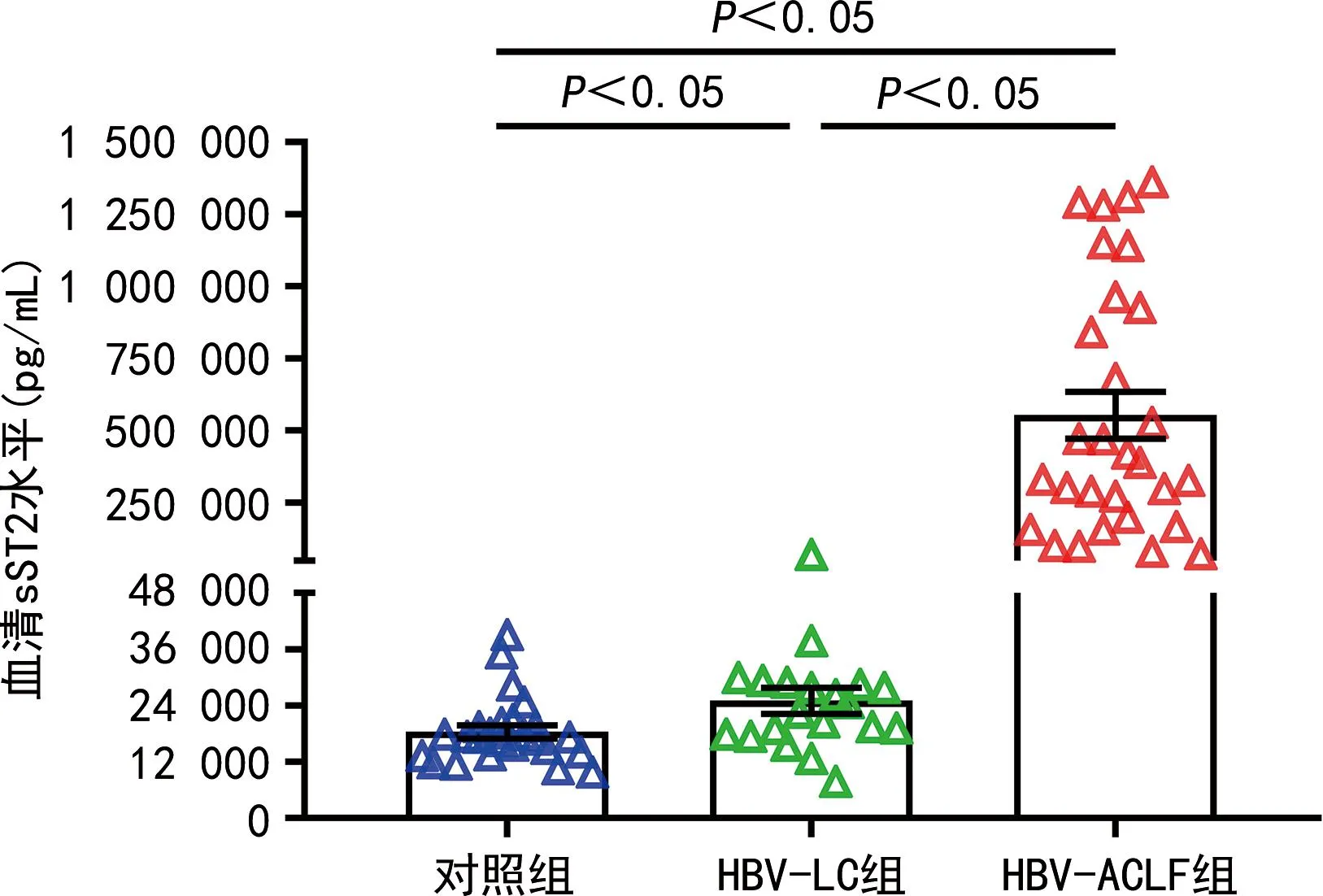
图1 各组血清sST2水平比较
2.3单个指标在ALSS治疗前预测ACLF患者ALSS治疗结局的效能 结果显示,sST2在ALSS治疗前预测HBV-ACLF患者治疗结局的曲线下面积(AUC)为0.643,高于肝功能代谢指标TBIL、DBIL、IBIL、ALT、AST和凝血功能指标PT、PTA、INR,同时炎症相关指标IL-2、IL-12、IL-17、IFN-γ的AUC均低于0.600,预测患者治疗结局较弱。MELD评分的AUC为0.605,低于sST2的AUC。见表2。

表2 单个指标在ALSS治疗前预测ACLF患者ALSS治疗结局的效能
2.4生存曲线分析 进一步根据每个指标各自的最佳临界值将患者分为高值组和低值组并绘制生存曲线,发现sST2、PTA、IL-17高值组和低值组30 d生存率比较,差异有统计学意义(Log-rankP=0.019 8、0.010 7、0.042 3),而其他指标高低值组在30 d生存率上比较,差异均无统计学意义(P>0.05)。见图2、3。
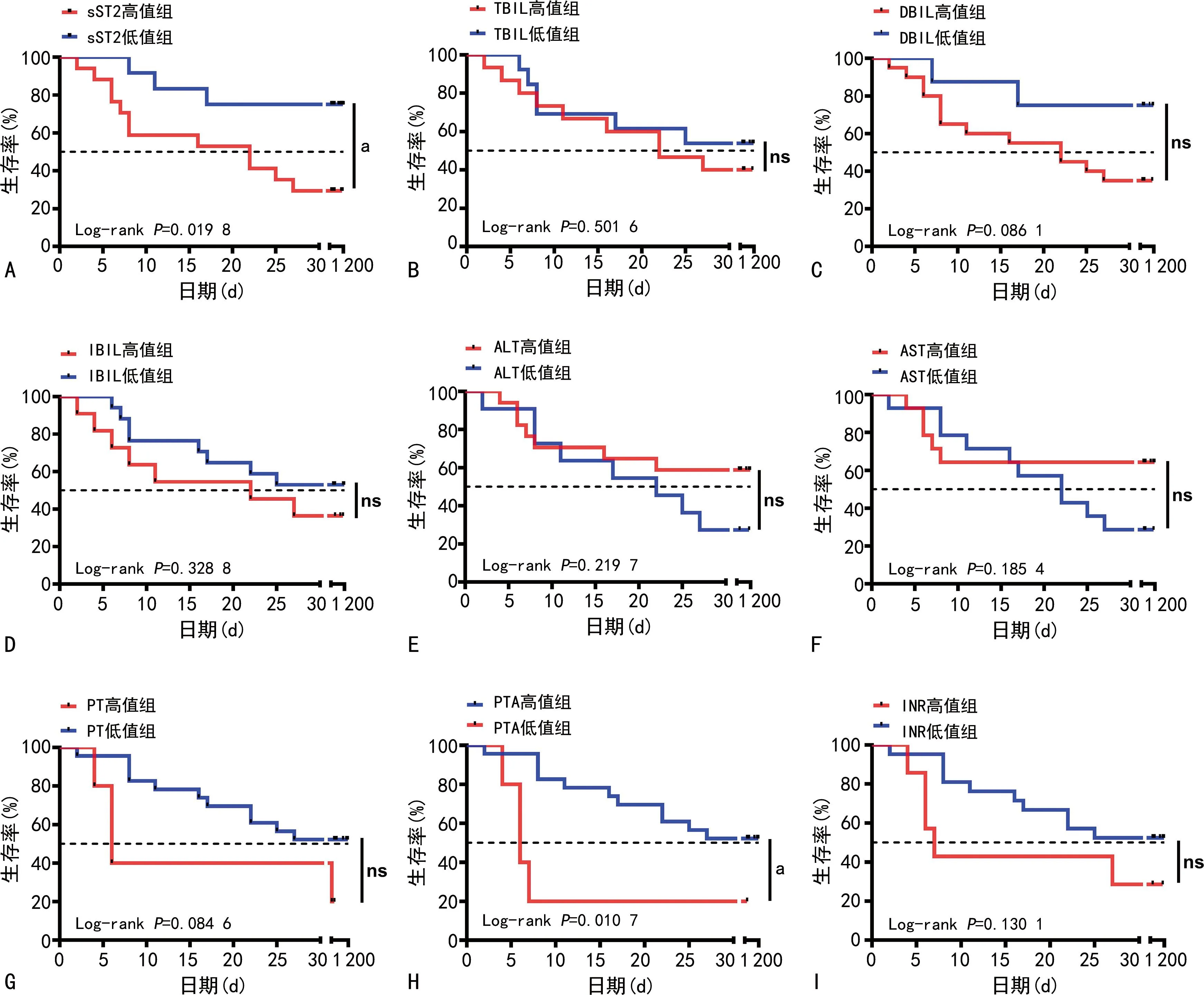
注:A~I分别为sST2、TBIL、DBIL、IBIL、ALT、AST、PT、PTA、INR相应高低值组比较的生存曲线图;aP<0.05;ns为P>0.05。

注:A~F分别为sST2、IL-2、IL-12、IL-17、IFN-γ及MELD评分相应高低值组比较的生存曲线图;aP<0.05;ns为P>0.05。
2.5多个指标联合在ALSS治疗前预测ACLF患者ALSS治疗结局的效能 由于单因素指标ROC曲线分析的AUC预测患者结局较弱,sST2、MELD评分联合临床相关指标检测结果表明,sST2、MELD评分联合IL-12的AUC为0.775,对预测患者预后具有相对较高的价值,见表3。

表3 多个指标联合在ALSS治疗前预测ACLF患者ALSS治疗结局的效能
3 讨 论
ACLF是肝硬化或慢性肝病患者出现急性肝功能恶化乃至危及生命的临床综合征,使患者发生全身炎症反应、多器官功能衰竭等现象。研究表明,ACLF的发病机制与病原体相关分子模式和损伤相关分子模式等导致的“细胞因子炎症风暴”密切相关[12],而严重的免疫炎症反应是ACLF患者死亡的关键。然而,ACLF的治疗缺乏特效药物和手段,主要为基于器官衰竭的支持性治疗、病因治疗和ALSS治疗。对于危重症的患者,ALSS治疗或肝移植是最有效的治疗方法,可提供良好的长期预后。而ALSS已被证明可以将ACLF的短期病死率降低30%,并将ACLF患者的长期生存率提高50%[13-15]。国际主要科学协会提出了有关ACLF不同严重程度的等级划分标准和预后评分,通过单一指标和评分模型对ACLF进行评价[16]。研究发现一些临床指标水平对ALSS治疗后ACLF患者的病死率具有独立的预测价值[17]。现研究阶段ALSS治疗的评价体系仍较为缺乏,需要寻找更灵敏、更特异的生物检测指标来进一步完善和简化体系。
近年来,IL-33/ST2通路参与了肝脏疾病的发病机制,而越来越多的人建议将sST2作为预后的相关指标。然而,关于IL-33/ST2通路在ACLF方面的作用确切机制尚不清楚,部分观点颇具争议。sST2水平在肝肾器官衰竭、免疫排斥反应、胃肠癌症、心血管疾病等方面与患者疾病的严重程度相关[8]。YUAN等[18]在分析HBV-ACLF患者病程中发现,与慢性乙型肝炎组、ACLF前期组比较,血清sST2水平在ACLF组是最高的,联合多项生物学指标可用于评估患者肝脏复发的病程进展和病死率,而高水平的血清sST2与生存率呈负相关,并且治疗后sST2水平降低,患者出现好转,生存时间延长,因此,建议可将sST2作为预测患者生存时间的重要指标[19]。研究者对血清sST2进行检测时发现其在急性肝衰竭[20]、ACLF[21]患者中水平升高,尽管其配体IL-33时常由于半衰期短、表达微弱难以检测[22],但sST2仍在ACLF患者中保持较高水平,似乎与疾病严重程度保持一致,提示sST2可作为判断疾病严重程度的重要指标,有助于区分急、慢性肝衰竭或监测疾病的进程。
本研究发现HBV-ACLF患者存在sST2水平升高的现象,进一步利用ROC曲线区分sST2高低值组发现,当HBV-ACLF患者ALSS治疗前血清sST2水平≤312 500 pg/mL时,其患者疗效好于血清sST2水平>312 500 pg/mL的患者,提示sST2与ALSS的疗效存在相关性,同时生存分析曲线结果显示,sST2高值组和低值组生存率有明显差异(Log-rankP=0.019 8)。于是,进一步通过多指标联合检测分析发现,sST2、MELD评分联合炎症相关指标IL-12具有较高的预测价值,其AUC为0.775,明显高于其他指标联合检测结果,为预测ALSS治疗的疗效提供了更准确、更灵敏、更早期的生物学指标和预测模型。
然而,由于本研究样本量较小,未能观察整个病程中血清sST2的水平变化,需要加入更多的样本量进行更深入的研究,从而进一步完善ALSS治疗的评价体系,为提高ACLF患者的生存率提供实验室依据。

