血清Stathmin、TFF3与上皮性卵巢癌患者初始肿瘤细胞减灭术治疗结局和术后复发的关系*
韩 晴,何爱琴,李 咏,邱云芬,刘春花
南通市肿瘤医院/南通大学附属肿瘤医院妇科,江苏南通 226361
卵巢癌为威胁全球女性生命健康的常见恶性肿瘤,发病率居第7位,病死率居第8位[1]。该肿瘤发病隐匿,目前缺乏有效的筛查与早期诊断方式,5年生存率约为47%[2]。上皮性卵巢癌多发于绝经后的女性,确诊患者多处于中晚期,此时可能合并脏器或淋巴结转移,错失最佳治疗时机[3]。初始累及盆腔及上腹部浸润性上皮性卵巢癌应尽可能切除癌病灶[4]。初始肿瘤细胞减灭术适用于中晚期卵巢癌患者,能较大程度切除病灶组织,抑制病情进展[5]。初始肿瘤细胞减灭术的满意标准为残余癌灶最大径不足1 cm,尽可能肉眼看不见残留病灶[6]。初始肿瘤细胞减灭术结局满意为提高患者术后生存率的关键,术前评估其结局可为治疗方案选择提供参考,但治疗后高复发率也是一大难题,寻找患者术后复发的危险因素是临床关注重点[7]。微管解聚蛋白(Stathmin)属于微管不稳定调节蛋白,对细胞微管功能有影响,可改变细胞增殖周期[8]。研究指出,Stathmin参与了肿瘤发生、治疗后复发转移等[9]。三叶因子3(TFF3)为三叶因子家族中最晚发现的小分子分泌多肽,可参与黏膜保护、上皮修复等过程,在多种肿瘤中水平较高[10-11]。研究显示,TFF3与宫颈癌等术后复发有关[12],但是血清Stathmin、TFF3与上皮性卵巢癌术后复发是否相关尚不清楚。为此,本研究通过分析血清Stathmin、TFF3对上皮性卵巢癌患者初始肿瘤细胞减灭术治疗结局和术后复发的影响,旨在为临床早期诊疗和降低复发率提供参考依据。
1 资料与方法
1.1一般资料 选取2016年7月至2020年1月本院收治的177例上皮性卵巢癌患者为研究对象,年龄35~78岁,平均(57.93±6.39)岁;国际妇产科联盟(FIGO)分期:Ⅲ期86例、Ⅳ期91例;组织分级:低分化74例、中高分化103例;淋巴结转移83例;超出腹腔外的远处转移87例。纳入标准:(1)符合《妇产科学》中卵巢癌诊断标准[13],经计算机断层扫描(CT)、磁共振成像(MRI)或超声等影像学检查与病理检查确诊为上皮性卵巢癌,Finkler超声评分≥7分;(2)患者FIGO分期为Ⅲ~Ⅳ期,符合指征,接受初始肿瘤细胞减灭术治疗;(3)预计生存期超过3个月,临床资料完整;(4)患者知情同意并签署同意书。排除标准:(1)无法耐受手术患者;(2)合并其他肿瘤患者;(3)术前有新辅助化疗患者;(4)感染性疾病患者;(5)化疗禁忌证患者;(6)严重肝肾功能障碍患者;(7)精神疾病患者。本研究取得本院伦理委员会批准(批号:2016xjs084)。
1.2方法
1.2.1临床资料收集 收集患者临床资料,包括年龄、FIGO分期、组织分级、腹水、化疗方法及淋巴结转移、超出腹腔外的远处转移等资料,并收集患者术后肿瘤标志物糖类抗原125(CA125)、人附睾蛋白4(HE4)检测结果。
1.2.2血清Stathmin、TFF3检测 术前抽取患者入院第2日清晨空腹静脉血3 mL,以3 000 r/min转速离心(离心半径为10 cm)0.5 h,取其血清置于-80 ℃冰箱中冷冻保存备用。采用酶联免疫吸附试验检测血清Stathmin、TFF3水平,Stathmin试剂盒购于深圳市康初源有限公司,TFF3试剂盒购于上海泽叶生物科技有限公司,操作过程严格按说明书进行。
1.2.3手术方法和手术结局评价 初始肿瘤细胞减灭术:术前做好充分的肠道准备,患者入手术室后常规消毒铺巾,麻醉后于腹部做一足够长的纵形切口,抽取腹水或腹腔冲洗液行脱落细胞学检查,全面探查盆腹腔,切除包括全子宫、大网膜、双附件、盆腹腔癌灶与盆腔或腹主动脉淋巴结,必要时游离输尿管。根据术中探查情况切除受累的肠管、部分膀胱等脏器,尽可能剥离切除受累腹膜。手术由同一组经验丰富的主任医师进行操作。手术结局:以肉眼下完全无残留癌灶(R0)或单个残留癌灶最大径不超过1 cm(R1)为满意,单个残留癌灶最大径>1 cm(R2)为不满意[14]。
1.3随访和复发标准 对患者行3年随访,第1~2年每隔2~3个月随访1次,第3年每隔4~6个月随访1次,随访截止时间为2023年1月或患者死亡。复发标准:CA125、HE4等肿瘤标志物水平升高,CA125正常范围为0~35 U/mL,HE4正常范围为0~140 pmol/L,高于正常值则判断为水平升高;经CT或MRI等检查、体格检查显示肿块;不明原因的肠梗阻;出现腹水。患者经手术治疗满意半年后发生以上任两项表现即可确诊为复发[15]。
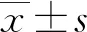
2 结 果
2.1满意组与不满意组基线资料比较 177例患者治疗结局满意113例(满意组),满意率为63.84%,不满意64例(不满意组)。满意组与不满意组年龄、FIGO分期、组织分级、淋巴结转移与超出腹腔外的远处转移比较,差异无统计学意义(P>0.05),满意组血清CA125、HE4水平低于不满意组(P<0.05)。见表1。
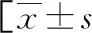
表1 满意组与不满意组基线资料比较或n(%)]
2.2满意组与不满意组血清Stathmin、TFF3水平比较 满意组血清Stathmin、TFF3水平低于不满意组(P<0.05)。见表2。

表2 满意组与不满意组血清Stathmin、TFF3水平比较
2.3血清Stathmin、TFF3对治疗结局不满意的预测价值 将血清Stathmin、TFF3以Logistic回归法构建联合应用的回归预测模型(LogP模型),模型为:Ln(P/1-P)= 0.829 1 ×Stathmin +0.022 5×TFF3。以其模型值为预测指标,进行ROC曲线分析。结果显示,血清Stathmin、TFF3单独及联合应用预测手术结局不满意的曲线下面积(AUC)分别为0.756、0.731、0.826,其中联合应用预测效能较高,AUC及灵敏度、特异度、准确度均较各指标单独应用有明显提升。见表3。

表3 血清Stathmin、TFF3对手术结局不满意的预测价值
2.4复发组与未复发组临床相关资料比较 随访结果显示,治疗结局满意患者复发47例(复发组),复发率为41.59%,未复发66例(未复发组)。复发组与未复发组年龄、化疗方法比较,差异无统计学意义(P>0.05),两组FIGO分期、组织分级、腹水、CA125、HE4、淋巴结转移、超出腹腔外的远处转移及血清Stathmin、TFF3水平比较,差异有统计学意义(P<0.05)。见表4。
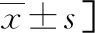
表4 复发组与未复发组临床相关资料比较[n(%)或
2.5影响术后复发的多因素分析 以表3中差异有统计学意义的指标:FIGO分期(Ⅳ期=1,Ⅲ期=0)、组织分级(低分化=1,中高分化=0)、腹水(>1 000 mL=1,≤1 000 mL=0)、CA125(>35 U/L=1,≤35 U/L=0)、HE4(>400 pmol/L=1,≤400 pmol/L=0)、淋巴结转移(有=1,无=0)、超出腹腔外的远处转移(有=1,无=0)、Stathmin(连续性变量,原值输入)、TFF3(连续性变量,原值输入)为自变量,有无复发(复发=1,未复发=0)为因变量行多因素Logistic回归分析,结果显示,FIGO分期Ⅳ期、腹水>1 000 mL、淋巴结转移、超出腹腔外的远处转移及术前血清Stathmin、TFF3水平升高为患者术后复发的独立危险因素(P<0.05)。见表5。
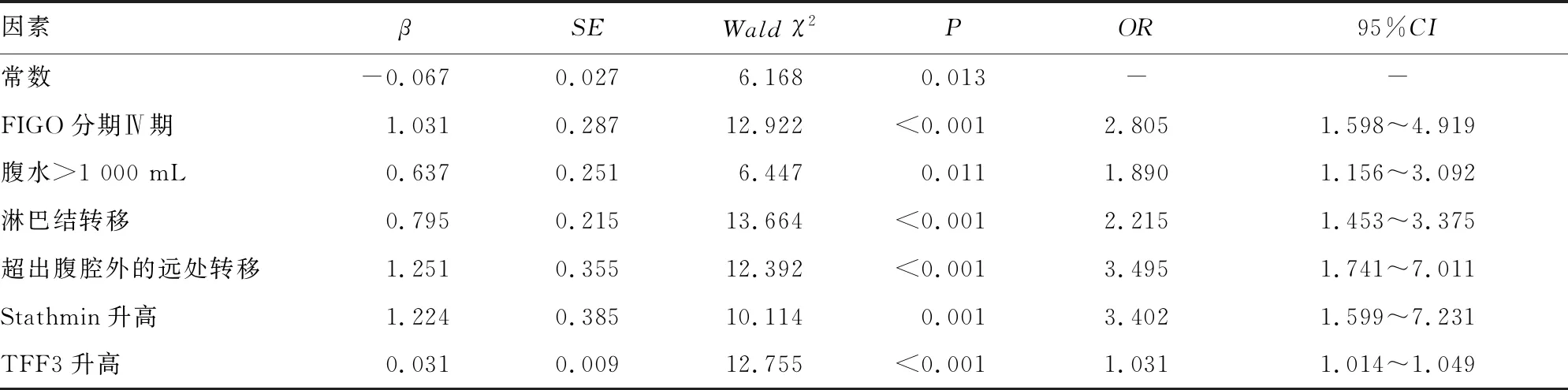
表5 影响术后复发的多因素分析
2.6血清Stathmin、TFF3对术后复发的预测价值 血清Stathmin、TFF3构建联合应用的回归预测模型(LogP模型),模型为:Ln(P/1-P)=1.224 1×Stathmin+0.0313 ×TFF3。结果显示:血清Stathmin、TFF3两指标单独及联合应用预测术后复发的AUC分别为0.781、0.720、0.834,联合应用预测效能更高。见表6。

表6 血清Stathmin、TFF3对术后复发的预测价值
3 讨 论
上皮性卵巢癌多发于中老年女性,其早期诊断率较低,患者病死率高,该肿瘤发病较为隐匿、病情进展快,治疗以手术为主,辅助化疗,强调综合治疗[16]。初始肿瘤细胞减灭术为上皮性卵巢癌治疗的重要方式,需尽可能切除盆腔、腹部及腹膜后肿瘤的所有病灶[17]。因部分患者为晚期,肿瘤已侵犯多器官,粘连较为严重,初始肿瘤细胞减灭术可能无法取得满意效果[18]。故术前评估手术结局对治疗方案选择、改善患者预后具有一定指导作用。患者晚期上皮性卵巢癌肿瘤细胞减灭术后易复发,复发将进一步加重病情,治疗难度更大。故寻找血清指标以预测患者术后复发极为重要。
Stathmin为近年来研究较多的微管调节蛋白,多存在于细胞质内,能够经磷酸化调节自身活性,改变细胞中微管系统动力平衡,在细胞周期中有重要作用[19]。该蛋白于乳腺癌[19]、结直肠癌[20]等多种肿瘤中水平升高。赵车冬等[21]指出,胃癌根治术后患者血清Stathmin水平与肿瘤复发转移有关。师路等[22]研究指出,胸腔镜食管癌切除术患者术后血清Stathmin水平与复发转移具有相关性,对术后复发转移具有预测价值。张军港等[23]研究发现,Stathmin参与卵巢癌C13K细胞的发生发展,但血清中Stathmin水平在上皮性卵巢癌患者的表达尚不清楚。本研究不满意组血清Stathmin水平高于满意组,提示血清Stathmin水平可能与初始肿瘤细胞减灭术后治疗结局有关。该结果原因可能为:Stathmin的作用靶点为微管蛋白,磷酸化水平与微管平衡及细胞周期转化有关,当细胞进入有丝分裂期,Stathmin磷酸化水平升高而促进细胞退出有丝分裂期,抑制正常细胞增殖而促进卵巢癌细胞增殖、侵袭、转移等能力[24]。研究指出,野生型p53基因能通过抑制Stathmin启动子活性以参与其表达的负性调节,而Stathmin高表达则越过p53介导的细胞周期阻滞,对癌细胞增殖、分化等产生促进作用[25]。
TFF3于肠黏膜损伤时可保护肠黏膜,对上皮愈合具有促进作用。TFF3通过多种机制在妇科恶性肿瘤发生发展中发挥重要作用,研究发现健康女性生殖组织中的TFF3无表达或表达较低,但在宫颈癌等肿瘤中表达升高[11]。TFF3表达受雌激素调控,在不典型增生组织和子宫内膜癌组织中异常升高[26]。TFF3与血管内皮生长因子具有协同作用,可激活信号转导通路促进肿瘤细胞侵袭与肿瘤生长[26]。MORITO等[27]研究指出,TFF3在结直肠癌中术后复发中表达升高。康婷等[12]指出,TFF3水平升高的宫颈癌患者术后2年易复发,但是血清TFF3在上皮性卵巢癌患者中的表达及是否与术后复发有关尚不清楚。本研究中不满意组血清TFF3水平高于满意组,提示TFF3可能与初始肿瘤细胞减灭术后治疗结局有关,其原因可能为TFF3通过表皮生长因子受体等信号通路对癌细胞存活、转移等过程产生促进作用[28]。TFF3高表达促进肿瘤发生发展,抑制癌细胞黏附以促进肿瘤浸润、侵袭,对细胞凋亡有明显抑制作用,进而促进癌细胞转移与扩散,导致初始肿瘤细胞减灭术的治疗结局不满意[29]。
复发组Stathmin、TFF3水平高于未复发组,进一步经多因素Logistic回归分析显示,术前血清Stathmin、TFF3水平升高为患者术后复发的独立危险因素,该结果原因为Stathmin能调节微管动力与纺锤体形成,对有丝分裂具有影响,进而改变细胞周期以影响细胞生物学行为,水平过高对癌细胞侵袭转移有促进作用,增加了术后复发风险[30-31]。TFF3可抑制E-钙黏蛋白表达,增加肿瘤侵袭性,TFF3表达上调抑制细胞凋亡,促进癌细胞增殖、侵袭、转移过程,术后更易复发[32]。血清Stathmin、TFF3联合检测对预测治疗结局不满意、术后复发的AUC分别为0.826、0.834,其灵敏度及特异度均高于Stathmin、TFF3单独检测,提示二者联合应用可以提升预测价值。与临床常用的血清CA125和HE4相比较,血清Stathmin、TFF3联合检测的预测效能略高,血清CA125和HE4的AUC在0.65~0.70,而血清Stathmin、TFF3单独及联合检测的AUC均>0.73,且血清Stathmin、TFF3这两个新指标采集难度与血清CA125、HE4相似,作为预测评估指标更适用。因此,Stathmin、TFF3有望作为临床早期评估上皮性卵巢癌患者治疗结局和预后的潜在生物标志物。但对于血清Stathmin、TFF3在上皮性卵巢癌中具体作用机制仍需展开进一步研究。
综上所述,血清Stathmin、TFF3在上皮性卵巢癌中水平升高,能有效预测患者初始肿瘤细胞减灭术治疗结局和术后复发风险,也是影响患者术后复发的危险因素,可作为临床诊疗与复发风险评估的潜在生物标志物。

