肝素结合蛋白、白介素-1β、丙二醛与新生儿化脓性脑膜炎病情严重程度与转归的关系
胡 浩,和灿琳,崔 珊,周百灵,张 焱
(昆明市儿童医院1.新生儿科;2.检验科,云南 昆明 650000)
新生儿化脓性脑膜炎在早产儿中发病率为1.4%~5.0%,在活产儿中发病率为1/(1 000~4 000),感染时机可能是出生前、出生时或出生后,具有起病急、病情进展迅速的特点,是引起新生儿死亡的主要原因之一,且在存活儿中后遗症发生率高达10%~30%,严重威胁患儿生命健康[1-2]。早期准确评估病情严重程度和病情转归对指导临床分层管理、抗菌药物疗程等均具有重要意义。肝素结合蛋白(heparin-binding protein,HBP)来源于成熟中性粒细胞,是细菌感染时升高最大的标志物之一[3]。Ren等[4]研究新生儿化脓性脑膜炎和病毒性脑膜炎患儿,发现前者脑脊液HBP显著升高。白介素-1β(interleukin-1β,IL-1β)是一种参与急性期免疫反应的细胞因子,在多种感染类疾病中可检测到IL-1β的升高[5]。近年来研究表明,IL-1β水平与术后细菌感染严重程度有关[6]。丙二醛(malondialdehyde,MDA)系脂质过氧化产物之一,细菌感染时可激活机体氧化应激反应,引起MDA升高[7]。王文翔等[8]监测细菌性脑膜炎患儿治疗前后脑脊液MDA水平发现,经有效治疗后脑脊液MDA水平显著降低,提示MDA可能与病情有关。基于此,本研究探讨脑脊液HBP、IL-1β、MDA与新生儿化脓性脑膜炎病情严重程度与病情转归的关系及意义,期待为临床提高新生儿化脓性脑膜炎救治水平、改善预后等提供参考依据。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年12月昆明市儿童医院收治的107例新生儿化脓性脑膜炎患儿作为研究对象,母亲年龄20~45岁,平均(35.00±4.88)岁;新生儿性别男54例,女53例;出生体重2 259.20~3 497.50g,平均(2 688.43±201.88)g。纳入标准:①参考《实用新生儿学》中化脓性脑膜炎的诊断标准[9],患儿具备感染和化脓性脑膜炎的典型表现,脑脊液常规和生化结果符合化脓性脑膜炎诊断或脑脊液细菌培养阳性;②新生儿;③因病情需要,能够顺利获取脑脊液标本,且均达到脑脊液采集标准[10-11];④法定监护人签署知情同意书。排除标准:①遗传代谢疾病;②入院前有抗菌药物等相关治疗史;③先天性脑发育异常;④其他类型的感染性脑膜炎(病毒性脑炎、结核性脑膜炎及新隐球菌脑膜炎等);⑤头颅外伤史;⑥严重的免疫功能低下状态。
1.2 分组及转归
根据患儿的临床症状和意识程度进行病情程度分级:①轻度:伴精神萎靡、易激惹、吮乳减少、惊跳、发热等症状体征,但神志清楚,无惊厥;②重度:精神萎靡、易激惹、吮乳减少、惊跳、发热等症状体征加重,出现嗜睡,可有惊厥、尖叫,惊厥发作后神志能恢复;③急危重症:精神萎靡、易激惹、吮乳减少、惊跳、发热等症状体征进一步加重,出现反复惊厥、昏迷,持续高热,呼吸不规则甚至需要呼吸支持,拒乳。本研究35例为轻度,41例为重度,31例为危急重症。
病情转归:依据相关规范进行治疗[9-11],治疗后临床症状体征消失,脑脊液病原学培养阴性,痊愈无相关后遗症为预后良好(良好组);治疗后临床症状体征改善,但伴有听力损伤、癫痫、脑积水、脑室膜炎、硬膜下积液等表现或死亡为预后不良(不良组)。本研究不良组26例,良好组81例。
1.3 研究方法
1.3.1 资料收集
采用一般资料调查表收集全部患儿母亲年龄、新生儿性别、早产情况、出生体重、分娩方式、发病日龄、胎膜早破情况、病原菌类型资料,比较预后良好组与不良组的以上人口学资料和临床特征情况。
1.3.2 主要仪器、试剂
免疫分析仪(中翰盛泰生物技术Jet-iStar3000型);全自动生化分析仪(日本Olympus AU400);HBP试剂盒(广西金贝医药有限责任公司);IL-1β试剂盒(北京索莱宝科技有限公司);MDA试剂盒(上海双赢生物科技)。
1.3.3 HBP、IL-1β、MDA检测
就诊时,参考《新生儿细菌性脑膜炎病因、诊断与治疗(共识)》《细菌性脑膜炎治疗疗程与腰椎穿刺检查建议》行脑脊液穿刺获取脑脊液标本[10-11],3 000r/min离心10min,分离上清待测。采用免疫荧光干式定量法检测上清HBP水平,采用双抗体夹心酶联免疫吸附法检测上清IL-1β水平,采用比色法检测上清MDA水平。比较不同病情程度、预后良好和不良组HBP、IL-1β、MDA水平,分析三者与病情严重程度关系及预测病情转归价值。
1.4 统计学方法
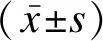
2 结果
2.1 不同病情程度患儿脑脊液HBP、IL-1β、MDA比较
不同病情程度脑脊液HBP、IL-1β、MDA水平不完全相同,两两比较发现危急重症组水平最高,重度组次之,轻度组最低,差异有统计学意义(F值分别为64.013、188.867、148.795,P<0.05),见表1。

表1 不同病情程度患儿脑脊液HBP、IL-1β、MDA比较
2.2 脑脊液HBP、IL-1β、MDA与病情程度相关性
以病情程度为X轴,以脑脊液HBP、IL-1β、MDA为Y轴进行相关性分析,结果显示脑脊液HBP、IL-1β、MDA与病情程度均呈正相关(r值分别为0.863、0.832、0.824,P<0.05),见图1。
图1 脑脊液HBP、IL-1β、MDA与病情程度相关性
2.3 不同预后组脑脊液HBP、IL-1β、MDA比较
预后不良组脑脊液HBP、IL-1β、MDA水平均高于良好组,差异有统计学意义(t值分别为8.933、11.222、6.252,P<0.05),见表2。
表2 不同预后组脑脊液HBP、IL-1β、MDA比较
2.4 ROC曲线分析脑脊液HBP、IL-1β、MDA预测病情转归的价值
以预后不良组为阳性样本,预后良好组为阴性样本,绘制脑脊液HBP、IL-1β、MDA预测病情转归的ROC曲线,结果显示三者预测病情转归的AUC分别为0.748、0.733、0.794,三者联合预测的AUC为0.942,大于单独指标(P<0.05),见表3、表4及图2。
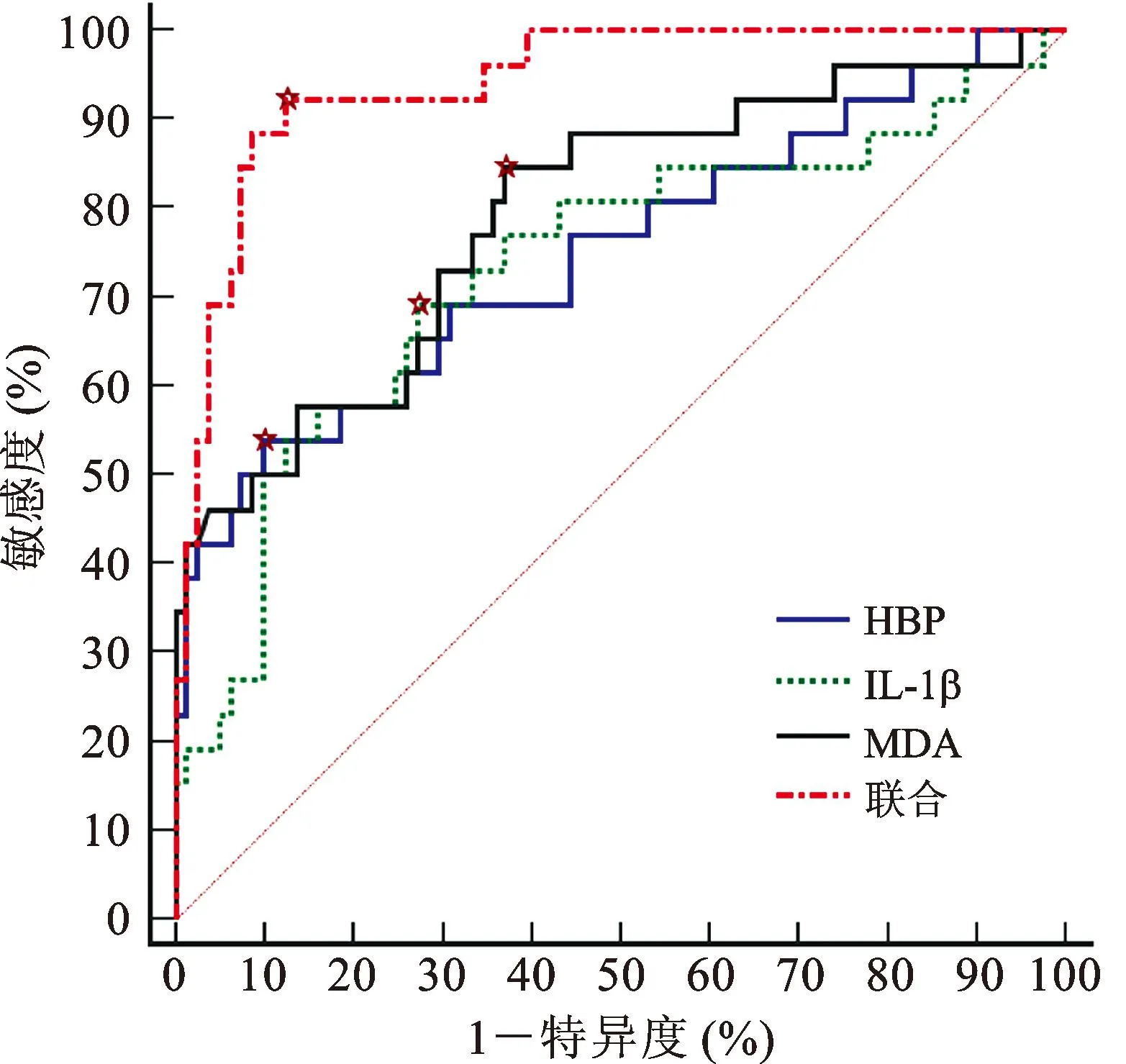
图2 脑脊液HBP、IL-1β、MDA预测病情转归的ROC曲线
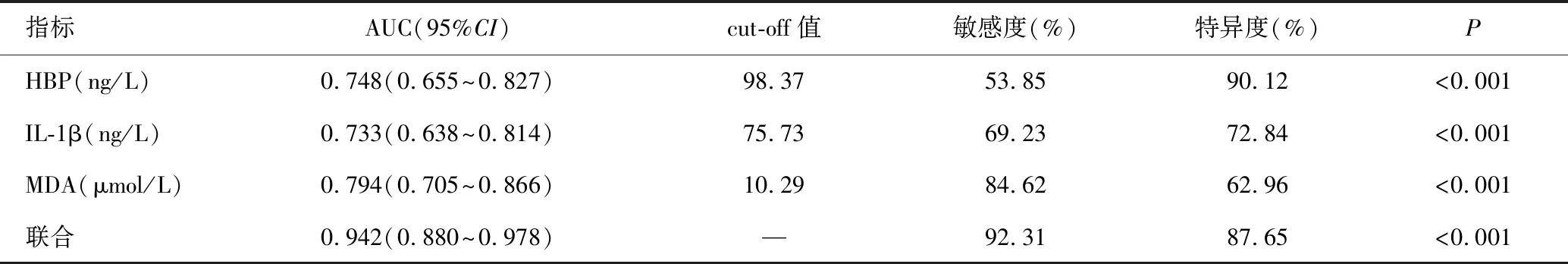
表3 脑脊液HBP、IL-1β、MDA预测病情转归的ROC分析结果
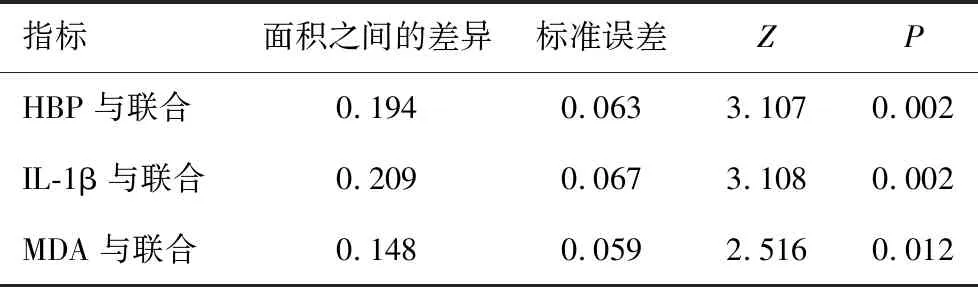
表4 不同预测方案间AUC的比较
3 讨论
3.1 HBP与新生儿化脓性脑膜炎病情、转归关系及预测价值
HBP是近年来细菌感染领域研究的一个热点指标,原因在于细菌感染后60min内即可在血浆中检测到HBP的升高,较传统C反应蛋白、降钙素原等标志物诊断效能更好[12]。本研究结果显示,随着新生儿化脓性脑膜炎病情严重程度的加重,HBP水平逐渐升高,与病情程度均正相关。细菌性脑膜炎发生后,在病原菌刺激下,中性粒细胞被激活,释放大量HBP,从而引起脑脊液HBP升高[13]。大量产生的HBP,能通过增加血管内皮通透性,造成血管微渗漏、脑水肿,并能促进单核巨噬细胞激活、放大炎症反应,引起神经细胞损伤,同时高水平HBP还能通过线粒体途径调节神经细胞凋亡,因此脑脊液HBP越高,神经系统病理反应越明显,患儿病情越严重,不良预后倾向的风险越高[14]。HBP预测病情转归的AUC为0.748,具有一定预测价值,且其预测特异度为90.12%,处于较高水平。由于HBP半衰期短,可敏感、迅速地反映患者病情好转或进展,这不仅有助于评估病情严重程度与病情转归情况,还能评估抗菌药物疗效、是否需要更换抗菌药物或停药等,从而为临床提供有价值的参考信息[15]。
3.2 IL-1β与新生儿化脓性脑膜炎病情、转归关系及预测价值
IL-1β主要由树突状细胞、单核巨噬细胞、淋巴细胞等分泌,表达水平受双信号的严格控制,是典型的炎症级联放大因子[16-17]。Liu等[18]纳入结核性脑膜炎、化脓性脑膜炎、病毒性脑膜炎患儿,并以健康儿童为对照,发现化脓性脑膜炎患儿脑脊液IL-1β水平最高,提示IL-1β与化脓性脑膜炎发病有关。本研究在以上研究基础上发现,化脓性脑膜炎脑脊液IL-1β,与病情程度正相关。在新生幼鼠模型中,阻断IL-1β受体,可抑制IL-1β导致的血液和大脑中细菌负荷的增加,从而促进病情的缓解,证实IL-1β在化脓性脑膜炎病情恶化中起到重要作用[19]。且与病情转归良好患儿比较,病情转归不良患儿脑脊液IL-1β升高,说明IL-1β还与患儿病情转归有关。IL-1β预测病情转归的AUC为0.733,cut-off值为75.73 ng/L,能为临床预测病情转归提供一定参考。
3.3 MDA与新生儿化脓性脑膜炎病情、转归关系及预测价值
MDA是机体氧化抗氧化系统的一个标志物,其水平越高,提示机体氧化应激反应越严重[20-21]。蔡文仙等[22]研究显示,细菌性脑膜炎患儿脑脊液中MDA水平明显高于无中枢神经系统感染的对照组与病毒性脑炎患儿,且与细菌性脑膜炎严重程度有关。本研究发现了类似的结论,提示脑脊液MDA是化脓性脑膜炎病情严重程度的一个潜在标志物。本研究还发现,病情转归不良患儿脑脊液MDA高于良好患儿,与患儿病情转归有关。MDA水平越高,提示机体过氧化反应越明显,脑组织遭受的自由基损伤越严重,从而导致病情的恶化。李静等[23]报道显示,脑脊液MDA判断低龄化脓性脑膜炎患儿病情转归的AUC为0.803,与本研究显示的0.794相似,表明检测脑脊液MDA可作为预测病情转归的一个标志物。脑脊液HBP+IL-1β+MDA的AUC为0.942,大于单独指标,提示联合检测脑脊液HBP、IL-1β、MDA可进一步提高对病情转归的预测价值,且联合预测时其敏感度有所提升,从而有助于临床灵敏、可靠地做出预测,为制定干预方案提供准确参考。
综上,脑脊液HBP、IL-1β、MDA与新生儿化脓性脑膜炎病情严重程度正相关,并与患儿病情转归密切相关,联合检测时可作为评估病情程度及预测不良病情转归危险度的一个可靠方案,为临床干预提供重要参考信息。

