维药罗欧咳祖帕抗哮喘活性评价和作用机制研究
郭朋程 王 婷 童应鹏 谢振达 姜春筱 周 戚 王建新,
(1 复旦大学药学院药剂学系,智能化递药教育部重点实验室,上海,201203; 2 复旦大学中西医结合研究院药物研究所,上海,201203; 3 台州学院,高等研究院天然产物与健康产品研究所,台州,318000)
哮喘是一种以气道炎症和气道高反应性为主要特征的慢性免疫疾病,也是最常见的儿童慢性疾病,对不同年龄段的人群均有影响,目前,全球约有3亿人患有哮喘[1-2]。哮喘的发病与环境污染密切相关,研究表明,48%的儿童哮喘与空气污染有关[3]。此外,遗传因素、影响健康的社会压力均密切相关,使其发病率和死亡率均急剧增加,尤其是中低收入的国家[4]。
维吾尔医学(简称“维医”)在哮喘的治疗上积累了丰富的临床经验,根据维医体液论,哮喘可分为异常黑胆质型哮喘、异常黏液质型哮喘、异常胆液质型哮喘[5]。异常黏液质型哮喘患者的临床表现主要体现为喉中闻及哮鸣有声、咳痰稀白、不易咯、面色白泽或晦黄、唇色淡白、口不干、胸膈满闷、大便溏薄,色淡黄气腥臭、小便清长舌质淡舌形胖,舌涎多,舌苔薄而润,或白腻,脉粗缓弱[5]。维医认为罗欧咳祖帕(LKZP)是治疗异常黏液质型哮喘的有效方剂,它主要由神香草和鸢尾根组成,具有温肺平喘、止咳化痰作用[6]。方中神香草为唇形科(Labiatea)硬尖神香草(HyssopuscuspidatusBoriss.)干燥全草,可调节异常黏液质,为主药[7];鸢尾根为鸢尾科(Iridanceae)植物喜碱鸢尾(IrishalophilaPall.)的干燥根茎,在方中主要是协助神香草清理脓性黏液质的作用[8]。药理学研究也结果显示,神香草和(或)鸢尾根均具有抗哮喘[9]、抗炎[10-11]、调节免疫力[12]等活性,但是目前还尚未对神香草和鸢尾根的组合方剂——LKZP抗哮喘的活性进行药理学评价,其抗哮喘作用机制研究也不深入,为此,本研究首先采用卵蛋白(Ovalbumin,OVA)诱导的哮喘模型小鼠评价了LKZP抗哮喘活性,随后采用网络药理学方法和分子对接技术分析了LKZP治疗哮喘的物质基础和作用机制,为后期制剂开发利用提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 BALB/c雌性小鼠,6~8周龄,体质量(20±2)g,购于上海杰思捷实验动物有限公司,合格证号为SCXK(沪)2018-0004。所有小鼠被置于模拟昼夜变化(12 h白天,12 h黑夜)的清洁室内,温度20~24 ℃,湿度50%。所有的动物实验方案均获得复旦大学实验动物伦理委员会的批准(伦理审批号:2020华山医院JS-675)。
1.1.2 药物 LKZP提取物由复旦大学药学院制备,制备方法为取神香草250 g和鸢尾根250 g,加入3.6 L水溶液,煎煮2次,1 h/次,然后浓缩至1 000 mL(相当于500 g生药材/1 000 mL),临用前稀释成15 g生药材/kg动物重量。阳性对照药为醋酸地塞米松片(浙江仙琚制药股份有限公司,国药准字H33020822)。
1.1.3 试剂与仪器 卵蛋白(OVA)(Sigma公司,美国,货号:A5503),氢氧化铝佐剂(Thermo Fisher Scientific公司,美国,货号:77161),戊巴比妥钠(Sigma公司,美国,货号:P3621进口分装),乙酰甲胆碱(Sigma公司,美国,货号:A2251)。气道阻力及肺顺应性测量系统(FinePointe RC System,Buxco公司,美国,型号:RC),光学显微镜(Nikon公司,日本,型号:ECLIPSE 80i)。
1.2 方法
1.2.1 分组与模型制备 48只小鼠适应性喂养1周后,随机分为正常组、模型组、水提组和地塞米松组。模型组、水提组和地塞米松组小鼠于第0天一次性腹腔注射OVA20 μg和氢氧化铝2 mg的生理盐水混悬液0.2 mL,使小鼠处于致敏状态。分别在第7天、第14天和第21天以相同的方法再加强致敏3次。第25天起每天超声雾化吸入3%OVA诱发哮喘约30 min,以小鼠出现呼吸加快、口唇发绀、腹肌痉挛、点头呼吸及站立不稳等表现为模型建立成功的标志,连续7 d。
1.2.2 给药方法 给药组小鼠于第24天开始灌胃服用相应的药物,每次雾化吸入前30 min给药,每次灌胃给药0.3 mL,连续灌服药物8 d。
1.2.3 哮喘小鼠气道高反应性(Airway Hyperresponsiveness,AHR)的测定 最后一次超声雾化吸入3%OVA的24 h后,用戊巴比妥钠(50 mg/kg)麻醉小鼠,然后采用气道阻力及肺顺应性测量系统测量小鼠的气道阻力。实验是通过雾化吸入不同剂量的乙酰甲胆碱(0、3.125、6.25和12.5 mg/mL)以激发小鼠发生后的产生的变化,以评估药物对哮喘小鼠AHR的影响,数据以与基线值的百分比变化表示。
1.2.4 肺组织病理学分析 AHR测定结束后,迅速取出肺组织,把肺组织周围所连接的组织剥离干净后,在4 ℃生理盐水中迅速漂洗,去除血渍和污物。将右肺上叶连同右主支气管置于4%的中性甲醛中浸泡固定,石蜡包埋,用5 μm切片进行组织病理学分析。肺切片用苏木精-伊红(Hematoxylin Eosin,HE)染色,以评估肺部组织的变化。使用光学显微镜进行拍照,并对所得图像进行分析。
1.3 基于网络药理学的LKZP抗哮喘的活性成分和作用机制研究
1.3.1 LKZP的化学成分及其作用靶点的收集和整理 通过检索国家知识基础设施数据库(China National Knowledge Infrastructure,CNKI)和web of science等数据库[13],收集硬尖神香草和喜碱鸢尾的化学成分[8-9,11,14-21],并采用chemdraw 16.0软件绘制化合物的结构式,整理成SMILES格式;将所有化合物导入SwissADME数据库(http://www.swissadme.ch/),筛选出符合Lipinski规则的化合物,再通过SwissTargetPrediction(http://www.swisstargetprediction.ch/)预测上述化合物的作用靶点。
1.3.2 LKZP抗哮喘的作用靶点 以“asthma”为关键词,分别检索在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,(https://www.omim.org/)和DisGeNET数据库(https://www.disgenet.org/)的与哮喘相关的基因[22-26],然后通过交集分析,确定LKZP作用靶点与疾病靶点的交集,上述交集靶点被认为是LKZP治疗哮喘的潜在靶点。
1.3.3 蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建 将上述交集靶点数据导入STRING数据库(https://string-db.org/)[27],物种选择为“homo sapiens”,构建PPI网络,将最小互作值设定为high confidence(0.7),同时隐藏了网络中没有连接的节点,PPI网络的分析结果以tsv数据格式导入Cytoscape 3.8.2软件中,进行拓扑分析,以Degree值大于中位数2倍的靶点作为LKZP治疗哮喘的关键靶点。
1.3.4 基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析 采用David 6.8数据库(https://david.ncifcrf.gov/tools.jsp)对LKZP治疗哮喘的关键靶点进行GO功能和KEGG信号通路的富集分析[28],采用Prism 7软件绘制GO功能柱状图,采用联川生物云分析平台(https://www.omicstudio.cn/tool/11)绘制KEGG气泡图。
1.3.5 活性成分-作用靶点-信号通路网络的构建 利用Cytoscape 3.8.2软件[29],以LKZP化学成分、抗哮喘作用靶点和信号通路为节点,将化合物及其作用的抗哮喘疾病靶点以及抗哮喘作用靶点与其富集的KEGG信号通路分别以边相连接;若化合物的作用靶点富集到某一信号通路中,则将化合物与该信号通路也以边相连接,构建出LKZP抗哮喘活性成分-作用靶点-信号通路的网络。再利用Analyze Network工具对上述网络进行分析,将化合物、靶点和信号通路三类节点中,Degree值排名前10的节点提取出来,构建出LKZP抗哮喘的核心网络,从而确定其抗哮喘关键活性成分、作用靶点及信号通路。
1.4 分子对接研究 依据1.3项下LKZP抗哮喘活性成分-作用靶点-信号通路网络的分析结果,使用ChemOffice 2014软件绘制关键活性成分的结构并使其能量最小化,保存为mol2格式;接着从PDB数据库中下载关键靶点的PDB格式数据,采用Pymol软件完成去水和去掉配体等操作;然后采用AutoDock Tools 1.5.6软件将关键活性成分和关键靶点的格式都转换为pdbqt格式;最后采用AutoDock Vina 1.1.2进行分子对接,采用Pymol软件进行可视化操作。
1.5 统计学方法 采用SPSS 21.0统计软件进行数据分析,组间比较采用t检验,以P<0.05为差异有统计学意义。采用GraphPad Prism 8.0软件作图。
2 结果
2.1 LKZP对哮喘小鼠气道高反应性的影响 如图1所示,随着乙酰甲胆碱剂量的增加,短期OVA致敏和激发能够明显增加小鼠气道阻力,在12.5 mg/mL乙酰甲胆碱剂量下,小鼠气道阻力(P<0.01)增加尤为显著。与哮喘模型组比较,水提组能显著降低气道阻力。随着乙酰甲胆碱剂量增加,降低气道阻力的作用越明显(P<0.05),且与阳性对照药物地塞米松组差别无统计学意义(P>0.05)。
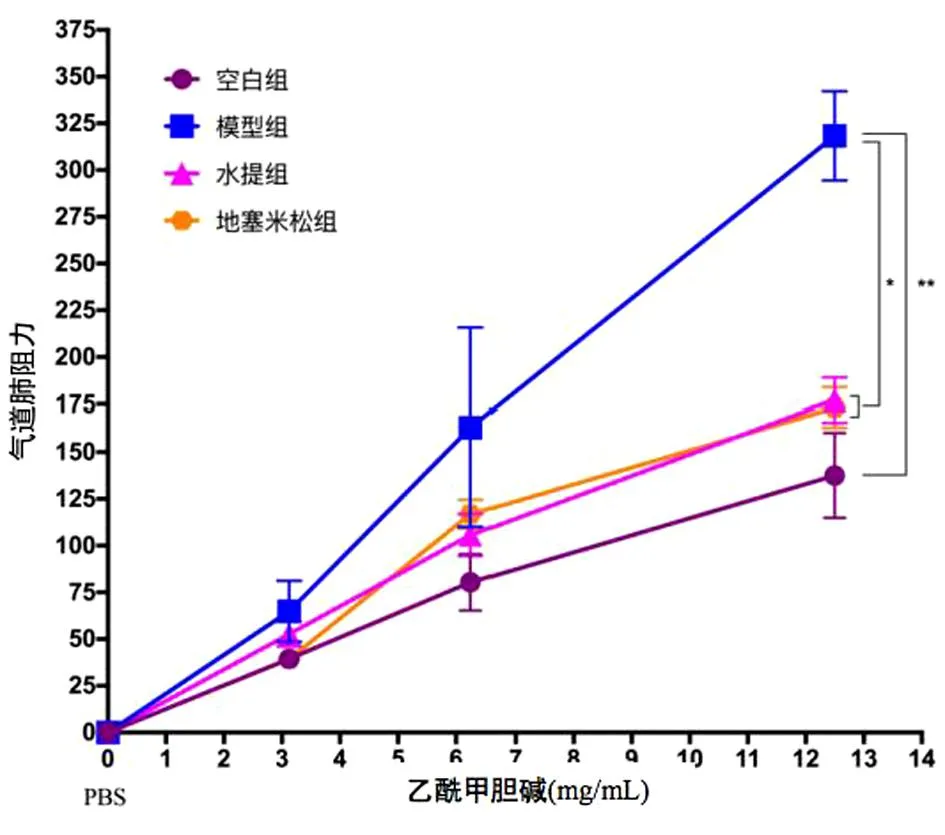
图1 LKZP对哮喘小鼠气道高反应性的影响
2.2 LKZP不同提取物对哮喘小鼠肺组织病变的影响 肺部病理学结果显示,正常组中肺组织支气管结构、轮廓相对完整。与正常小鼠比较,OVA激发引起大量炎症细胞向支气管周围浸润,OVA诱导的哮喘小鼠肺部有大量黏液分泌,炎性细胞大量浸润,基底膜显著增厚,气管平滑肌明显增厚,肺组织结构被破坏。LKZP水提取物干预显著降低支气管和血管周围炎症细胞浸润,缓解气道的损伤,改善平滑肌的增厚。见图2。
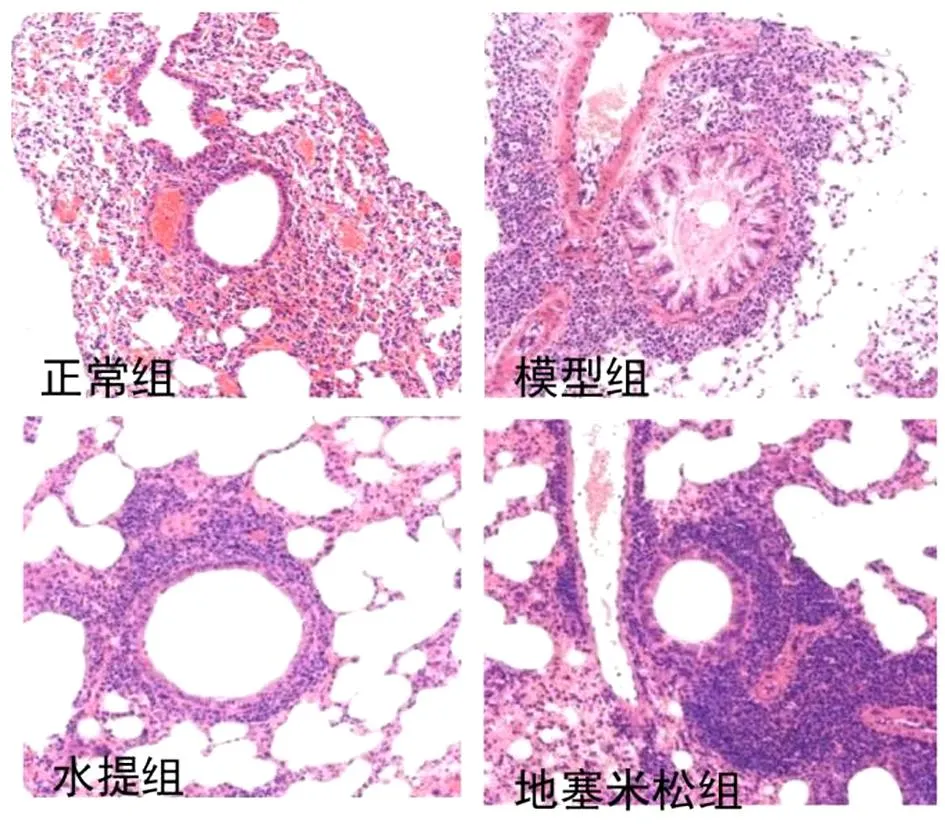
图2 LKZP对哮喘小鼠肺组织病理学的影响(HE染色,×200)
2.3 LKZP抗哮喘网络药理学的研究结果
2.3.1 LKZP潜在活性成分和潜在靶点 LKZP中符合Lipinski规则的化合物共有136个,其中硬尖神香草和喜碱鸢尾根的成分分别有53个和83个。在SwissTargetPrediction数据库中共获得上述成分的无重复作用靶点共841个。
2.3.2 PPI网络的构建与分析 通过LKZP作用靶点与哮喘疾病靶点的交集分析,共获得312个交集靶点。在由STRING数据库和Cytoscape 3.8.2软件绘制的PPI网络中,共含有297个节点和2 457条边,节点Degree值的中位数为12,其中Degree值>24的核心靶点共66个。
2.3.3 核心靶点的GO功能富集及KEGG通路富集分析 依据DAVID数据库对66个核心靶点的GO功能和KEGG信号通路分析结果,发现共有391个GO条目(P<0.05),其中生物过程(Biological Process,BP),细胞组分(Cellular Component,CC)和分子功能(Molecular Function,MF)的条目分别有298、32和61条,分别占条目总数的76.21%,8.18%和15.60%。见图3A。每组前10个条目的GO富集分析条形图见图3B(按照P值从小到大排列)。由此可见,LKZP的核心靶点主要参与了胞质钙离子浓度的正调控(Positive Regulation of Cytosolic Calcium Ion Concentration)、血小板活化(Platelet Activation)、炎症反应(Inflammatory Response)、一氧化氮生物合成过程的正调控(Positive Regulation of Nitric Oxide Biosynthetic Process)、磷脂酰肌醇3-激酶信号转导的调控(Regulation of Phosphatidylinositol 3-kinase Signaling)、RNA聚合酶Ⅱ启动子转录的正调控(Positive Regulation of Transcription from RNA PolymeraseⅡ Promoter)、平滑肌细胞增殖的正调控(Positive Regulation of Smooth Muscle Cell Proliferation)、ERK1和ERK2级联的正调控(Positive Regulation of ERK1 and ERK2 Cascade)、磷脂酰肌醇介导的信号转导(Phosphatidylinositol-mediated Signaling)和脂多糖介导的信号通路(Lipopolysaccharide-mediated Signaling Pathway)等生物过程。细胞组分主要涉及质膜(Plasma Membrane)、质膜的组成部分(Integral Component of Plasma Membrane)、磷脂酰肌醇3-激酶复合物(Phosphatidylinositol 3-kinase Complex)、细胞质(Cytoplasml)、蛋白质复合物(Protein Complex)等方面。分子功能主要与蛋白磷酸酶结合(Protein Phosphatase Binding)、酶结合(Enzyme Binding)、相同蛋白结合(Identical Protein Binding)、蛋白结合(Protein Binding)、磷脂酰肌醇-4、5-二磷酸3-激酶活性(Phosphatidylinositol-4,5-bisphosphate 3-kinase Activity)等有关。
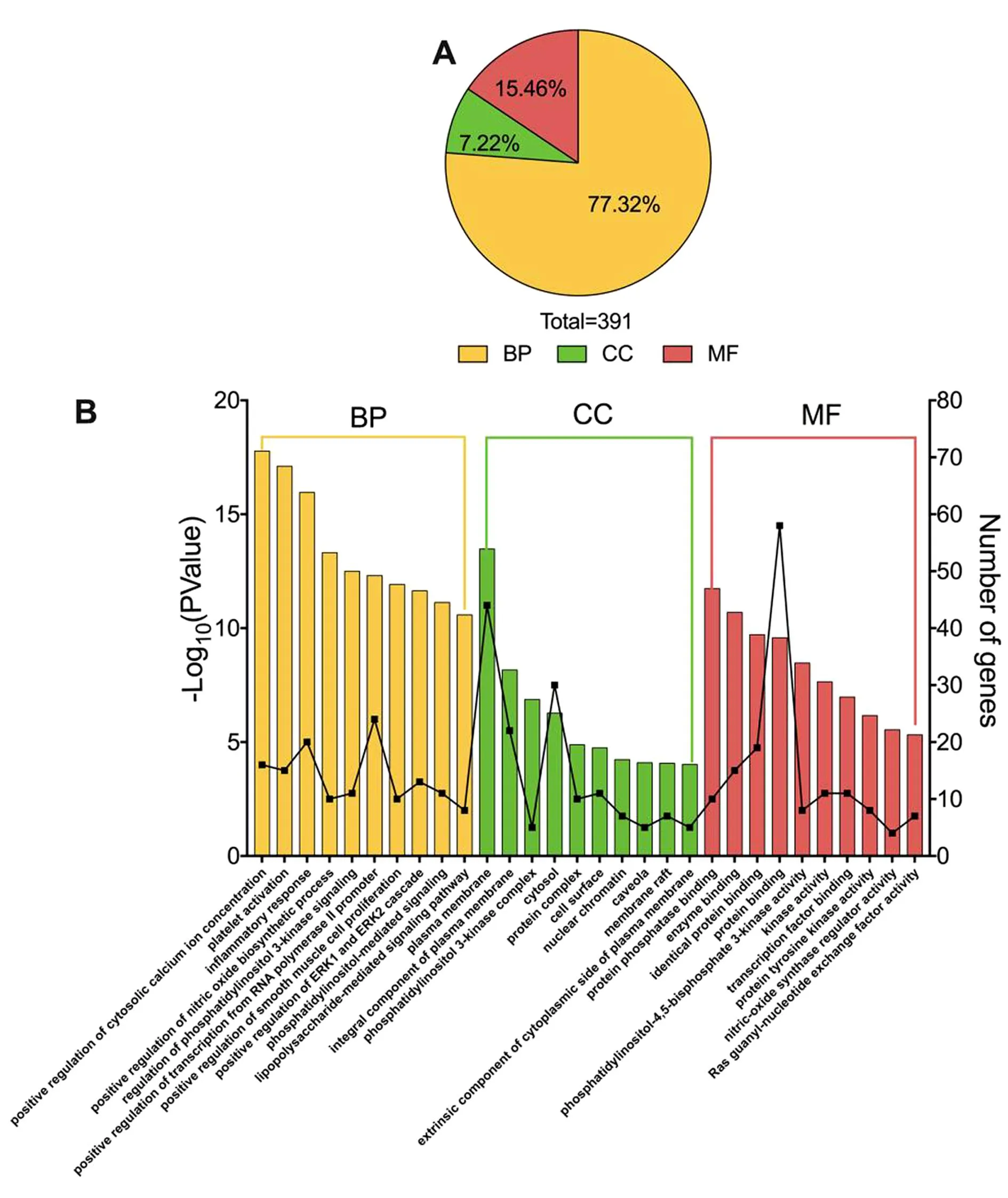
图3 LKZP作用靶点的GO功能分析
共富集得到了119条信号通路(P<0.05),其中有39条信号通路的P<1×10-9。在上述39条信号通路中,有16条与疾病相关的途径,又分为癌症和微生物感染性疾病等2大类。见图4A。在非疾病信号通路中。见图4B。有12条信号通路是与调节炎症反应相关,包括PI3K-AKT信号通路(PI3K-AKT Signaling Pathway,hsa04151)、FcεRI信号通路(Fc Epsilon RI Signaling Pathway,hsa04664)、TNF信号通路(TNF Signaling Pathway,hsa04668)、ErbB信号通路(ErbB Signaling Pathway,hsa04012)、Toll样受体信号通路(Toll-like Receptor Signaling Pathway,hsa04620)、催乳素信号通路(Prolactin Signaling Pathway,hsa04917)、T细胞受体信号通路(T cell Receptor Signaling Pathway,hsa04660)、自然杀伤细胞介导细胞毒性(Natural Killer Cell Mediated Cytotoxicity,hsa04650)、趋化因子信号通路(Chemokine Signaling Pathway,hsa04062)、白细胞跨内皮迁移(Leukocyte Transendothelial Migration,hsa04670)、Jak-STAT信号通路(Jak-STAT Signaling Pathway,hsa04630)和B细胞受体信号通路(B Cell Receptor Signaling Pathway,hsa04662)等。有3条信号通路是与调节支气管血管有关的,包括HIF-1信号通路(HIF-1 Signaling Pathway,hsa04066)、VEGF信号通路(VEGF Signaling Pathway,hsa04370)和钙信号通路(Calcium Signaling Pathway,hsa04020)。剩余的8条信号通路,包括鞘脂信号通路(Sphingolipid Signaling Pathway,hsa04071)、破骨细胞分化(Osteoclast Differentiation,hsa04380)、FoxO信号通路(FoxO Signaling Pathway,hsa04068)、甲状腺激素信号通路(Thyroid Hormone Signaling Pathway,hsa04919)、黏着斑(Focal Adhesion,hsa04510)、雌激素信号通路(Estrogen Signaling Pathway,hsa04915)、mTOR信号通路(mTOR Signaling Pathway,hsa04150)和胰岛素抵抗(Insulin Resistance,hsa04931)等。
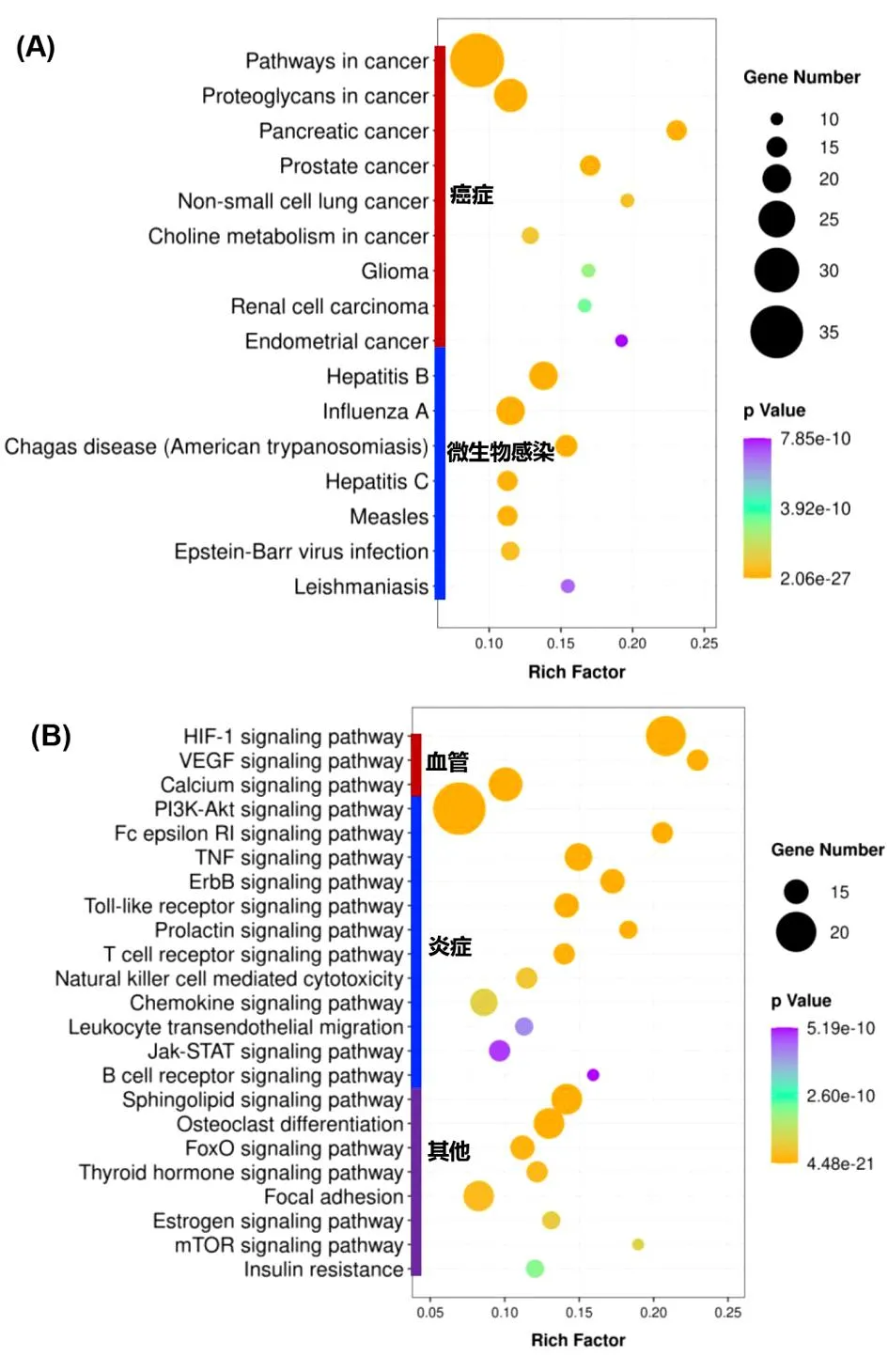
图4 LKZP核心靶点富集的KEGG信号通路
2.3.4 活性成分-作用靶点-信号通路网络的分析 在构建的LKZP抗哮喘的“活性成分-核心靶点-信号通路”的网络中(图5A),共包含了120个化合物(绿色和黄色节点分别代表来源于硬尖神香草和喜碱鸢尾的化学成分)、66个核心靶点(蓝色节点)及其富集到的119条信号通路(红色节点),上述3类节点的中位数Degree值分别为80、25和76,说明LKZP中很多化合物可以干预多个作用靶点,从而作用于多条信号通路。而在LKZP抗哮喘“活性成分-核心靶点-信号通路”的核心网络中(图5B),化合物、靶点和信号通路等三类节点的平均Degree值可达到118.5、79.9和117.2,均远高于Degree中位数值,因此,这些靶点是LKZP抗哮喘作用网络中的关键枢纽。
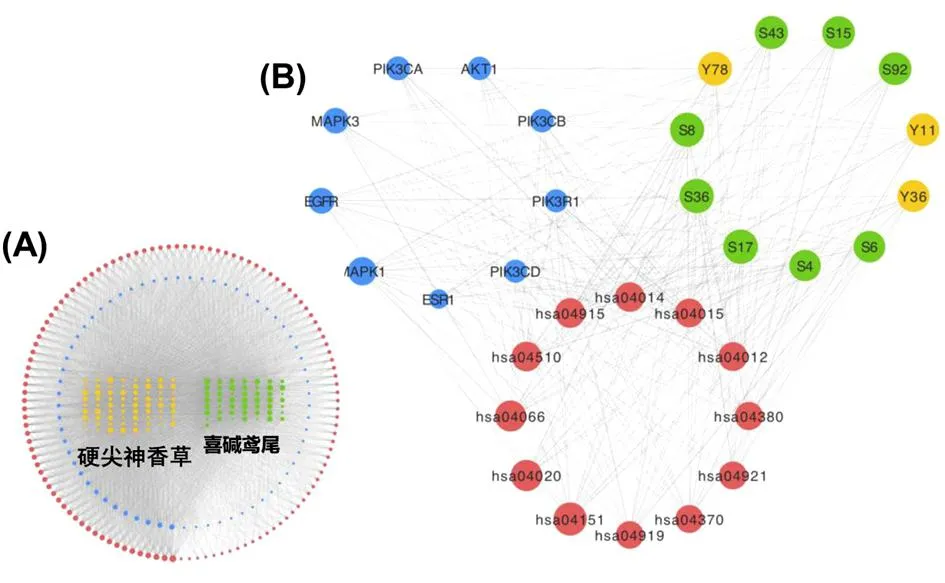
图5 LKZP化学成分-作用靶点-信号通路的网络(A)及其核心网络(B)
从图5B和表1中也可知,LKZP可能主要通过作用于MAPK1、EGFR、MAPK3、PIK3CA、AKT1、PIK3CB、PIK3CD、PIK3R1、PRKCA、ESR1等关键靶标发挥治疗哮喘的作用。其中MAPK1和MAPK3为编码细胞外信号调节蛋白激酶(ERK),PIK3CA、PIK3CB、PIK3CD和PIK3R1均编码磷脂酰肌醇-3-激酶(PI3K),EGFR、AKT1、PRKCA和ESR1分别编码表皮生长因子受体蛋白(EGFR)、丝氨酸/苏氨酸蛋白激酶1(AKT1)、蛋白激酶C alpha(PKCα)和雌激素受体1(ESR1)。
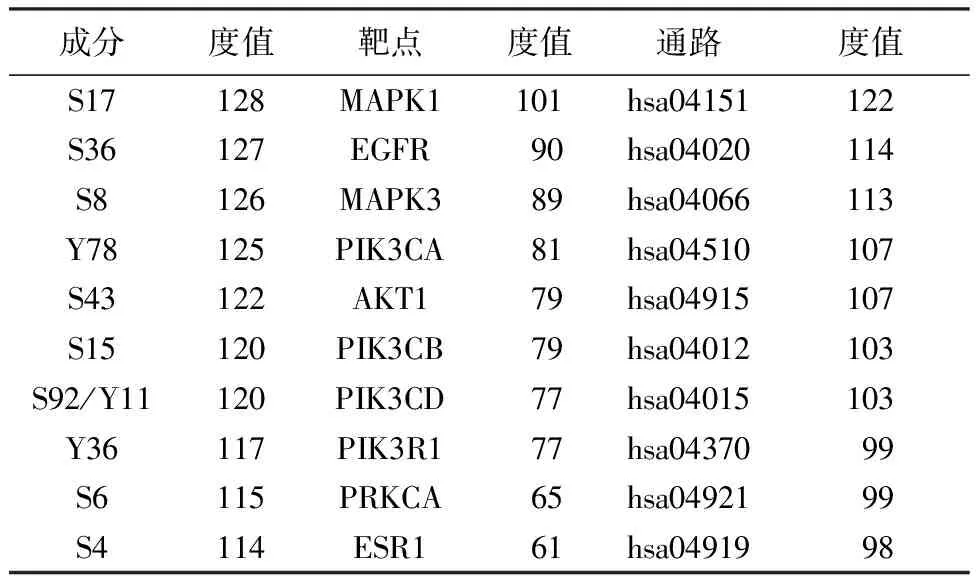
表1 LKZP抗哮喘的潜在活性成分、作用靶点和信号通路
LKZP作用的关键信号通路包括HIF-1信号通路(hsa04066)、VEGF信号通路(hsa04370)、钙信号通路(hsa04020)、PI3K-AKT信号通路(hsa04151)、ErbB信号通路(hsa04012)、甲状腺激素信号通路(hsa04919)、黏着斑(hsa04510)、雌激素信号通路(hsa04915)、Rap1信号通路(Rap1 signaling pathway,hsa04015)、催产素信号通路(Oxytocin signaling pathway,hsa04921)。这些信号通路基本和调节炎症反应和支气管血管有关。
按照化学结构分类,LKZP中治疗哮喘的关键活性成分可以分为3大类。见表1和图6。分别为萜类,共计6种,包括(7S,10R)-11-hydroxy-4,5-seco-guai-1-ene-4-one(S15)、desacetylmatricarin(S36)、(4aR,5R)-6-hydroxy-4a,5-dimethyl-3-(prop-1-en-2-yl)-3,4,4a,5,6,7-hexahydronaphthalen-1(2H)-one(S8)、Hyssopusin A(S17)、eudesmane-1β,5α,11-triol(S4)和Cryptomeridiol(S6);苯丙素类成分2种,包括Caffeic Acid(S92,Y11)和(+)-isolariciresinol(S43);黄酮类成分2种,分别为5,6,7,4′-tetrahydroxy-8-methoxy isoflavone(Y78)和Naringenin(Y36)。其中来源于神香草和鸢尾根的活性成分分别有8种和3种,二者共有成分有1种,为Caffeic Acid。
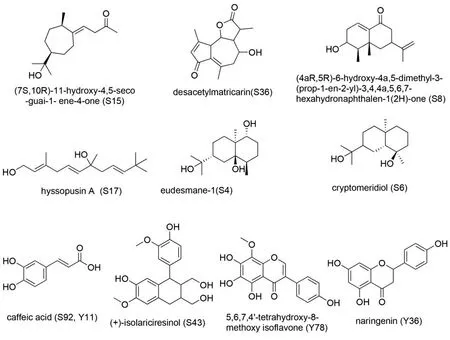
图6 LKZP治疗哮喘潜在的关键活性成分
2.4 分子对接分析 将LKZP抗哮喘的7个关键核心靶点蛋白ESR1(1A52)、EGFR(1M17)、AKT1(1UNQ)、MAPK1(2Y9Q)、PIK3CA(4JPS)、MAPK3(4QTB)和PIK3CD(5DXU)与前10种关键活性成分进行了分子对接。从表2可知,仅AKT1与Hyssopusin A(S17)、Caffeic Acid(S92,Y11)之间的结合能>-5 kcal/mol;结合能<-7 kcal/mol(1 cal=4.184 J)的有43组,占总数的61.42%。并且有5组之间的结合能<-9.0 kcal/mol,分别为MAPK1与Desacetylmatricarin(S36)、5,6,7,4′-tetrahydroxy-8-methoxy isoflavone(Y78),MAPK3与Desacetylmatricarin(S36)、5,6,7,4′-tetrahydroxy-8-methoxy isoflavone(Y78)、Naringenin(Y36),二者的共有高结合能成分为Desacetylmatricarin(S36)、5,6,7,4′-tetrahydroxy-8-methoxy isoflavone(Y78),其与MAPK1和MAPK3的结合模式见图7。其中MAPK1与Desacetylmatricarin结合的氨基酸残基为LYS-54 GLN-105和LYS-114,MAPK1与5,6,7,4′-tetrahydroxy-8-methoxy isoflavone结合的氨基酸残基为LYS-54和MET-108,二者相同的氨基酸残基为LYS-54;MAPK3与desacetylmatricarin和5,6,7,4′-tetrahydroxy-8-methoxy isoflavone则没有相同的氨基酸残基。
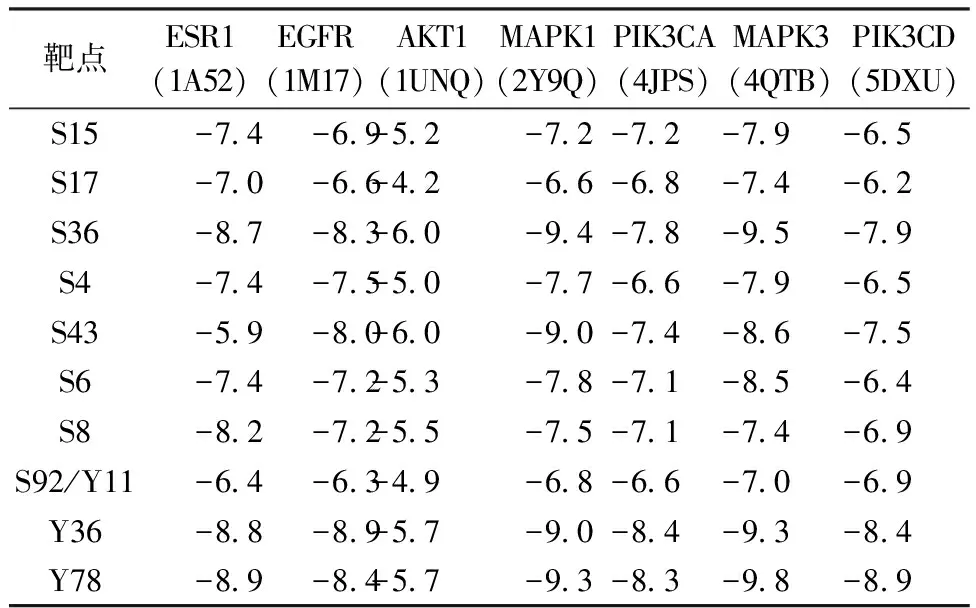
表2 LKZP抗哮喘关键靶点与活性成分之间的结合能
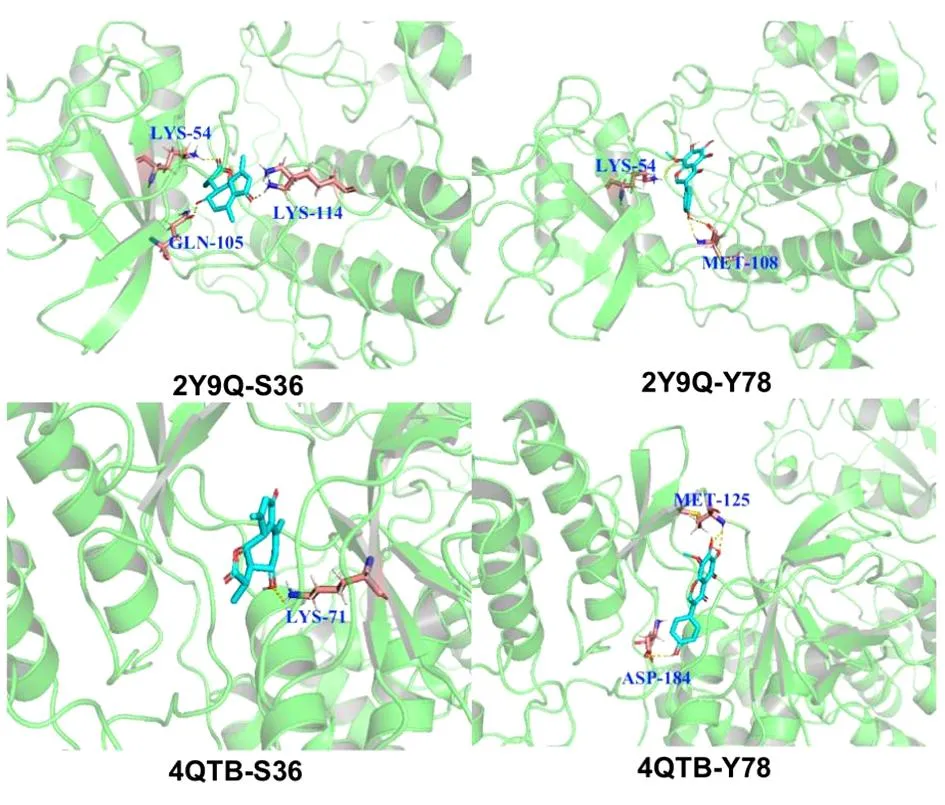
图7 LKZP抗哮喘关键靶点与活性成分分子对接可视化
3 讨论
哮喘是由多种气道炎症细胞和细胞组分参与的气道慢性炎症性疾病,在临床治疗上,药物首先需要抑制炎症细胞活化和介导产生抗炎因子,以减轻气道炎症反应,缓解哮喘症状。实验中LKZP水提组能显著降低气道阻力,同时病理结果LKZP水提组中OVA诱导的哮喘小鼠肺部有大量黏液分泌,炎症细胞大量浸润,基底膜显著增厚,气管平滑肌明显增厚,肺组织结构被破坏的情况具有改善作用。本研究发现,LKZP治疗哮喘的排前10位关键靶点中,至少有8个靶点是参与介导了炎症反应,包括MAPK、PI3K、AKT、PKC等,它们可能主要参与介导HIF-1信号通路、PI3K-AKT信号通路、ErbB信号通路等与炎症反应密切相关的通路。在LKZP治疗哮喘的潜在活性成分中,有6种倍半萜类成分(S15,S36,S8,S17,S4和S6),这些成分均来源于神香草,已有研究表明,神香草中的倍半萜类成分能够抑制脂多糖诱导的RAW264.7细胞NO的释放[19]。此外,黄酮类成分也能减轻气道炎症反应,如周旋等[30]利用OVA诱导建立哮喘大鼠模型发现柚皮素(Y36)能显著性降低哮喘大鼠的气道炎症反应。
气道重塑也是哮喘的重要病理机制之一,它与气道炎症在哮喘的发病机制中起同样重要的作用。细胞内钙离子(Intracellular Ca2+)可以调控气道平滑肌的收缩,影响气道平滑肌管径大小和气道阻力大小,对气道重塑发挥重要作用[31]。有研究表明,血管内皮生长因子通过刺激内皮细胞释放相应的因子导致平滑肌细胞增殖是气道重塑的前提条件[32]。缺氧诱导因子-1(Hypoxia-inducible Factor-1,HIF-1)可调控血管内皮生长因子的表达,因此也被认为参与了哮喘的气道重塑[32]。本研究发现,LKZP的化学成分可能可以通过同时调控钙信号通路、VEGF信号通路和HIF-1信号通路等发挥调控气道重塑的作用的。很多黄酮类成分都可以通过调节钙离子水平,舒张血管平滑肌[33]。
此外,LKZP还可能通过作用于雌激素信号通路发挥治疗哮喘的作用,目前发现女性哮喘患者的临床症状更各生命阶段(青春期、月经期、怀孕和更年期)有关,推测哮喘可能与雌激素密切相关[34]。而雌激素有可能是通过干预核因子κB/NLRP3信号通路减轻气道炎症,从而缓解哮喘症状的[35]。
本研究通过网络药理学的研究方法对维药LKZP治疗哮喘的潜在活性成分和作用机制进行预测,结果发现LKZP中的倍半萜类、黄酮类和苯丙素类成分可能是其治疗哮喘的主要活性成分,它们主要通过调节气道炎症和气道重塑发挥哮喘的治疗作用。
利益冲突声明:无。

