新型同种异体骨修复骨缺损对动物生理生化指标的影响
朱力鸣 焦 昆 刘 伟 李胜利*
(1.首都医科大学实验动物部,北京 100069,2.北京化工大学材料科学与工程学院,北京 100029)
在临床治疗中,因外伤、退行性病变、先天畸形、骨肿瘤、种植牙、牙周疾病、开颅手术等各种原因导致的骨缺损十分常见,尤其在骨科、口腔科、神经外科等领域的患者较为集中。在患者伴随有疾病的情况下或骨缺损超过临界尺寸时,缺损部位很难通过自身的再生修复,此时则需要外加治疗性干预[1-2]。据统计,我国每年约400万人需要进行植骨治疗[3]。
根据骨移植材料在体内的骨形成特性,理想的植骨移植材料应具有骨生成性、骨诱导性、骨引导性[4]。组织工程学和生物材料学被认为是发展再生移植修复骨缺损的重要方式。单纯的人工骨材料仅能作为骨引导的支架,缺乏诱导成骨能力,成骨速度慢,效果欠佳,需植入有骨诱导性或骨生成性的移植材料。组织工程学将生物材料、细胞以及生物活性分子结合起来,能够恢复或改善受损或病变组织的生物功能[5]。在组织工程学中,为了提高细胞活力、附着、增殖和归巢、成骨分化、血管生成、宿主整合和承重[6],学界研究了包括硫酸软骨素在内的大量的支架材料[7-9]。传统的骨组织工程研究通过将种子细胞接种在支架材料上植入骨缺损处进行修复,但这种方式存在种子细胞凋亡、引发免疫炎症反应等缺陷,这将削弱修复效果[10]。为解决此不足,有学者[11]提出“原位组织工程”的概念,构建具有高成骨响应的材料,通过身体的再生潜力加速诱导缺损部位的修复过程。人工骨替代材料也具有各自的优势和缺点,磷酸钙陶瓷与骨有着相似的化学组成,但其溶解性影响破骨细胞的活性[12],高分子聚合物具有生物活性但机械强度低[13]。
自体骨移植被认为是骨移植的“金标准”,虽然优势突出,但其供骨部位的并发症却不容忽视。同种异体骨移植尽管也有疾病传播和免疫排斥等并发症[14-15]的潜在风险,但随着相关研究的深入,以及制作技术的改进和提高,其作为异体移植材料的并发症已显著降低,目前已成为治疗骨缺损的一个重要选择,成为当前骨移植材料的热点研究方向。本文研究旨在探讨新型同种异体骨材料修补骨缺损过程中对动物体质量、血常规与生化指标的影响,通过实验组、对照组、空白对照组的比较,对使用该植入材料修补骨缺损的安全性进行评估,为进一步临床试验提供数据。
1 材料与方法
1.1 材料
1.1.1 实验动物
成年普通级新西兰兔,60只,体质量2.2 kg以上,雄性,购自北京富豪实验动物养殖中心[实验动物生产许可证号:SCXK(京)2019-0015],饲养于首都医科大学实验动物部[实验动物使用许可证号:SYXK(京)2018-0003],实验动物质量控制及饲养环境均符合国家相关标准规定[16-17]。采用随机数字分配法将60只动物随机分成3组,分别为实验组、对照组和空白对照组,每组均20只动物。对于上述3组动物,分别在手术后的第1周、4周、8周和12周时取5只动物,测体质量、抽血检测血常规及生理生化指标。本文研究通过首都医科大学动物实验及实验动物管理委员会批准(动物实验伦理审查批号:AEEI-2022-083)。
1.1.2 试剂与仪器
供试品:同种异体骨(批号:TZG-S1-211124。型号规格:松质骨小块,DG-SZGXK,0.5 g;皮质骨粒,DG-PZGL-3,0.5 g),由北京桀亚莱福生物技术有限责任公司提供,干燥避光密闭保存,每次使用前用适量无菌0.9%氯化钠注射液(以下简称生理盐水)配制供试品,并在2~3 h内使用完毕。对照品:市售同种骨植入材料。主要仪器:SANKYO-CA800全自动全血细胞计数仪,EOS-BRAVO-FORTE全自动生化分析仪,Strong 204精密微型研磨机。
1.2 方法
1.2.1 动物模型制备方法
将兔称质量后,进行全身麻醉(麻醉剂:氯雷他定片0.03 mL/kg+异戊巴比妥钠0.1 mL/kg),保定,取侧卧位,备皮(半径约3 cm),消毒,铺无菌巾。避开皮下血管,逐层切开皮肤、皮下组织及筋膜,切口为2 cm,分离肌群,暴露股骨外侧面。在股骨近心端之外缘、大转子下缘1 cm处,用直径4 mm球头精密研磨机制备骨缺损,深度以不打穿髓腔、目视可见红色骨髓为度(防止骨髓腔开放后暴露的髓内干细胞自愈合能力的干扰)。此时,骨缺损深度约为1 mm,骨缺损体积约为5.24 mm3。制造骨缺损时予以生理盐水冲洗降温。用同样的方法处理对侧股骨。在实验组(供试品)和对照组(对照品)动物的左股骨缺损区填充皮质骨粒,右股骨缺损区填充松质骨小块,轻压填紧,尽量使材料与骨缺损密合。分层缝合。空白组动物进行上述同样手术,不填充任何材料。术后给予每只动物肌肉注射青霉素钠溶液80万单位,连续3 d。
1.2.2 日常观察
临床观察:动物进入实验室后,每天对其外观体征和行为活动的情况进行详细的观察,包括精神状况、进食、大小便及口、鼻、眼、耳异常分泌物和被毛等方面的变化进行记录。
体质量测量:手术前、病理取材前各称量一次并记录。
与改款前相同的是,新一代C级车继续提供长轴距轿车、长轴距运动轿车以及标准轴距运动版三种车型,外观风格上的升级也让三款车型的辨识度更高。新一代C级长轴距轿车前杠上的进气格栅更加宽大,搭配经典的“三线中网”和立标后气质更显庄重。新一代C级长轴距运动轿车选择了AMG风格的外观,采用星辉格栅、中网大标和AMG车身套件。新一代C级标准轴距运动版则选择了更简洁的“双线中网”与大标搭配,与发动机盖上的双凸起棱线和AMG车身套件一起营造出更运动的视觉效果。
1.2.3 血常规及生化指标的检测
术后第1周、4周、8周、12周对3组动物经后肢隐静脉取血,抗凝处理后立即进行血液检测。从后肢隐静脉取全血约2 mL,注入离心管中,室温静置1 h以上,然后离心提取血清用于血清生化指标检测,分别用以评价供试品、对照品对肝功能、肾功能、血糖、血脂、蛋白代谢和身体酸碱平衡等重要生理指标的影响。
1.3 统计学方法
应用SPSS 22.0软件对数据进行统计。统计方法为双因素方差分析,采用LSD多重比较检验法进行组间两两比较,以确定不同时间点各组的试验结果差异是否有统计学意义。以P<0.05为差异有统计学意义。
2 结果
2.1 日常观察
实验组动物外观体征、行为活动、毛发光泽、精神状态、饮食摄入、粪便感观与对照组和空白对照组存活动物比较无明显差别。实验过程中,对照组和空白对照组动物在术后2周时分别出现部分个体死亡。上述死亡动物在术后逐步出现食欲下降,精神萎靡,被毛凌乱,粪便稀软。经病理剖检,在上述死亡动物肠道内可见线虫,身体和器官检查未见肉眼可见之其他病理变化。鉴于空白对照组动物也出现与对照组动物类似症状及死亡现象,综合考虑,分析其死亡原因可能是麻醉及手术刺激加大了对感染寄生虫的实验样本的影响(按照《实验动物国家标准》[16]规定,普通级实验兔并不要求必须排除蠕虫),导致动物食欲减退,营养不良,最终逐步衰竭死亡。
2.2 体质量
实验期内,术后一周,3组动物体质量均有轻度下降,下降幅度在0.2 kg到0.4 kg之间,基本上不超过体质量的10%,这是动物对手术的一种应激反应。一周之后,随着伤口的愈合,手术对动物的不利影响逐步减小,实验动物体质量多数呈增加趋势。但在各实验周期内,实验组和空白对照组之间体质量变化比较差异无统计学意义(P>0.05)(图1)。
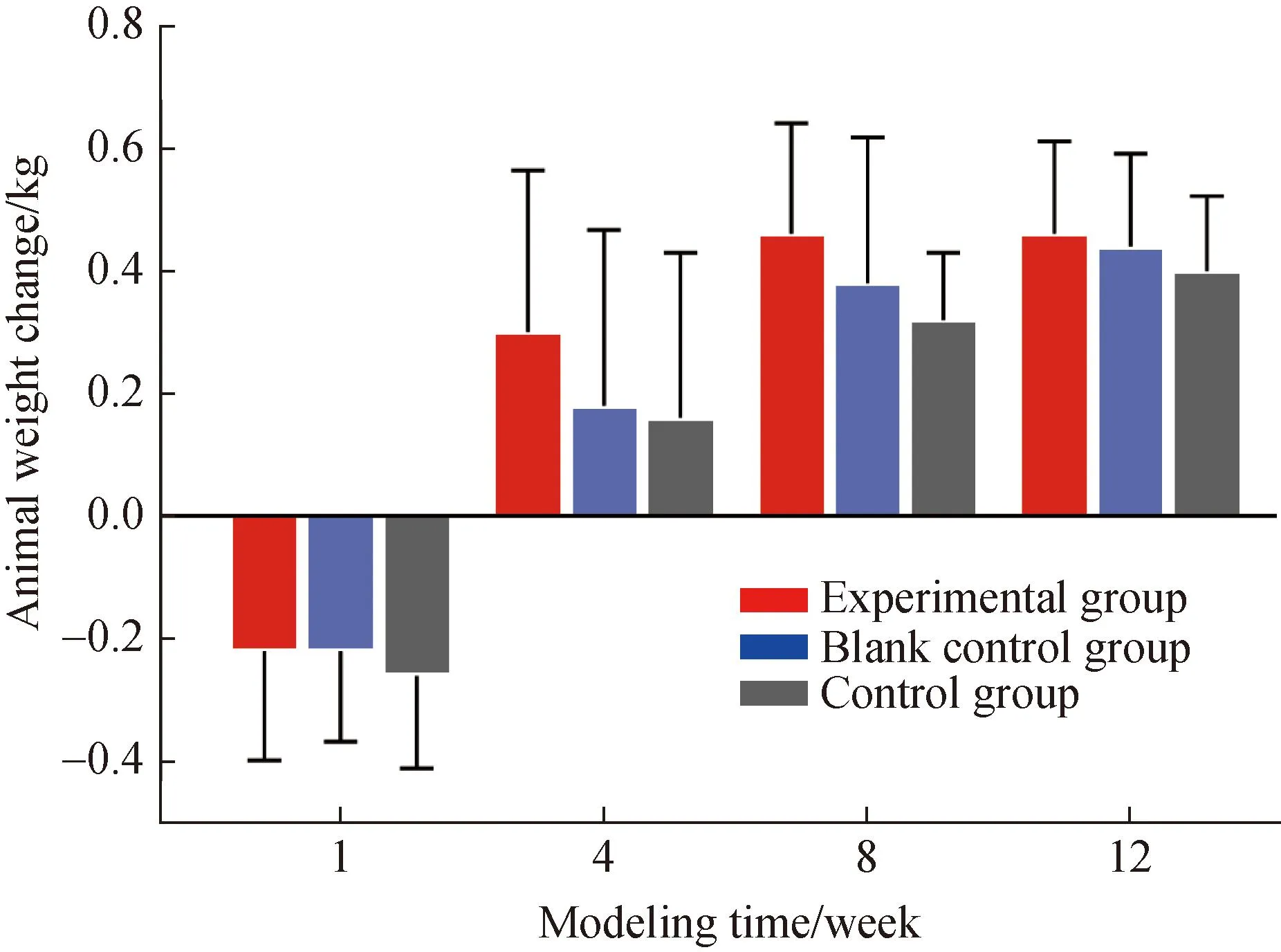
图1 各时间点3组动物体质量变化Fig.1 Changes of body weight of the 3 groups at each time point
2.3 血常规
分析术后1周时血常规中各项指标,实验组动物中性粒细胞数目与对照组及空白对照组比较,差异有统计学意义(P<0.05),结果详见表1。其他各项指标均在正常范围之内,考虑为术后机体正常反应,无病理学意义。

表1 动物血常规检查结果Tab.1 Results of blood routine examination
4周、8周和12周得到的血常规结果,实验组动物指标均在正常范围内,且实验组各项指标与对照组和空白对照组比较,差异无统计学意义(P>0.05),表明植入供试品对动物的血液系统、造血功能并无不良影响。
2.4 血清生化检测结果
血清生化项目检测结果及数据统计分析结果见表2。本次实验过程中,实验组各项生化指标基本正常。8周时,实验组的葡萄糖检测数据与空白对照组比较,差异有统计学意义(P<0.05),但检测值均在正常范围内。实验第12周检测,实验组与空白对照组比较,葡萄糖及三酰甘油两项指标差异有统计学意义(P<0.05)。原始检测数据显示,空白对照组中有一个样本的葡萄糖检测数据(12.13 mmol/L)偏离参考范围(4.17 mmol/L~9.5 mmol/L),导致该组数据平均值偏大(平均值为10.37±1.54);这也是两组之间三酰甘油检测值差异出现的原因。第12周时,比较对照组与实验组的丙氨酸氨基转移酶检测值,差异具有统计学意义(P<0.01);对照组与空白对照组比较,二者之间在该指标上差异也具有统计学意义(P<0.05)。究其原因,在于对照品组中有两个样本的丙氨酸氨基转移酶检测值(分别为124 U/L和133 U/L)远远高于参考范围(5 U/L~106 U/L)。其他各项指标,在三组动物间两两比较,差异均无统计学意义(P>0.05)。

表2 动物血清生化检查结果Tab.2 Results of serum biochemical examination
分析血清生化指标的实验数据表明,供试品的植入可能对受体动物的生物化学反应及代谢产生一定影响,但这仍是机体的正常反应,在本文实验过程中植入供试品对动物肝功能、肾功能、血糖、血脂、蛋白代谢和身体酸碱平衡等没有产生不良影响。
3 讨论
本试验以成年雄性新西兰兔为实验材料,制作骨缺损疾病模型,填充皮质骨粒或松质骨小块以探究骨修复效果。新西兰兔作为一种封闭群动物,其动物个体之间具有丰富的遗传异质性,在开展人类遗传研究、药物筛选和毒性试验等方面起着不可替代的作用[18]。其免疫排斥性灵敏,是适合开展同种异体骨移植生物兼容性研究的优选实验动物。血常规结果显示,1周时血常规的各项指标,实验组动物除中性粒细胞稍高于参考值外,其他各项指标均正常;4周、8周和12周时实验组动物血常规指标均在正常范围内。淋巴细胞与机体的免疫反应及炎症密切相关,在细胞免疫及白细胞的趋化作用中发挥着重要作用。中性粒细胞在临床诊断时被作为判断急性炎症的重要指标,多出现于急性炎症、化脓性炎症及炎症早期的循环血液中[19]。实验组动物炎性细胞检测数据与空白对照组和对照组两两比较,差异均无统计学意义,分析该系列指标的波动为术后机体正常反应,无病理学意义,表明该新型同种异体骨的低免疫诱导性具备一定的植入安全性。血清生化数据表明,实验组各项生化指标基本正常,仅在4周时实验组个别动物样本出现葡萄糖、胆固醇偏高,但这两项指标的检测值与空白对照组比较差异均无统计学意义(P>0.05),分析可能为个体差异所导致。另外,尽管4周时空白对照组中有一个样本的肌酐和三酰甘油数据偏离参考范围,致使空白对照组平均值偏离标准值较多,但实验组与空白对照组比较,二者之间差异无统计学意义(P>0.05)。12周时比较实验组与对照组的丙氨酸氨基转移酶检测值,两者差异有统计学意义(P<0.05)。但原始检测数据显示,该项指标检测值均在正常范围内。
本文实验中动物造模时对局部骨膜造成一定破坏,可能在一定程度上影响局部血供及血管生成,而血管生成在加速骨折愈合中的作用已经成为共识[20]。同时,既往研究[21]认为,骨损伤时可导致微循环障碍,而微循环障碍不仅与血管生成有关,而且与脂质代谢有关,可能导致脂质代谢紊乱[22]。根据本文实验生化检查结果分析,供试品的植入可能对受体动物的生物化学反应及代谢产生一定影响,但这种变化并未导致动物出现病理反应,可视为其机体的适应性调节。
本文实验提示该新型骨修复材料具有一定的安全性和有效性,为后续临床试验和应用提供了一定的支持证据。既往研究[20]表明,松质骨的孔隙度和性别具有相关性,本文实验动物均选用了雄性兔,可能对结果造成一定的影响。另外,本文实验所使用的材料在修复骨缺损过程中,是否会受到性激素的影响,有待于在后续研究中进一步探讨。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明朱力鸣:动物模型制作,数据分析处理,论文撰写;焦昆:动物模型制作,数据质量审核,论文审订;刘伟:提出研究思路,设计研究方案,实验协调;李胜利:总体把关,论文审定。

