识别α-synuclein N端结构域的单克隆抗体鉴定及免疫应用
贾焕珍 焦 洁 高 歌#* 杨 慧#*
(1.首都医科大学燕京医学院中心实验室,北京 101321;2.首都医科大学基础医学院神经生物学系 北京脑重大疾病研究院帕金森病研究所 北京市神经再生修复重点实验室 神经变性病教育部重点实验室, 北京 100069)
帕金森病(Parkinson’s disease, PD)是第二大神经退行性疾病,其主要病理特征是黑质致密部多巴胺能神经元变性、丢失及残存神经元中路易体的形成。PD除了出现肌僵直、运动迟缓、静止性震颤、姿势步态异常等运动症状外,还出现嗅觉障碍、便秘、快速动眼睡眠障碍等非运动障碍,并且非运动症状出现早于运动症状10~20年,当患者出现运动症状后,其疾病已经到不可挽回的地步,因此对于PD的早期诊断和治疗显得尤为重要。α-突触核蛋白(α-synuclein,α-syn)是PD患者脑中路易体的主要成分,对疾病的发生发展起到关键作用。在生理条件下,α-syn不仅存在于黑质、丘脑、皮质和海马以及神经胶质细胞,也在心脏、肌肉等外周组织中表达。它能结合突触囊泡并调节神经递质的释放,在突触功能和可塑性中起重要作用[1],它能促进囊泡与细胞膜结合,维持线粒体内钙稳态,增强内质网和线粒体膜之间的相互作用[2]。而在病理状态下,α-syn失去其天然结构并聚集成富含β片的原纤维残基, 第5~8、14~31和50~57氨基酸决定原纤维生长速率[3]。许多因素会影响α-syn聚集,包括环境、点突变、C末端截断和翻译后泛素化、磷酸化和硝化等修饰[4],其聚集和传播在疾病的发生发展中起到重要作用。因此,α-syn可以作为PD的潜在诊断生物标志物、治疗靶点以及疾病进程的判断标准。
针对α-syn的特异性抗体是用于α-syn作为生物标志物的试剂盒的制备、PD的免疫治疗,以及发病机制的探索必不可少的。α-syn由140个氨基酸组成,由于其N端有一个跨膜序列,能与膜结构结合,因此,被认为是其发挥毒性作用的关键结构域。此外,由于α-syn的C端结构域的129丝氨酸的磷酸化作为PD的毒性形式,增加毒性α-syn聚集和传播[5],针对N端的抗体可以避开129位磷酸化的位点,可以用作双抗夹心酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)中的捕获抗体捕获α-syn,为识别129 位丝氨酸磷酸化的抗体留出抗原识别表位。本实验室已经成功研发针对129位丝氨酸磷酸化的单克隆抗体[6]。因此,本课题组制备了针对其N端的α-syn抗体,并进行了抗体效价的初步筛选和鉴定,为PD的发病机制的研究和治疗提供了技术支持。
1 材料与方法
1.1 实验动物
Thy1-α-syn转基因小鼠(Line 15)购于美国Jackson实验室,实验动物许可证编号:0214AX18,雄性,月龄:9个月。小鼠采用数字表法随机分为2组:转基因小鼠组(Thy1-α-syn transgenic mice,TG)及同窝对照野生小鼠组(wild-type mice, WT)。动物伦理审查文件编号(AEEI-2020-017)。
1.2 抗体制备
根据实验室前期制备单克隆抗体的方法[6],筛选出克隆号为1C16、2B8、2P21、3O18和1J6这5种单克隆抗体。简述如下:使用N端序列内肽段(Ac-TKEGVVHGVAT-NH2)行皮下免疫BALB/c小鼠,选择小鼠脾细胞与骨髓瘤细胞(Sp2/0)融合成杂交瘤细胞,采用间接酶联免疫吸附法初步筛选出5株可识别免疫肽段的单克隆抗体用于后续验证。
1.3 试剂
大肠杆菌BL21感受态细胞购于中国Tiangen公司;抗α-syn抗体购于美国Santa cruz公司; 抗β-actin抗体购于中国华安生物公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购于美国Pierce公司;考马斯亮蓝染液购于美国Biotium公司;SepharoseTM4B Beads购于美国GE公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、硝酸纤维素膜(nitrocellulose filter membrane,NC)和超滤管购于美国Millipore公司;5×上样缓冲液、放射免疫沉淀法(radio immunoprecipitation assay, RIPA)全细胞裂解液购于中国普利莱公司;人凝血酶购于中国Solarbio公司;异丙基-β-D-1-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)购于美国Abcam公司;明胶购于北京化工厂。
1.4 蛋白纯化
实验室前期已经成功构建了人源谷胱甘肽S 转移酶(glutathione S-transferase, GST)-α-syn蛋白(human-α-syn,h-α-syn)的融合蛋白重组质粒 pEGX-4T-1-h-α-syn[7],以及鼠源α-syn蛋白(mouse-α-syn,m-α-syn)、β-syn蛋白、人源α-syn/N蛋白、人源α-syn/ΔN端蛋白重组质粒,根据文献[8-9]的方法对这5种蛋白重组质粒进行体外纯化。简述如下:IPTG诱导大肠杆菌表达质粒,裂解菌体后提取重组蛋白,使用人凝血酶行GST标签切割,经纯化柱洗脱,收集蛋白样品,分别得到单体h-α-syn纯蛋白、m-α-syn纯蛋白、β-syn纯蛋白、h-α-syn/N纯蛋白、h-α-syn/ΔN端纯蛋白,经浓缩柱浓缩。
1.5 考马斯亮蓝染色
将体外纯化后的5种蛋白加入Loading buffer后,行12%(质量分数)十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE),结束后的凝胶浸没在装有考马斯亮蓝染液的暗盒中,水平摇床上孵育1 h,随后用洗脱液洗去非特异结合,使用Gel DocTMEM Imager仪器(美国Bio-Rad公司)拍摄结果。
1.6 斑点印迹法(Dot blotting)检测
使用0.1 mol/L 磷酸盐缓冲液(phosphate buffered saline,PBS)将各种重组蛋白稀释成100 ng/μL,取1 μL滴于0.3%(质量分数)明胶包被的NC膜上,常温晾干,用5%(质量分数)脱脂牛奶封闭1.5 h,三羟甲基氨基甲烷缓冲盐(triethanolamine buffered saline,TBS)/tween 20(T)洗膜3次,每次5 min。加入一抗,于孵育盒内4 ℃ 孵育过夜,TBS/T洗膜3次,加入荧光二抗(1∶10 000)室温孵育1 h,TBS/T洗膜3次,Odyssey扫描仪(美国LI-COR公司)成像。
1.7 蛋白印迹法检测蛋白质表达
冰上取小鼠皮质,加入RIPA裂解液后冰上孵育30 min,行超声裂解。4 ℃ 12 000g离心30 min,取上清使用BCA法测蛋白质浓度,进行12%(质量分数) SDS-PAGE电泳,半干转法将蛋白转移至PVDF膜,5%(质量分数)脱脂牛奶孵育1 h,一抗于4 ℃ 孵育过夜,TBS/T洗膜3次,加入荧光二抗(1∶10 000)室温孵育1 h,TBS/T洗膜3次,Odyssey扫描仪成像。
2 结果
2.1 制备h-α-syn、m-α-syn、β-syn、α-syn/N、α-syn/ΔN蛋白
α-syn分为3个结构域(图1A),N端是指1~60氨基酸(1~60 aa),非β淀粉样结构(nonamyloid component,NAC)区是61~90氨基酸(61~90 aa);C端是指91~140氨基酸(91~140 aa)。在大肠杆菌BL21感受态细胞表达h-α-syn质粒、m-α-syn质粒、β-syn质粒、α-syn/N质粒和α-syn/ΔN质粒后,诱导表达后提纯的蛋白进行考马斯亮蓝染色(图1B),结果显示,在m-α-syn、h-α-syn和β-syn组的相对分子质量17 000位置出现蛋白条带,说明α-syn蛋白和β-syn蛋白纯化成功。α-syn/N和α-syn/ΔN蛋白条带的相对分子质量分别在9 000和13 000。结果说明这5种形式的蛋白纯化成功,可以用作标准抗原检测抗体的效价。
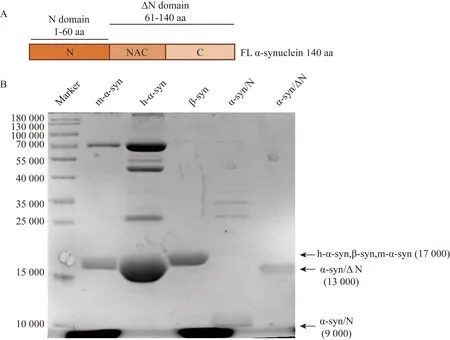
图1 体外制备不同的α-syn蛋白全长及结构域Fig.1 Preparation of full length and different domains of α-syn protein in vitro
2.2 初步筛选识别h-α-syn全长和α-syn/N蛋白的抗体及效价检测
免疫小鼠的肽段序列为:TKEGVVHGVAT(图2A),其位于α-syn的第44~54个氨基酸,即N端结构域内序列。取h-α-syn(100 ng/μL)、m-α-syn(100 ng/μL)、β-syn(100 ng/μL)、α-syn/N-1(100 ng/μL)和α-syn/N-2(150 ng/μL)蛋白,各1 μL滴于NC膜上。Dot blotting结果显示了筛选出的单克隆抗体的识别区域。结果显示,市售的商品化抗体Santa Cruz (sc-69977)作为阳性对照抗体仅识别h-α-syn和m-α-syn,而不识别α-syn/N肽段(图2B膜1)。在不同的稀释比例下(1∶5 000和1∶10 000)单克隆抗体1C16(1.5 mg/mL)只识别h-α-syn蛋白全长,不识别m-α-syn和β-syn(图2B膜2和3)。单克隆抗体2B8(1.5 mg/mL)在1∶5 000的比例下识别h-α-syn、m-α-syn和α-syn/N,而在1∶10 000的比例下不再识别m-α-syn(图2B膜4和5)。在2种不同的稀释比例下,单克隆抗体2P21(1.5 mg/mL)也只识别h-α-syn蛋白全长(图2B膜6和7)。单克隆抗体3O18(1.5 mg/mL)在1∶5 000的比例下对h-α-syn、m-α-syn的识别比较弱,但是对α-syn/N的识别比较强,而在1∶10 000的比例下仅对α-syn/N有微量识别(图 2B膜8和9)。在1∶5 000的比例下,单克隆抗体1J6(1.5 mg/mL)识别h-α-syn、m-α-syn、β-syn和α-syn/N蛋白,而增加稀释比例后在1∶10 000的稀释比例下,1J6仅识别h-α-syn、m-α-syn和α-syn/N蛋白(图 2B膜10和11)。结果显示1C16只能识别h-α-syn蛋白全长,1J6是特异性识别N端α-syn的蛋白,而抗体2B8虽然有类似的结果,但是它的识别效率比较低。
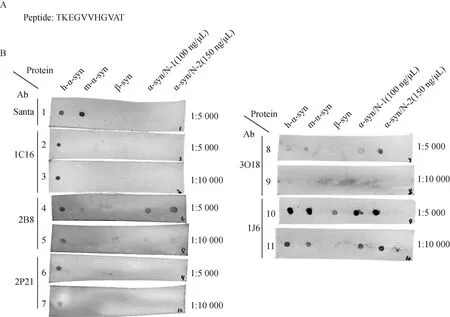
图2 使用Dot blotting方法筛选识别h-α-syn全长和α-syn/N蛋白的抗体Fig.2 Using Dot blotting to detect the antibodies that could recognize the full length of h-α-syn and α-syn /N protein
2.3 筛选识别α-syn/N蛋白和α-syn/ΔN蛋白的抗体
取1 μL的h-α-syn、β-syn、α-syn/N和α-syn/ΔN纯蛋白(100 ng/μL)加于NC膜上,用于进一步验证各个抗体的识别区域。Dot blotting 结果显示:在1∶10 000的稀释比例下,1C16(1.5 mg/mL)抗体不识别α-syn/N蛋白,而识别α-syn/ΔN纯蛋白。2B8抗体既识别全长α-syn,也识别α-syn/N蛋白和α-syn/ΔN纯蛋白。2P21抗体识别全长α-syn和α-syn/ΔN纯蛋白。3O18抗体与2B8类似,既识别全长α-syn,也识别α-syn/N蛋白和α-syn/ΔN纯蛋白,只是效价更低。1J6抗体识别全长α-syn和α-syn/N蛋白,不识别α-syn/ΔN蛋白,对β-syn有比较低的识别效价(图3)。
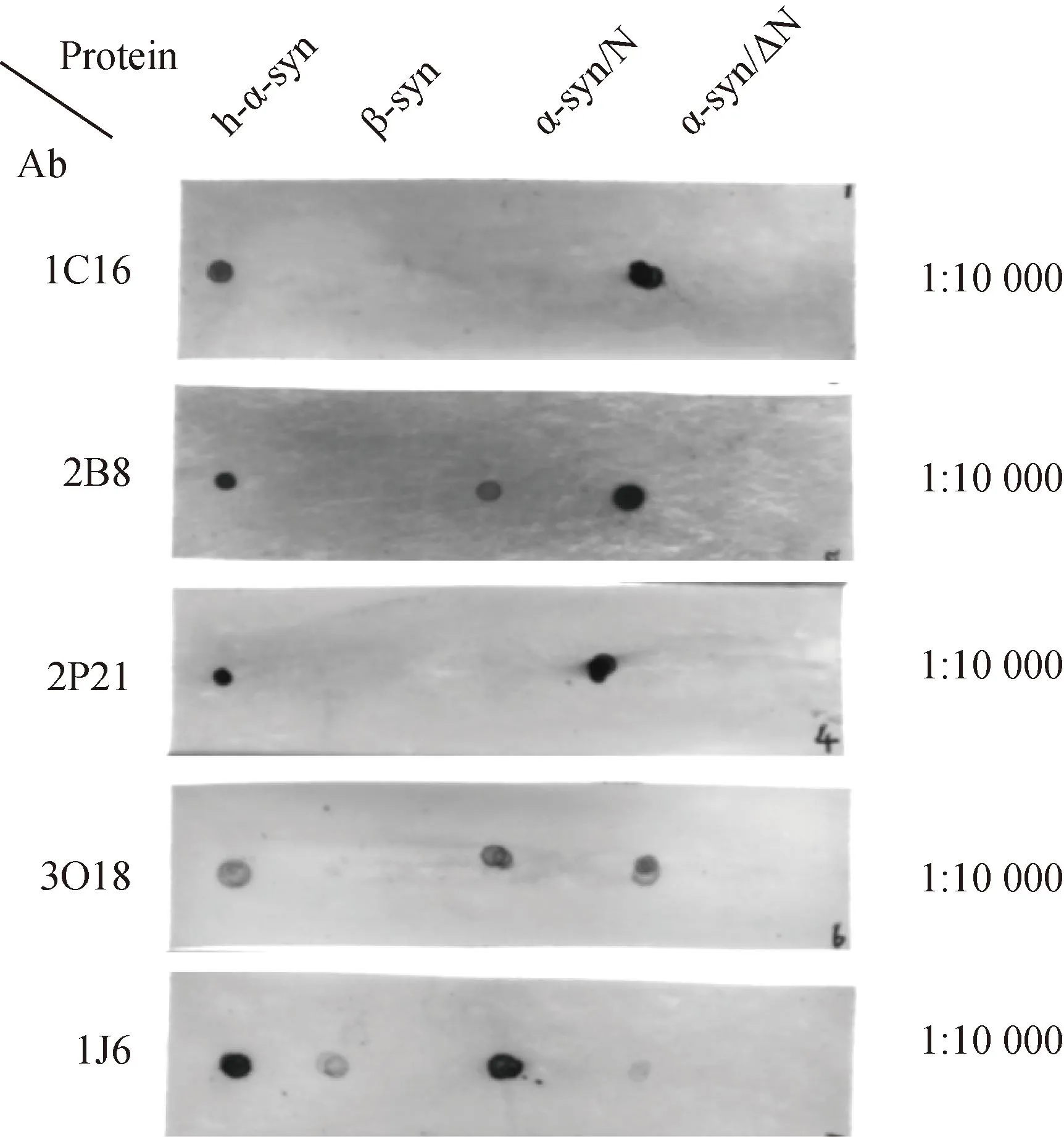
图3 筛选识别α-syn/N结构域和α-syn/ΔN结构域的抗体Fig.3 Screening antibodies to recognize α-syn/N domain and the α-syn/ΔN domain
2.4 在动物脑组织中验证1C16和1J6是否能用于Western blotting
Dot blotting实验初步验证了1C16和1J6能识别非变性状态下的纯蛋白。接下来验证其是否能识别变性蛋白。使用1C16检测变性处理后的α-syn、β-syn、α-syn/N、 α-syn/ΔN纯蛋白(各1 μg)和 TG、WT(各10 μg)小鼠皮质提取蛋白,Western blotting结果显示,抗体1C16(1∶10 000)孵育后,α-syn纯蛋白和TG小鼠样品组均在17 000的位置出现条带,在13 000的α-syn/ΔN纯蛋白组也出现条带(图4A),不识别变性后的β-syn纯蛋白,同一张PVDF膜进行β-actin抗体孵育,作为上样内参(图4B)。抗体1J6(1∶10 000)仅能识别变性状态下的9 000的α-syn/N纯蛋白(图4C),为了验证上样量的准确性,同一张PVDF膜进行1C16(1∶10 000)和β-actin抗体孵育,结果显示,α-syn纯蛋白和TG小鼠样品组均有存在α-syn(图4D)。这提示,抗体1C16可以识别变性的人源的α-syn,而1J6不识别变性后的全长α-syn纯蛋白。
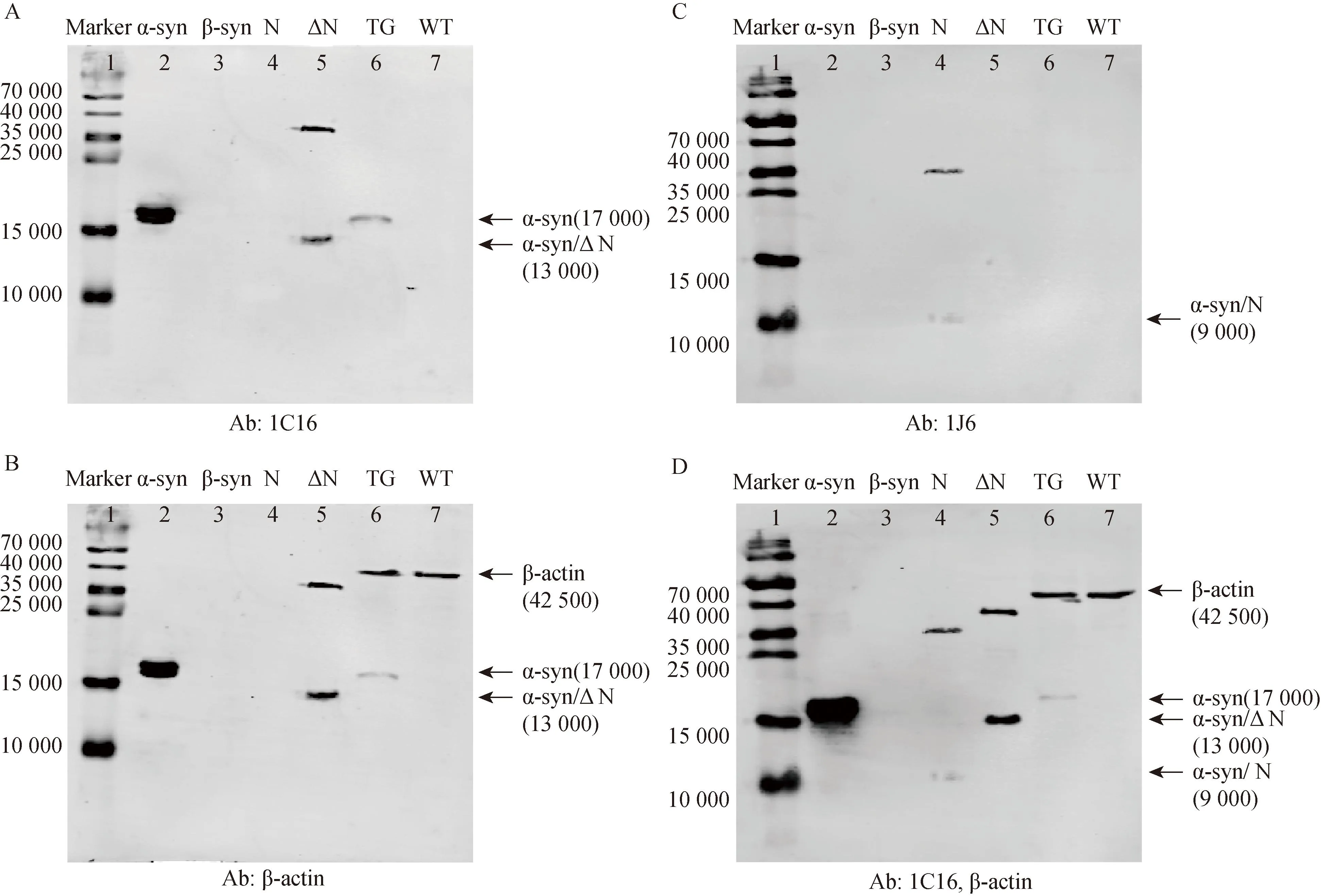
图4 使用Western blotting 方法验证1C16和1J6对变性蛋白的识别情况Fig.4 Using 1C16 and 1J6 to verify the recognition of denatured proteins by Western blotting
3 讨论
α-syn是由140个氨基酸组成的蛋白质,其结构分为N端(1~60 aa),该结构域内含有7个KTKEGV不完全重复序列,使α-syn与磷脂具有较高的亲和性而易于与富含磷脂的细胞膜结合;高度疏水性的NAC区(61~90 aa),该结构域在介导α-syn聚集过程中纤维结构的形成中起到重要作用; C端(91~140 aa)富含酸性残基和脯氨酸,产生无序而灵活的结构域。PD患者脑中路易体内主要由全长α-syn组成,其中90%为129位丝氨酸磷酸化形式的α-syn[10],此外还有少量约10 000~15 000的α-syn各种截短体[11]。α-syn的几种天然C-末端截短形式(1~119或1~122)可能在促进α-syn聚集中及体内的纤维生成中起关键作用。在PD患者脑和α-syn转基因小鼠中,发现C端截短的α-syn积聚在轴突,这与神经元功能障碍相关[12]。
研究者根据不同的研究目的设计了不同的抗体,比如syn-O1、 -O2、 和 -O4和Syn-10H能识别α-syn的寡聚体,Syn-F1 及Syn-F2是针对识别α-syn的纤维而设计的抗体[13],1H7、5C1、CT(A1-A6)是识别α-syn的C端的抗体,值得一提的是,PRX002是第一个被用于治疗PD的抗体药物[14],NAC32和VH14是针对NAC区研发的抗体,NAC32能降低A53T细胞株的神经毒性[15]。由于N端能与膜结构结合,因此针对它的抗体比较少。也有针对α-syn单一位点的抗体,比如针对129丝氨酸的磷酸化抗体[6]。本课题组研发针对N端的特异性单克隆抗体除了可以探讨α-syn引起PD的发病机制、免疫治疗,还可以用于开发PD早期诊断试剂盒。N端抗体对α-syn的特异性捕捉,可以留出引起聚集的NAC结构域和C端结构域,针对这2个区域的大量的抗体可以作为捕获抗体,可以应用在检测α-syn和p-α-syn的ELISA诊断试剂盒中。
由于α-syn/N端的TKEGVVHGVAT有更高的表位活性,因此,使用此序列进行免疫用于制备单克隆抗体。为了筛选出特异性识别N端的抗体,不仅纯化了人源α-syn全长蛋白,也纯化了m-α-syn蛋白、β-syn蛋白、h-α-syn/N和h-α-syn/ΔN纯蛋白,其中α-syn/N(9 000)的条带与电泳前沿虽然没有形成明显的分离,但是胶前沿的条带是在α-syn/N的下方,因此能证明α-syn/N纯蛋白制备成功。在鉴定α-syn/N蛋白的时候,电泳前沿着色是溴酚蓝作为跑胶的指示剂加入到需要鉴定的蛋白质内的,而在后期鉴定中Dot blotting实验并不加入溴酚蓝,同样在Western blotting实验中使用特异性抗体检测目的蛋白,溴酚蓝也不会着色。因此不会影响其专一性,也不会出现交叉反应。结果提示,1J6 可以作为识别 α-syn /N 的抗体,1C16 和2P21 可以用于识别 α-syn /ΔN 的抗体,2P21 的效价较1C16 低。 2B8 和 3O18 抗体不能用于 α-syn 检测。Dot blotting 结果筛选出抗体1J6可以作为识别α-syn/N,1C16可以用于识别α-syn/ΔN的抗体。Western blotting 进一步验证了这2种抗体对变性蛋白的识别情况。结果提示,抗体1C16可以识别非变性的人源α-syn纯蛋白和小鼠脑组织中的变性的人源α-syn蛋白,不识别鼠源的α-syn和β-syn。抗体1J6仅识别非变性的人源的α-syn及α-syn/N纯蛋白, 不识别变性后的全长α-syn纯蛋白和小鼠脑组织中的变性人源α-syn蛋白,可以用于双抗夹心的ELISA的捕获抗体。
综上,本课题组初步筛选出2种可以应用于ELISA和Western blotting检测的特异性识别α-syn/N端结构域的单克隆抗体及初步效价检测,将进一步验证其在ELISA检验及免疫治疗中的作用。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明贾焕珍:提出研究思路,研究过程的实施,整理数据,撰写论文;焦洁:研究过程的实施,数据整理;高歌、杨慧:提出研究思路,研究的可行性分析,负责文章质量控制及论文审定。

