Lindegaard指数预测早期脓毒症相关性脑病的临床价值
宋 倩 周 倩 孙 宏 李 硕 梅 雪 郭瑞君 葛辉玉
(首都医科大学附属北京朝阳医院超声医学科,北京 100020)
脓毒症是机体对感染反应失衡导致危及生命的多系统、多器官功能障碍,是临床最常见的急危重症[1]。脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)是由脓毒症引起的急性弥漫性中枢神经系统功能障碍,起病隐匿,多发生于脓毒症早期,最早可在起病后数小时发生,临床表现为轻度谵妄至重度昏迷等不同程度的脑功能紊乱[2]。SAE发病机制复杂,可能与神经炎症、脑血管自动调节功能紊乱、脑微循环障碍及颅脑低灌注等密切相关,有研究[3-4]认为脑血管痉挛是脓毒症早期患者发生SAE的主要原因。由于目前尚无特异性评价指标,且鉴别诊断易受其他中枢神经系统疾病干扰,文献[5]报道SAE发病率从8%到70%不等。床旁超声可动态监测脑血流变化,是评估脑血管痉挛发生及严重程度的有效工具。脑血管痉挛指数(Lindegaard index,LR)为大脑中动脉(middle cerebral artery, MCA)与同侧颈内动脉颅外段(extracranial internal carotid artery, EICA)平均流速的比值[6],多用于动脉瘤性蛛网膜下腔出血后脑血管痉挛的鉴别与评价。本文研究采用床旁经颅彩色多普勒超声(transcranial color-coded sonography, TCCS)及颈动脉超声测量脓毒症早期患者MCA及EICA的各项血流动力学参数、计算LR,以评估脑血流变化及脑血管痉挛情况,进一步探讨LR对脓毒症早期SAE的预测价值。
1 对象与方法
1.1 研究对象
回顾性分析2021 年 11 月至 2022 年3 月入住首都医科大学附属北京朝阳医院急诊科的脓毒症患者。纳入标准:脓毒症诊断符合2016年美国重症医学会(The Society of Critical Care Medicine,SCCM)与欧洲重症医学会(European Society of Intensive Care Medicine,ESICM)联合发布的Sepsis 3.0[7]。排除标准:年龄<18岁;入住重症加强护理病房(intensive care unit,ICU)时间小于3 d;颞窗透声不佳,TCCS无法清晰显示MCA;既往存在中枢神经系统疾病(如脑梗死、脑出血、中枢神经系统感染或其他代谢障碍导致的脑病)或精神疾病;合并重度动脉粥样硬化导致颈动脉或MCA狭窄或闭塞;合并甲状腺功能亢进、贫血、心房颤动、心力衰竭等疾病。本文研究经过首都医科大学附属北京朝阳医院医学伦理委员会的批准(伦理审批号:2021-科-704),并获得患者或患者家属的知情同意。最终纳入37例脓毒症患者,所有患者均按照拯救脓毒症运动指南的标准给予集束化治疗[8]。
1.2 SAE临床诊断及分组标准
确诊脓毒症后3 d内,使用格拉斯哥昏迷评分 (Glasgow coma score,GCS) 及重症加强护理病房谵妄评估量表(confusion assessment method for the intensive care unit,CAM-ICU) 评估所有患者的精神状态和意识水平(镇静治疗患者需停用镇静药物至少6 h再进行评估)。排除其他可能导致意识水平改变的原发性中枢神经系统疾病和药物影响,一旦出现谵妄或昏迷(CAM-ICU阳性或持续性GCS≤14),即诊断为SAE[9-10]。根据是否出现SAE将脓毒症患者分为SAE组和非SAE组。
1.3 临床资料收集
收集入组患者入院24 h内一般临床资料:年龄、性别、急性生理与慢性健康状况评分Ⅱ (acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)、GCS评分、平均动脉压(mean arterial pressure,MAP)、血乳酸(lactate,Lac)检测值。记录患者28 d死亡或生存情况。
1.4 超声仪器与方法
采用Philips EPIQ7C彩色多普勒超声诊断仪,S5-1探头(1~5 MHz)及L9-3探头(3~9 MHz),于入院第1天、第3天(第一次集束化治疗前、后)对患者进行EICA与MCA超声检查。患者取仰卧位,经颞窗在深度45~65 mm范围内探测双侧MCA M1段血流,记录血流速度较高一侧的MCA收缩期峰值流速(systolic velocity,Vs)、舒张期流速(diastolic velocity,Vd)、平均血流速度(mean velocity,Vm)、搏动指数(pulsatility index,PI)及阻力指数(resistant index,RI),其中Vm=(Vs+2Vd)/3,PI=(Vs-Vd)/Vm,RI=(Vs-Vd)/Vs。随后于同侧颈动脉分叉处上方1.0~1.5 cm处测量EICA Vm,LR=(MCA Vm)/(EICA Vm)。当MAC Vm≥120 cm/s且LR≥3时,诊断为脑血管痉挛[11]。测量上述指标时,声束与血流方向夹角需小于60°。
图像采集与数据分析由具有5年以上急危重症超声经验的医师完成,且其对患者病情严重程度不知情。
1.5 统计学方法

2 结果
2.1 一般临床资料
37例脓毒症患者纳入本研究,SAE组17例,非SAE组20例。2组患者年龄、性别、MAP差异无统计学意义,而入院24 h 内APACHE Ⅱ评分 、GCS评分、Lac及28 d病死率差异有统计学意义(表1)。
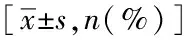
表1 非SAE组与SAE组一般临床资料比较Tab.1 Comparison of the clinical data between the non-SAE and SAE groups
2.2 两组间MCA血流动力学参数比较
2.2.1 第1天各参数比较
SAE组VsD1、VdD1、VmD1及LRD1、脑血管痉挛发生率均高于非SAE组,差异有统计学意义(P<0.05);SAE组PID1、RID1高于非SAE组,差异无统计学意义(P>0.05)(表2)。
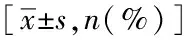
表2 非SAE组与SAE组第1天TCCS参数比较Tab.2 Comparison of TCCS parameters between the non-SAE and SAE groups on the first day
2.2.2 第3天各参数比较
SAE组与非SAE组血流动力学参数差异均无统计学意义(P<0.05)(表3)。
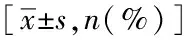
表3 非SAE组与SAE组第3天TCCS参数比较Tab.3 Comparison of TCCS parameters between the non-SAE and SAE groups on the third day
2.3 治疗前后MCA血流动力学参数比较
2.3.1 治疗前后,两组组内血流动力学参数变化
SAE组:LR及MCA流速(Vs、Vd及Vm)在第3天均较第1天明显下降,差异有统计学意义(P<0.05)。非SAE组:LR及MCA流速(Vs、Vd及Vm)在第3天均较第1天升高,差异无统计学意义(P>0.05)。无论SAE组还是非SAE组,MCA PI及RI,在第3天均较第1天降低,差异无统计学意义(P>0.05)(表4)。
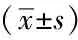
表4 治疗前后两组组内TCCS参数变化Tab.4 Changes of TCCS parameters before and after treatment in each group
2.3.2 两组间治疗前后LR差值(ΔLR=LRD1-LRD3)比较
SAE组ΔLR大于非SAE组,差异有统计学意义(P<0.05)(表5)。
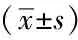
表5 非SAE组与SAE组间ΔLR比较Tab.5 Comparison of ΔLR between the non-SAE and SAE groups
2.4 二元Logistic回归分析
二元Logistic回归分析结果显示入院24 h 内APACHE Ⅱ评分、LRD1及ΔLR是脓毒症患者发生SAE的危险因素(P<0.05)(表6)。
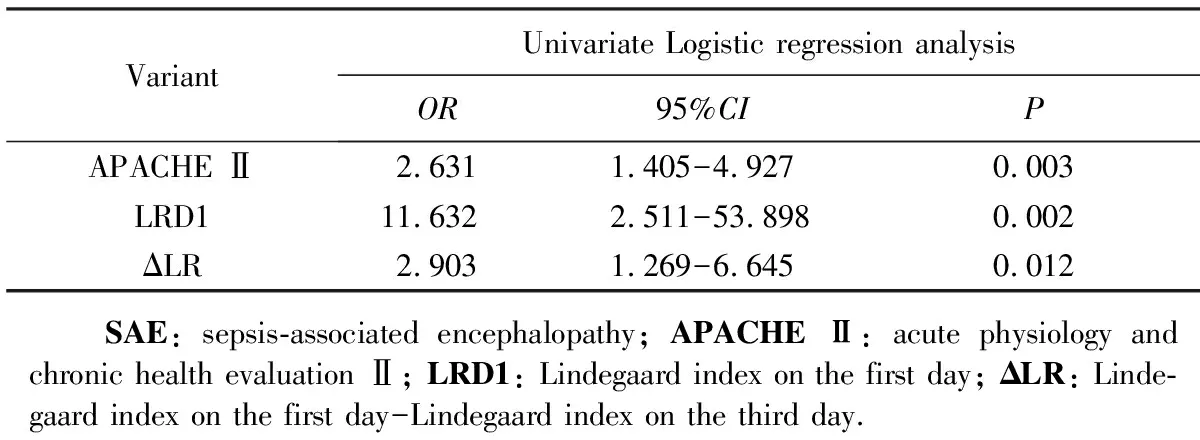
表6 SAE患者二元Logistic回归分析结果Tab.6 The results of binary Logistic regression analysis in SAE patients
2.5 ROC曲线分析
ROC曲线分析结果显示,入院24 h 内APACHE Ⅱ评分、LRD1、ΔLR均可预测早期SAE发生,曲线下面积(area under the curve,AUC)分别为0.946(95%CI:0.818~0.993)、0.865(95%CI:0.712~0.955)、0.779(95%CI:0.613~0.899),APACHE Ⅱ评分与ΔLR联合预测SAE的效果最佳,AUC为0.968(95%CI:0.850~0.999),灵敏度为88.24%,特异度为95%,P均<0.01(表7)。
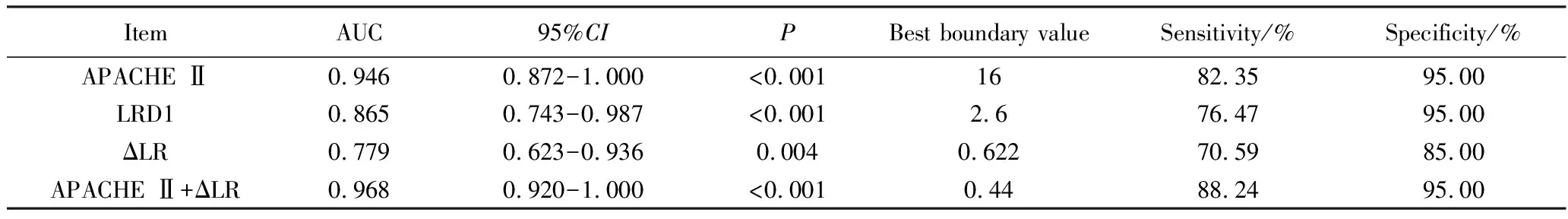
表7 各指标预测SAE的ROC分析Tab.7 The ROC analysis of each index for predicting SAE
3 讨论
研究[12-13]显示,脓毒症早期是SAE的发病高峰期,SAE可导致脓毒症患者长期神经功能认知障碍及病死率增加。而SAE早期多表现为行为、认知、意识改变,缺乏特异性,具有一定的隐蔽性和复杂性,极易被临床忽视。目前SAE诊断主要依靠临床评估和排除性诊断,存在较大的主观性,因此如何通过客观检查早期诊断SAE对降低脓毒症病死率、改善预后至关重要。
床旁超声因无创、便捷、经济等优势已广泛应用于重症医学[14]。临床常以MCA作为评价脑血流及脑血管痉挛的重要靶血管,将MCA Vm>120 cm/s作为痉挛诊断阈值,因易受到脑血流量即脑充血等因素的影响而发生偏倚,故引入LR进行鉴别:当MCA Vm≥120 cm/s且LR≥3,诊断为脑血管痉挛,当MCA Vm≥120 cm/s且LR<3,则诊断为脑充血[15]。
本文研究中SAE组患者入院24 h 内APACHE Ⅱ评分及Lac明显高于非SAE组,GCS评分明显低于非SAE组(P<0.05),表明SAE的发生与机体全身炎症反应程度和其他脏器功能状态密切相关,SAE组患者病情明显重于非SAE患者。本文研究结果显示SAE组患者28 d病死率明显高于非SAE组,说明在脓毒症早期出现SAE提示病情恶化及预后不良,SAE是脓毒症患者死亡的危险因素。
治疗前,SAE组MCA流速(Vs、Vd及Vm)均高于非SAE组,这可能与SAE组早期颅内炎症反应更重有关,大量炎症介质及多种促炎细胞因子释放导致脑血管内皮细胞功能紊乱,引起舒血管物质如一氧化氮(NO)及前列环素等合成及释放减少,缩血管物质如内皮素-1及前列腺素等合成及释放增多,使脑血管呈持续收缩状态,甚至发生痉挛[16],从而导致MCA上述血流速度明显加快。还可能由于SAE组中躁动型脑病比例高于抑制型脑病,而脓毒症早期脑血流自动调节机制尚完整[17],可通过神经血管偶联,整合各种机械、化学和分子信号自主调节脑血管管径,加快脑血流流速,增加脑灌注以适应躁动型SAE患者大脑活动增强时的高代谢需求[9]。本文研究中SAE组患者早期发生脑血管痉挛的比例明显高于非SAE组(52.9%vs0%),进一步验证了上述病理生理学变化。
经过早期集束化治疗,D3与D1结果比较,SAE组患者MCA流速(Vs、Vd及Vm)均明显下降,而非SAE组略升高,说明非SAE组脑血流动力学状态较平稳,治疗后脑循环缓慢改善,脑血流灌注呈上升趋势,而SAE组患者脑血流波动大,对治疗反应差,脑血流灌注不足,提示病程进展、病情加重。
Pierrakos等[18-19]的研究报道脓毒症早期(24 h内)PI值升高可能提示血管顺应性下降、远端血管阻力增高、脑血管痉挛,反映脑微循环障碍及脑灌注不足,PI值>1.3可预测SAE发生。本文研究结果显示:无论SAE组还是非SAE组,第1天和第3天PI值均升高,但未达到1.3,且差异均无统计学意义。笔者推测可能与本组研究对象存在一定的选择偏倚(如躁动型与抑制型脑病患者PI及脑灌注存在明显差异[9])、病情严重程度不同及样本量不足等因素有关。本文研究中SAE组LRD1及ΔLR明显高于非SAE组,差异有统计学意义,这可能与SAE组早期脑血管痉挛发生率高有关,而PI及RI两组差异无统计学意义,提示与PI及RI相比LR指数及其变化ΔLR可能是更为敏感的预测早期SAE发生的指标。
LR反映了由颅外到颅内(由EICA到 MCA)血流的加速能力[20],当LR升高时通常说明颅内血流灌注改善,而LR降低可能与脑血流灌注减少、脑灌注压低于脑自动调节范围或脑血流自主调节机制受损等有关。本文研究表明在早期集束化治疗后,SAE组LR明显下降,说明SAE组患者颅内动脉血流加速困难,进一步导致脑灌注不足、脑实质缺血缺氧。
Logistic回归分析结果显示,入院24 h内APACHE Ⅱ评分、LRD1及ΔLR是早期脓毒症患者发生SAE的危险因素。ROC曲线分析显示,入院24 h内APACHE Ⅱ评分、LRD1及ΔLR均可预测早期SAE发生。LRD1对SAE预测价值较大,当截断值为2.6时,灵敏度为76.47%、特异度为95.00%。入院24 h内APACHE Ⅱ评分与ΔLR联合评估,能进一步提高对早期SAE的诊断效能:AUC为0.968,灵敏度为88.24%、特异度为95.00%。
本文研究为单中心回顾性研究,病例数较少,仅评估分析了脓毒症早期(前3 d)的精神状态和脑血流动力学参数,存在一定的局限性,今后应扩大样本量,连续、动态监测脓毒症不同时期脑血流变化,分析LR与SAE的关系,明确其诊断价值。此外,由于SAE是一种异质性疾病,未来可按照临床表现进一步将SAE患者分为躁动型及抑制型脑病亚组进行具体分析,最大限度地减少影响脑血流变化的混杂因素。
综上结果显示,脓毒症早期SAE患者MAC流速及LR指数明显升高,与脑血管痉挛有关,而治疗后两者均明显降低,与脑灌注不足有关。床旁超声评估脓毒症第1天LR指数及其早期动态变化ΔLR联合临床APACHE Ⅱ评分对早期SAE的诊断存在较高临床价值。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明宋倩:设计研究方案,采集数据,分析数据,撰写文章;周倩、孙宏、李硕:采集数据;梅雪、郭瑞君:把握研究思路可行性;葛辉玉:提出研究思路,修改及审定论文,总体把关。

