栀子大黄汤在酒精性肝病小鼠模型中的保护作用
侯逸文, 张荣杰, 纪龙珊, 李 茜, 高月求, 李 曼
1 上海中医药大学附属曙光医院 a. 细胞免疫实验室, b. 肝病科, 上海 201203; 2 肝肾疾病病症教育部重点实验室, 上海 201203;
酒精性肝病(ALD)是一种因过量饮酒导致迅速出现以黄疸和肝脏相关并发症为特征的疾病,具有较高的短期病死率[1]。ALD是引起全球慢性肝病的主要原因之一[2],也是全球最常见的晚期肝病之一[3],其中仅酒精性相关的肝硬化和肝癌死亡数就占全球死亡人数的1%[4]。在美国,ALD 占其肝硬化病死率的48%[2],而在我国,随着社会的发展,饮酒人群比例和ALD的患者数量也逐年升高[5]。ALD 主要包括酒精性脂肪肝、酒精性肝炎和酒精性肝硬化,严重的情况下甚至导致肝癌的发生[6]。酒精可以通过各种机制作用,最后导致脂肪在肝脏的沉积,而酒精在体内的代谢产物会引起免疫反应,可能会造成炎症和损伤[7],随着病情进展和代谢产物的积累,最终可能会导致肝癌的形成。ALD 的治疗方法主要有戒酒、营养支持和预防肝硬化的发生及进展[8],除此之外,没有针对ALD的具体治疗方案[6]。戒酒只能减轻ALD 的部分症状,寻求有效的治疗ALD、减缓ALD进展的药物是必要的。
ALD 的发病机制复杂[9],目前已知的机制主要涉及氧化应激失衡,肠道内毒素的增加,免疫炎症信号通路的激活,以及饮酒对肝细胞的直接损伤等[10]。氧化应激失衡由抗氧化能力和活性氧(ROS)之间的失衡引起的[11]。酒精的氧化代谢产物如乙醛和ROS在酒精性肝炎的临床和病理谱中发挥着重要作用。酒精氧化代谢影响细胞内信号通路,扰乱多个基因的转录控制,导致脂质积累、纤维化、先天免疫和适应性免疫的激活。此外,乙醇代谢激活天然免疫和获得性免疫在ALD的发生发展中起着关键作用,乙醛和脂多糖诱导细胞释放ROS、促炎细胞因子和趋化因子,导致中性粒细胞的浸润。
中草药含有多种天然化合物,存在低毒性、多靶点等作用优势,在ALD 的预防和治疗方面已受到广泛关注[12]。ALD 在中医学一般归属于“黄疸”“酒疸”[13]“伤酒”“酒胀”[14]等范畴。主要病机在于内湿为患,寒湿内蕴或湿郁化热,进一步至脾虚肝郁,肝失疏泄,气滞血瘀,最终导致肝、脾、肾等脏腑功能失常[1]。《金匮要略》中张仲景对于酒疸的治则是“清解湿热”,以“上下分消”为治法[15],据此提出栀子大黄汤(ZZDHT)治疗酒疸[16],该方由栀子十四枚、大黄一两、枳实五枚、豉一升组成。本研究显示了ZZDHT 能够减轻慢性酒精喂养加急性酒精灌胃ALD 小鼠模型(NIAAA 模型小鼠)的氧化应激和炎症反应,改善中性粒细胞浸润水平。通过采用网络药理学、非靶向代谢组学和RNA转录组测序等方法,研究ZZDHT 治疗ALD 的可能作用机制,以期为ALD的治疗提供研究思路和参考。
1 材料与方法
1.1 网络药理学分析
1.1.1 ZZDHT 活性成分筛选 通过中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP),检索“栀子”“大黄”“枳实”“淡豆豉”此4 味中药的化合物,以口服利用度值(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18 作为筛选条件,过滤获得复方的有效化合成分及对应靶点。使用Uniprot蛋白质数据库对筛选出来的中药复方药物靶点,借助Uniport数据库,将物种限定为Homo sapiens,将靶点全称统一规范转换为对应的基因symbol进行校正,便于后期的分析与数据处理。
1.1.2 ZZDHT-ALD 靶点网络可视化分析 使用GeneCards、OMIM、PharmGkb、TTD和DrugBank五个数据库以“Alcoholic liver disease、alcohol-related liver diseases、alcohol-associated liver disease”为检索词获取ALD 相关基因,将筛选到的药物靶点基因和疾病相关基因取交集,得到药物-疾病相关基因,使用jvenn 网络平台(http://jvenn.toulouse.inra.fr/app/example.html)绘制交集基因Venn 图。通过Cytoscape3.8.0 软件对药物-疾病相关基因进行可视化网络分析,得到中药复方调控网络图。
1.1.3 ZZDHT-ALD 蛋白质互作网络(protein-protein interaction,PPI)构 建 使 用String 平 台(https://cn.string-db.org/)对交集基因进行蛋白质互作网络分析,物种选择“Homo sapiens”,设置互动分数为0.900,去除网络图中已断开连接的节点。将分析结果导入Cytoscape3.8.0软件,使用CytoNCA插件计算网络节点中心性得分,根据节点的Betweenness(BC)、Closeness(CC)、Degree(DC)、Eigenvector(EC)、LAC、Network(NC)各项得分均大于中位值进行过滤,最终可以得到网络的核心节点基因。
1.1.4 ZZDHT-ALD 基因本体(gene ontology,GO)分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析 使用David数据库(https://david.ncifcrf.gov/)对核心基因进行功能富集分析,以P<0.05 作为过滤条件,进行GO 和通路富集分析。使用R-4.1.1软件的ggpubr包绘制柱状图对富集结果进行展示。
1.2 ZZDHT 非靶代谢组分析 使用非靶代谢组学技术检测ZZDHT 在小鼠血清和肝脏中代谢物变化情况,配制两倍中剂量浓度的栀子大黄汤予以小鼠灌胃,准备36 只C57BL/6J 小鼠,随机分为对照组和用药组,每组18 只。用药组前3 天早晚各灌胃ZZDHT 一次(0.1 mL/10 g),第3 天晚上禁食,第4 天早上灌胃一次,分别于间隔2 h及4 h后再灌胃一次。对照组灌胃对应体积的生理盐水。分别于最后一次灌胃后10 min、30 min、1 h、2 h、4 h、6 h,随机从2 组各取3 只小鼠麻醉后取小鼠血清和肝组织,血清每只取30 µL,肝组织每只取30 mg,分别混合18 只小鼠的血清和肝组织进行后续质谱分析。使用超高液相色谱技术,分离和鉴定ZZDHT 在血清和肝组织中的代谢物,对ZZDHT 有效成分进行验证。
1.3 ZZDHT 改善NIAAA 模型小鼠氧化应激和炎症反应动物实验
1.3.1 实验动物、药物及造模饲料 采用8 周龄SPF级C57BL/6J 雄性小鼠。购自浙江维通利华实验动物技术有限公司,生产许可证号:SCXK(浙)2019-0001,实验动物使用许可证编号:SYXK(沪)2019-0003。
ZZDHT 药物来自上海中医药大学附属曙光医院中药房的免煎颗粒(江阴天江药业有限公司)。Lieber-DeCarli 对照液体饲料,Lieber-DeCarli 酒精液体饲料,购自南通特洛菲饲料科技有限公司。
1.3.2 主要试剂 HE 染色试剂盒(北京酷来搏生物科技有限公司,货号:SL7070-100ML),DAB 显色试剂盒(茹创生物有限公司,货号:220105),Trizol(碧云天生物科技有限公司,货号:R0016 ECL),RNA 逆转录试剂盒(南京诺唯赞公司,货号:R223-01),RNA 扩增试剂盒(南京诺唯赞公司,货号:Q711-02),ALT、AST检测试剂盒(南京建成生物工程有限公司,货号:C009-2-1、C010-2-1)、组织固定液(Biosharp 公司,货号:70081800),磷酸盐缓冲液(美仑生物技术有限公司,货号:PWL101),柠檬酸钠抗原修复液(Bioss公司,货号:C02-02002),EDTA 抗原修复液(BBI 公司,货号:E673003-0100),3%过氧化氢修复液(北京酷来搏生物科技有限公司,货号:DZSL30222501)。
1.3.3 药物制备 ZZDHT 由栀子15 g,大黄3 g,枳实10 g,淡豆豉15 g 组成[14]。按公式:小鼠的正常给药剂量(g/kg)=成人用药量(g)/成人标准体质量(kg)×9,配制ZZDHT,一剂药溶于66 mL 蒸馏水中即为ZZDHT 中剂量用药组[ZZDHT(M)],溶于33 mL 蒸馏水中,为高剂量用药组[ZZDHT(H)],溶于132 mL 蒸馏水中,为低剂量用药组[ZZDHT(L)]。配制好的药物放在4 ℃冰箱,备用。
1.3.4 模型制备、给药与取材 NIAAA 模型小鼠制备[17-18]:C57BL/6J雄性小鼠50只,8周龄,体质量20~30 g,SPF级。(1)对照饮食制备:称量218.8 g对照饮食饲料,加入1 L灭菌纯水充分混匀,制备成1 L对照液体饮食。(2)酒精饮食制备:称量148 g酒精饮食饲料,加入950 mL灭菌纯水充分混匀,制备成950 mL的酒精饮食,再加入50 mL无水乙醇混合(保存用于第2天的酒精液体饮食使用时再加入相应比例酒精),配制成酒精液体饮食,按照比例每次配制2天用量,除液体饮食外不予其他食物和水。将50只C57BL/6J雄性小鼠适应性喂养1周后,随机分为对照组、模型组、ZZDHT(L)组、ZZDHT(M)组、ZZDHT(H)组,每组10只。对照组和模型组予等量生理盐水灌胃,各用药组予相应的ZZDHT剂量灌胃。灌胃量为0.1 mL/10 g小鼠体质量,在造模当日起给药,每天1次,给药时间为10天,第11天称重后,模型组和用药组用单剂酒精灌胃(5 g/kg体质量)1次,对照组用单剂量麦芽糖糊精灌胃(9 g/kg 体质量),灌胃9 h后进行取材,使用3%戊巴比妥钠(80~100 mg/kg)腹腔注射麻醉后摘眼球取血,断颈处死后肝脏取材。血液室温静置1 h后离心(4 ℃,3 500 r/min,15 min)取上清,-80 ℃冻存备用。剥离小鼠肝脏,切取两块肝大叶中部约0.5 cm×0.5 cm肝组织分别置于4%多聚甲醛固定和OCT胶液氮速冻,剩余肝组织保存于-80 ℃冻存备用。
1.3.5 检测指标及方法
1.3.5.1 小鼠血清生化指标检测 根据试剂盒说明书检测小鼠血清ALT、AST和TG表达水平。
1.3.5.2 小鼠血清和组织ELISA 检测 将血清稀释5倍后,在微孔酶标板分别加入样本和标准品各50 µL,再加入辣根过氧化物酶100 µL,37 ℃恒温孵育60 min,弃液拍干,洗涤液洗涤5次后,每孔加底物A、B各50 µL,37 ℃避光孵育15 min,加终止液50 µL 并在15 min 内于450 nm波长处测定OD值。
1.3.5.3 肝组织qPCR检测 提取肝组织总RNA,将4 µL的HiScript Ⅱ Q RT SuperMix和16 µL的RNA溶液(1 µg总RNA)制成20 µL的上样体系,在50 ℃、15 min,85 ℃、5 s的条件下,逆转录成cDNA。cDNA 与引物和ChamQ Universal SYBR qPCR Master Mix 混合在95 ℃、2 min,95 ℃、10 s,60 ℃、30 s,40 个循环的条件下进行扩增,读取Ct值。以2-△△Ct方法计算结果。
1.3.5.4 肝组织HE 染色 肝组织固定24 h后,依次经过50%乙醇,70%乙醇,90%乙醇,无水乙醇,逐级脱水。二甲苯中透明40 min。包埋,以4 µm 进行切片,贴片。
石蜡切片置于70 ℃烤箱中,烤片1 h,脱蜡,依次通过100%乙醇,90%乙醇,每种醇溶液10 min,进行水化。苏木素染色2 min,自来水冲洗。伊红染色液染色20 s,自来水冲洗,镜下观察染色情况。中性树脂封片。
1.3.5.5 肝组织油红染色 将冰冻切片置室内回温5~10 min,试剂一应用液染色10~15 min,37 ℃蒸馏水洗涤5~20 s,试剂二复染液染色3~5 min,蒸馏水洗30~60 s,滴加试剂三水性封固剂进行封片,随后镜检。
1.3.5.6 肝组织髓过氧化物酶(MPO)免疫组化染色石蜡切片进行烤片、脱蜡、水化。抗原修复:将切片浸泡于1×EDTA/柠檬酸钠抗原修复液中,再置于微波炉中,高火5 min,低火15 min 修复。室温冷却。PBS 洗涤3 次,每次5 min。免疫组化笔画圈后用3%的过氧化氢阻断剂封闭30 min。PBS 洗涤3 次,每次5 min。用10% BSA 溶液室温封闭1 h。一抗4 ℃孵育过夜。室温平衡20 min。PBS 洗3 次,每次5 min。二抗室温孵育1 h。PBS 洗3 次,每次5 min。DAB 显色,苏木素复染。中性树脂封片。
1.3.5.7 肝组织超氧化物歧化酶(SOD)和丙二醛(MDA)检测[19]称取肝组织并按质量(g)∶体积(mL)=1∶9的比例加入生理盐水并匀浆,离心取上清液,一部分上清液用BCA 测定蛋白浓度。后续测定SOD 和MDA。
1.4 统计学方法 采用SPSS 25.0 软件进行统计学分析。计量资料以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 网络药理学分析
2.1.1 ZZDHT 活性成分及ALD 相关基因的筛选通过TMSP 数据库共检索得到符合筛选标准活性成分53 个,对应227 个靶点。通过GeneCards、OMIM、PharmGkb、TTD和DrugBank上检索得到ALD相关基因8 685 个,将两者取交集后得到222 个药物-疾病靶点(图1)。使用Cytoscape3.8.0 软件对这些靶点进行可视化处理,得到ZZDHT的复方调控网络图(附录A)。

图1 ZZDHT和ALD交集靶点venn图Figure 1 Venn diagram of ZZDHT and ALD intersection target
2.1.2 ZZDHT-ALD 的PPI网络构建和可视化 使用String 平台中对222 个药物-疾病靶点进行PPI 网络构建,并通过Cytoscape3.8.0 软件CytoNCA 插件对PPI构建结果进行网络拓扑结构分析,以BC、CC、DC、EC、LAC、NC 各项得分均大于分数中位值进行过滤,最终筛选出45 个核心节点基因,186 条边。根据Degree 值的大小对节点进行排序,排名前10 位的节点分别为MAPK3、JUN、TP53、MAPK1、RELA、MYC、MAPK14、TNF、FOS、AKT1(附录B)。
2.1.3 ZZDHT-ALD 的GO 功能分析和KEGG 通路富集分析 通过对45个核心基因进行功能富集分析,结果显示45 个核心基因涉及功能和通路与氧化应激和炎症反应密切相关。其中GO 富集到response to oxygen-containing compound、cellular response to oxygencontaining compound、response to lipid等主要功能,KEGG富集到interleukin-6 signaling、TNF signaling pathway、alcoholic liver disease、inflammatory mediator regulation of TRP channels 和AMPK signaling pathway 等主要通路(图2、3)。

图2 核心靶点的GO富集分析图Figure 2 GO enrichment analysis of core target
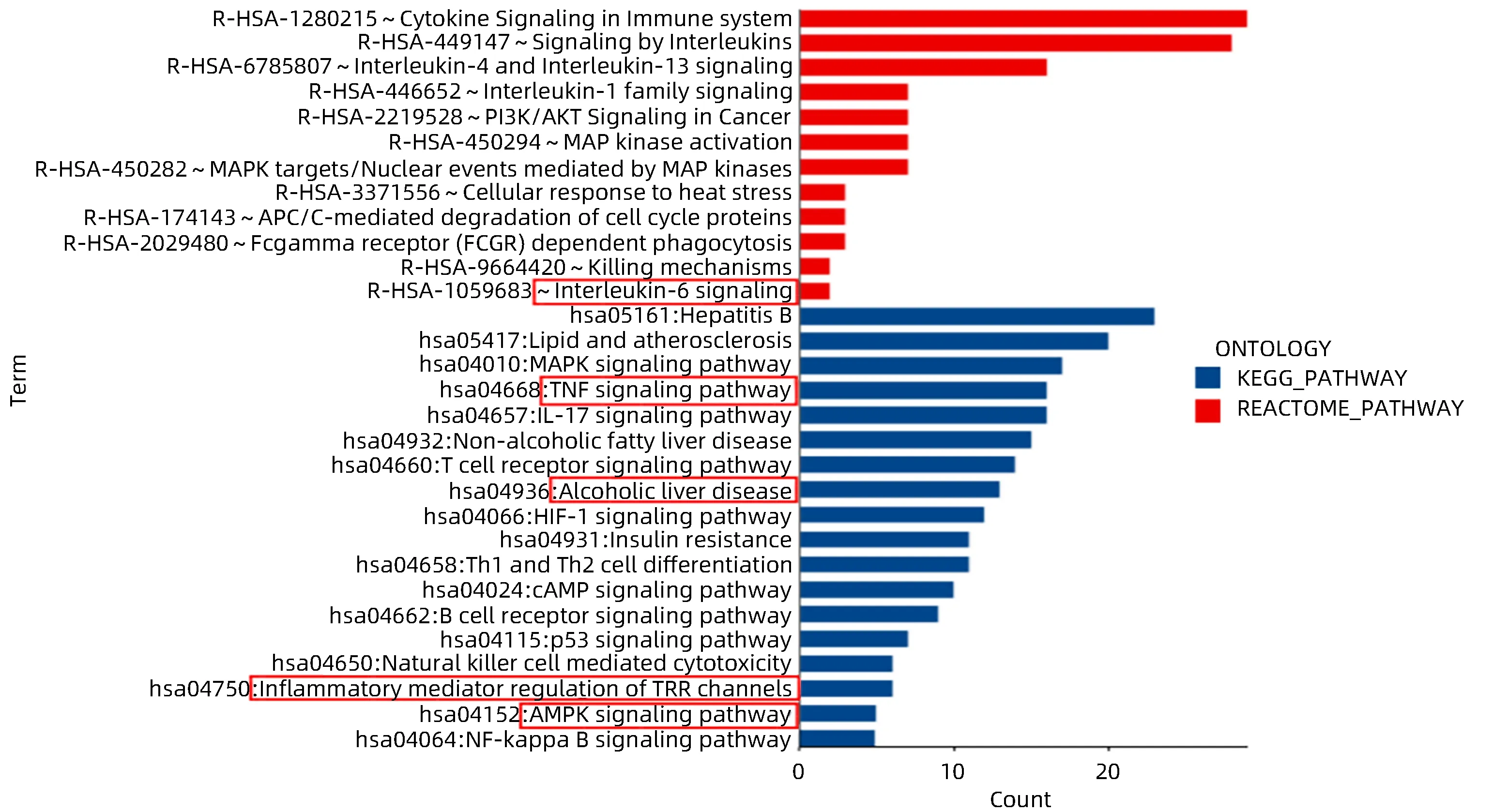
图3 核心靶点的KEGG富集分析图Figure 3 KEGG enrichment analysis diagram of core target
2.2 非靶代谢组分析 通过对ZZDHT 组小鼠和对照组小鼠肝组织和血清的非靶代谢组分析,以|logFC|>1进行筛选,得到ZZDHT在小鼠肝脏中差异代谢物225个,在血清中差异代谢物227 个,共同代谢物126个(图4)。
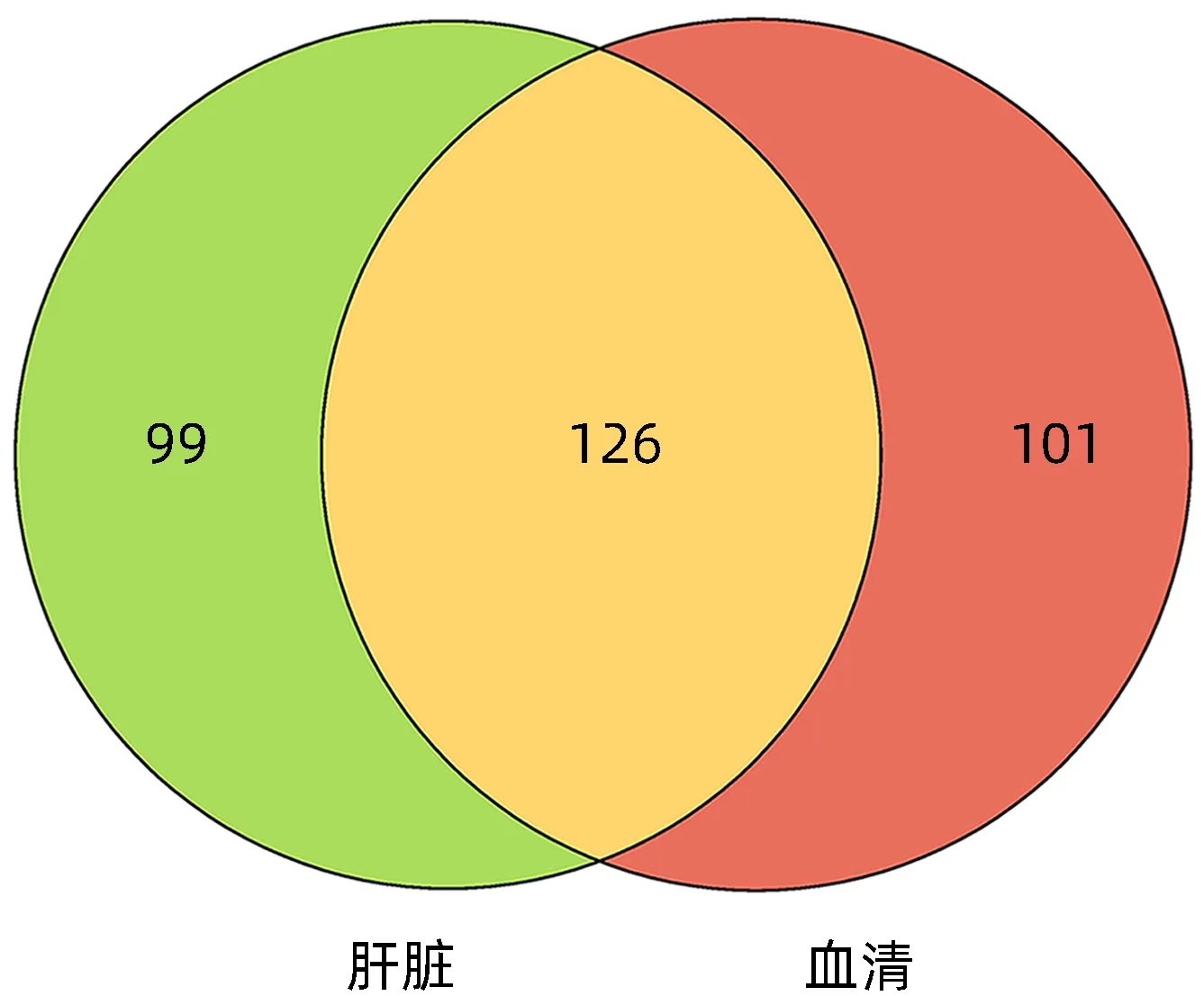
图4 ZZDHT在肝脏和血清中的差异代谢物交集venn图Figure 4 Venn diagram of different metabolites of ZZDHT in liver and serum
通过KEGG进行代谢物通路富集分析,结果显示,肝 脏 代 谢 物 与Glycerolipid metabolism、Inflammatory mediator regulation of TRP channels、Biosynthesis of unsaturated fatty acids 和Fatty acid biosynthesis 等通路有关;血清代谢物与AMPK signaling pathway、Oxidative phosphorylation 和Inflammatory mediator regulation of TRP channeis等通路有关。肝脏和血清中代谢通路均与脂质代谢和氧化应激紧密相关(图5、6)。
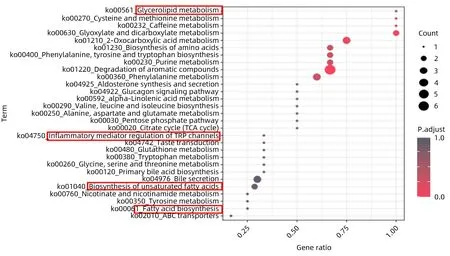
图5 肝脏差异代谢物KEGG富集分析图Figure 5 Analysis of KEGG enrichment of liver differential metabolite
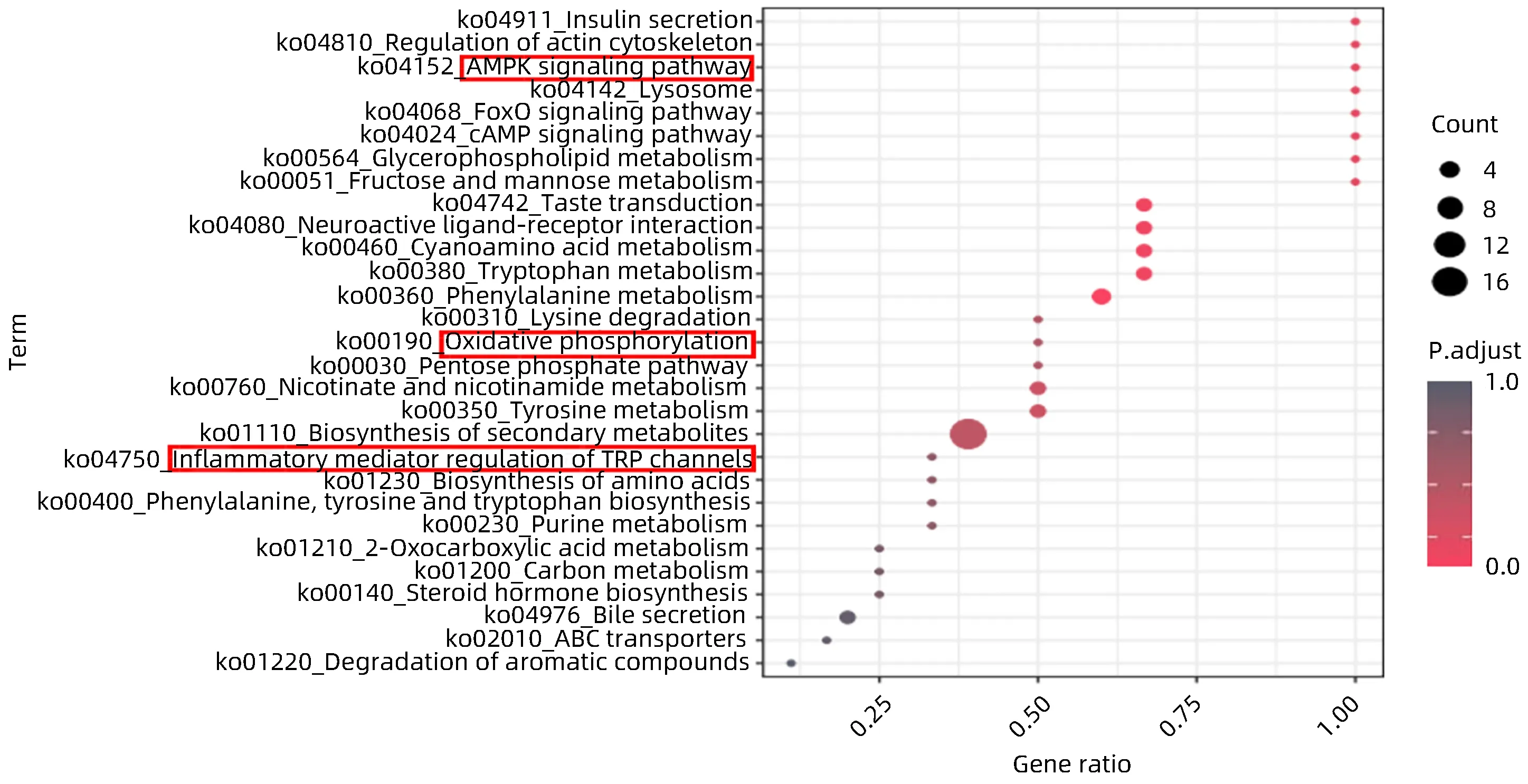
图6 血清差异代谢物KEGG富集分析图Figure 6 Enrichment analysis of serum differential metabolite KEGG
2.3 ZZDHT对NIAAA模型小鼠的调节作用
2.3.1 ZZDHT 对NIAAA 模型小鼠肝脏和脾脏的改善 对照组肝脏表面光滑有亮泽,脾脏红润,大小适中;模型组小鼠肝脏表面有粗糙颗粒感,脾脏有轻微淤血;ZZDHT(L)组小鼠肝脏表面有轻微粗糙感,脾脏红润,大小适中;ZZDHT(M)和ZZDHT(H)组小鼠肝脏表面较光滑,脾脏红润,大小适中(图7)。
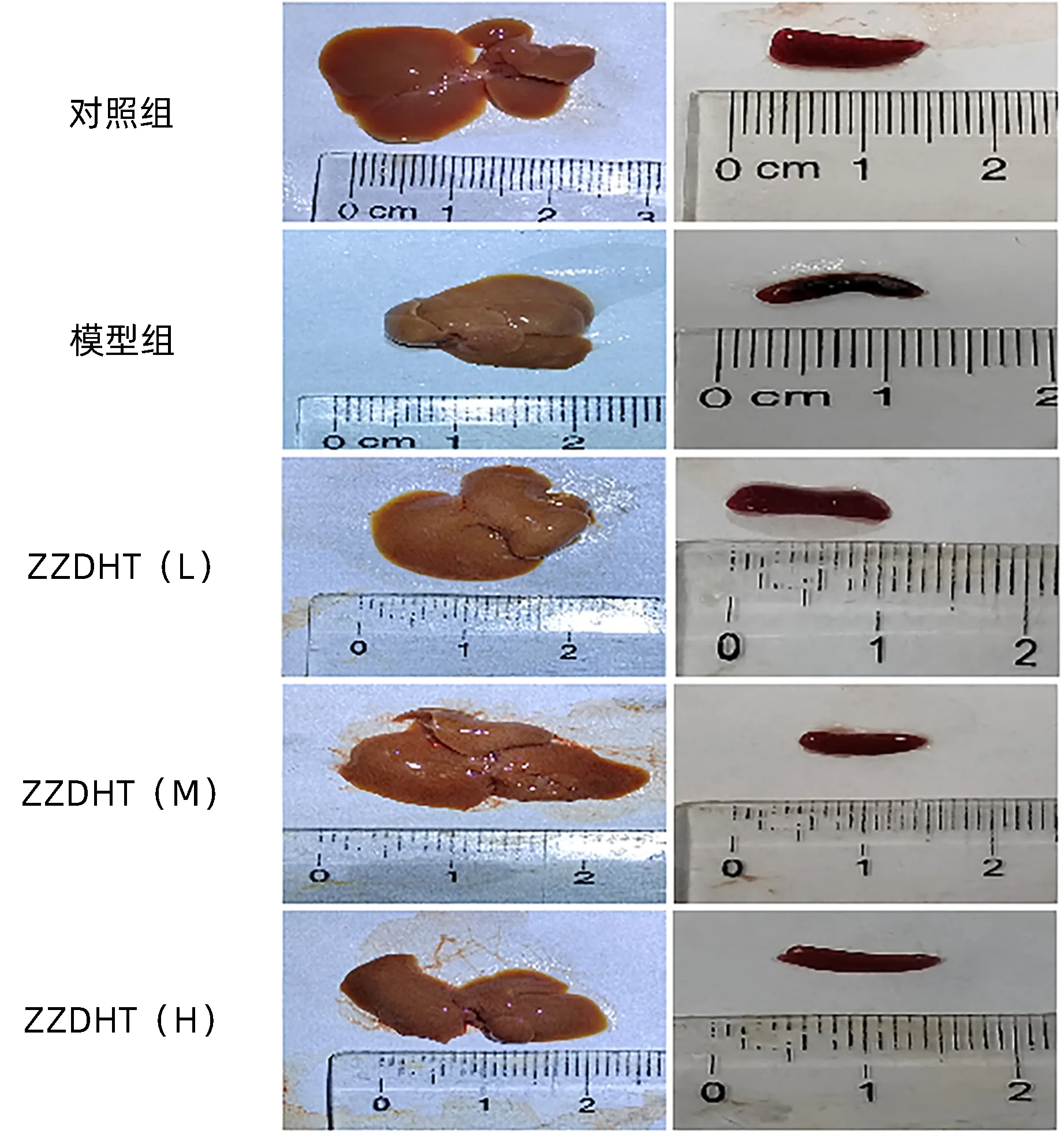
图7 ZZDHT对NIAAA模型小鼠肝脏和脾脏大体观的改善作用Figure 7 The improvement effect of ZZDHT on the liver and spleen of NIAAA model mice
2.3.2 ZZDHT 降低NIAAA 模型小鼠血清ALT、AST和TG 水平 与对照组相比,模型组小鼠血清AST、ALT 和TG 水平均明显升高(P值均<0.05),与模型组相比,ZZDHT(L)、ZZDHT(M)和ZZDHT(H)组小鼠血清AST、ALT 和TG 水平均明显降低(P值均<0.05),各用药组组间差异无统计学意义(P值均>0.05)(图8)。
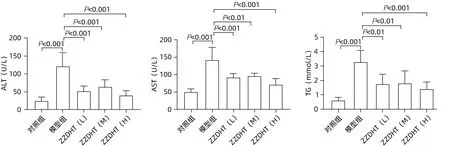
图8 ZZDHT对NIAAA模型小鼠血清ALT、AST和TG表达水平的调节作用Figure 8 The regulatory effect of ZZDHT on the expression level of serum ALT, AST and TG in NIAAA mice
2.3.3 ZZDHT 对NIAAA 模型小鼠肝组织结构的影响 HE 结果显示,对照组肝细胞形态正常,肝小叶结构正常;模型组见严重脂肪变性坏死,组织结构破坏严重,可见炎性细胞浸润;ZZDHT(L)、ZZDHT(M)和ZZDHT(H)组肝细胞脂肪变性和炎症浸润明显轻于模型组,各用药组组间无明显差异,ZZDHT(L)组脂肪变性小气泡略多于其他用药组(图9)。
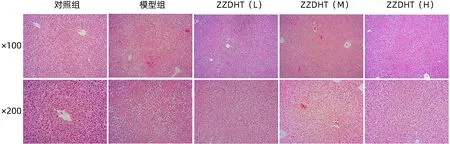
图9 ZZDHT对NIAAA模型小鼠肝组织结构的影响(HE染色)Figure 9 The effect of ZZDHT on the liver tissue structure of NIAAA model mice (HE staining)
2.3.4 ZZDHT 减少NIAAA 模型小鼠肝脏脂质沉积肝组织油红染色结果显示,与对照组相比,模型组脂肪浸润明显加重(P<0.05),与模型组相比,ZZDHT(M)脂肪浸润明显减轻(P<0.05)(图10)。
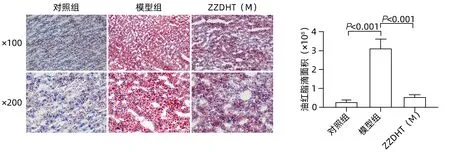
图10 ZZDHT对NIAAA模型小鼠肝脏脂质沉积的改善作用(油红染色)Figure 10 Improvement effect of ZZDHT on liver lipid deposition in NIAAA model mice (oil red staining)
2.3.5 ZZDHT 减少NIAAA 模型小鼠肝脏中性粒细胞浸润 MPO 染色结果显示,与对照组相比,模型组MPO 阳性数量明显增多,与模型组相比,ZZDHT(M)组阳性数量明显减少(图11)。
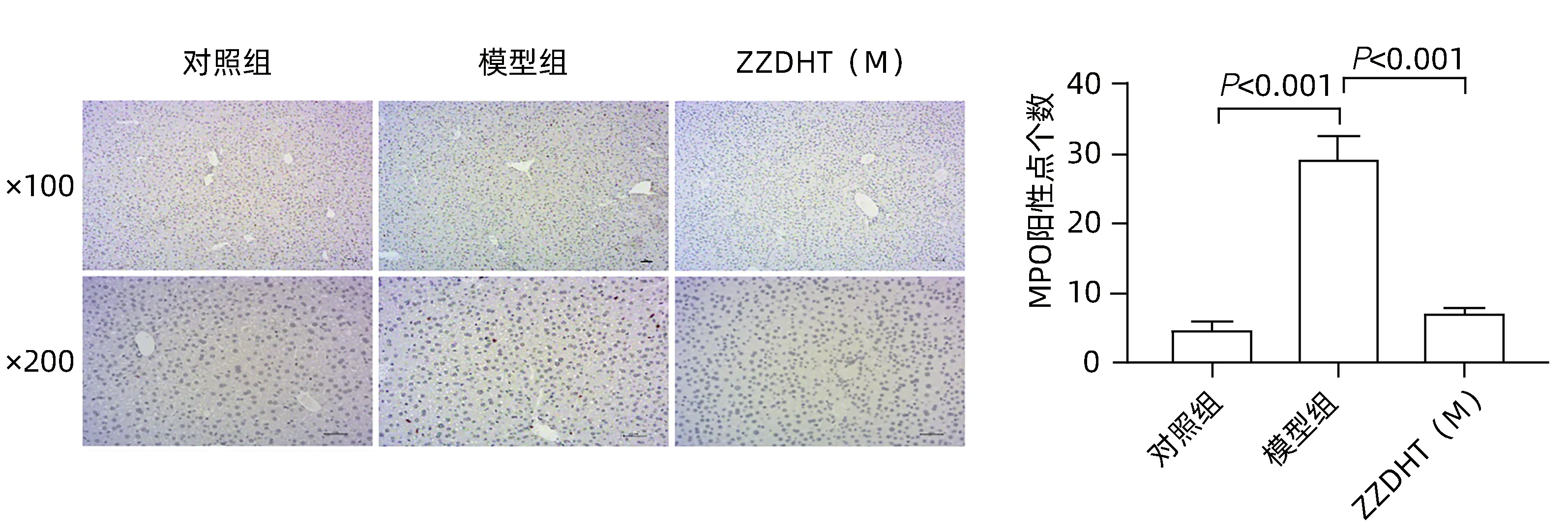
图11 ZZDHT对NIAAA模型小鼠肝脏中性粒细胞浸润的改善作用(免疫组化染色)Figure 11 Improvement effect of ZZDHT on liver neutrophil infiltration in NIAAA model mice (IHC staining)
2.3.6 ZZDHT 改善NIAAA 模型小鼠肝脏氧化应激和炎症反应
2.3.6.1 肝组织 与对照组相比,模型组Ly6g、Ncf1、Ncf2、IL-6、TNF-α、IL-1β 水平均明显升高(P值均<0.05),与模型组相比,ZZDHT(M)组Ly6g、Ncf1、Ncf2、IL-6、TNF-α、IL-1β 水平均明显降低(P值均<0.05)(图12)。与对照组相比,模型组SOD 水平明显降低(P<0.05),与模型组相比,ZZDHT(M)组SOD 水平明显升高(P<0.05);与对照组相比,模型组MDA、4-HNE、Gp91 和P22 水平均明显升高(P值均<0.05),与模型组相比,ZZDHT(M)组MDA、4-HNE、Gp91 和P22水平均明显降低(P值均<0.05) (图13、14)。
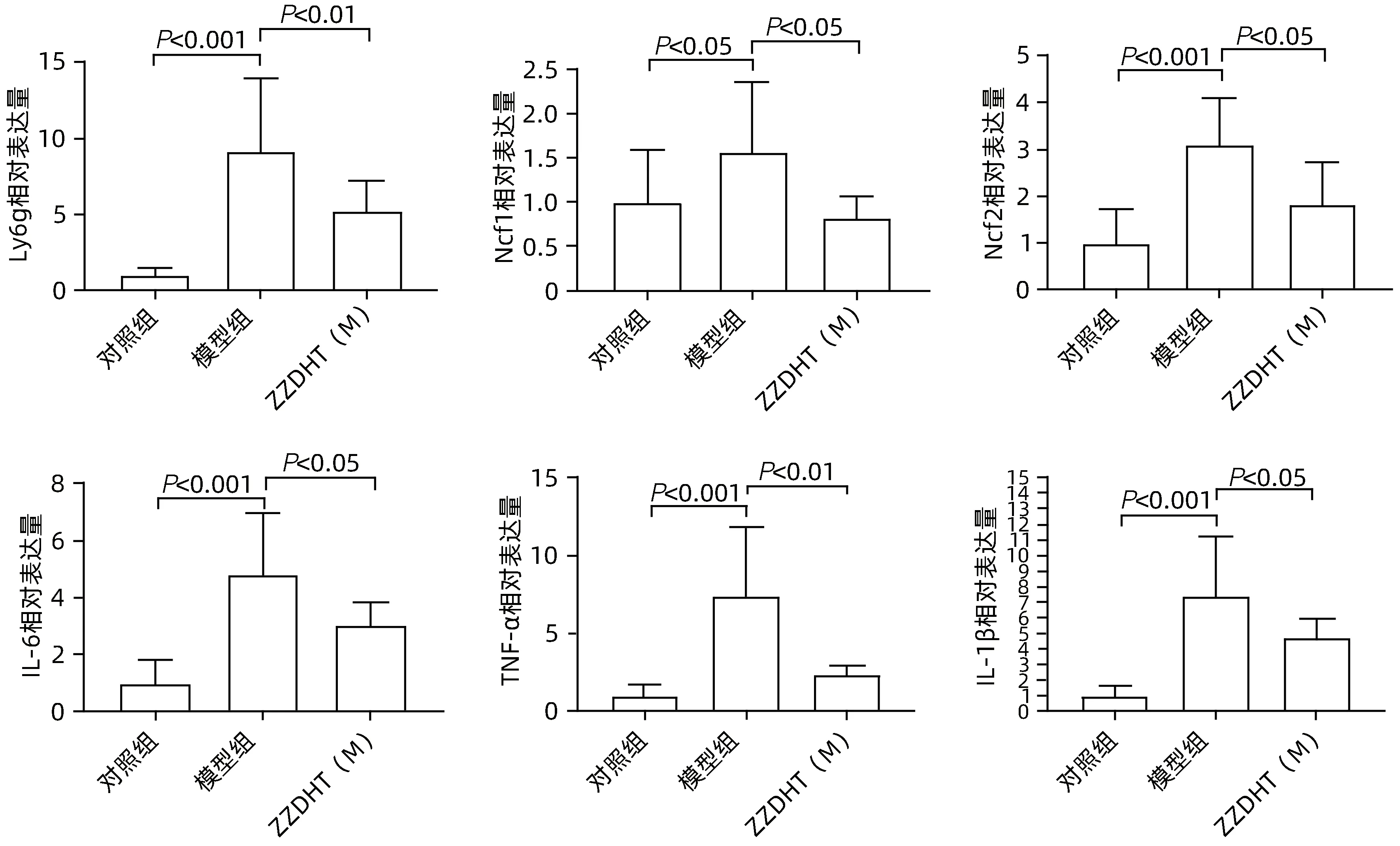
图12 ZZDHT对NIAAA模型小鼠肝脏氧化应激和炎性因子的调节作用Figure 12 The regulatory effect of ZZDHT on liver oxidative stress and inflammatory factors in NIAAA model mice
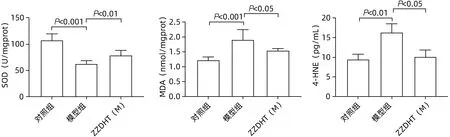
图13 ZZDHT对NIAAA模型小鼠肝脏SOD、MDA和4-HNE蛋白水平的调节作用Figure 13 Regulation of ZZDHT on liver SOD, MDA and 4-HNE protein levels in NIAAA model mice
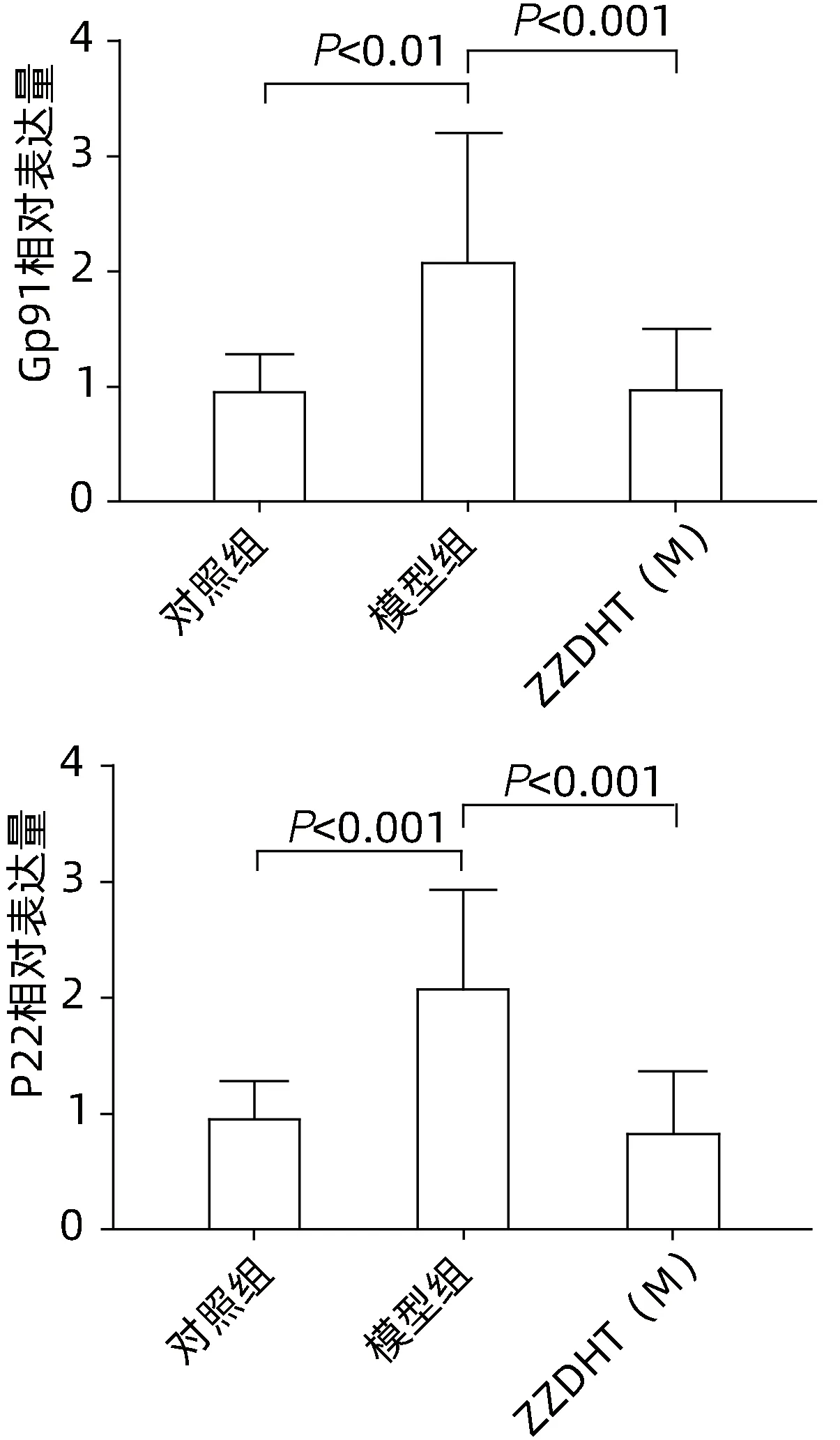
图14 ZZDHT对NIAAA模型小鼠肝脏Gp91和P22基因水平的调节作用Figure 14 Regulation of ZZDHT on Gp91 and P22 gene levels in liver and liver of NIAAA model mice
2.3.6.2 血清 与对照组相比,模型组4-HNE水平明显升高(P<0.05),与模型组相比,ZZDHT(M)组4-HNE水平明显降低(P<0.05)。与对照组相比,模型组GSHPx 水平均明显降低(P<0.05),与模型组相比,ZZDHT(M)组GSH-Px水平均明显升高(P<0.05)(图15)。
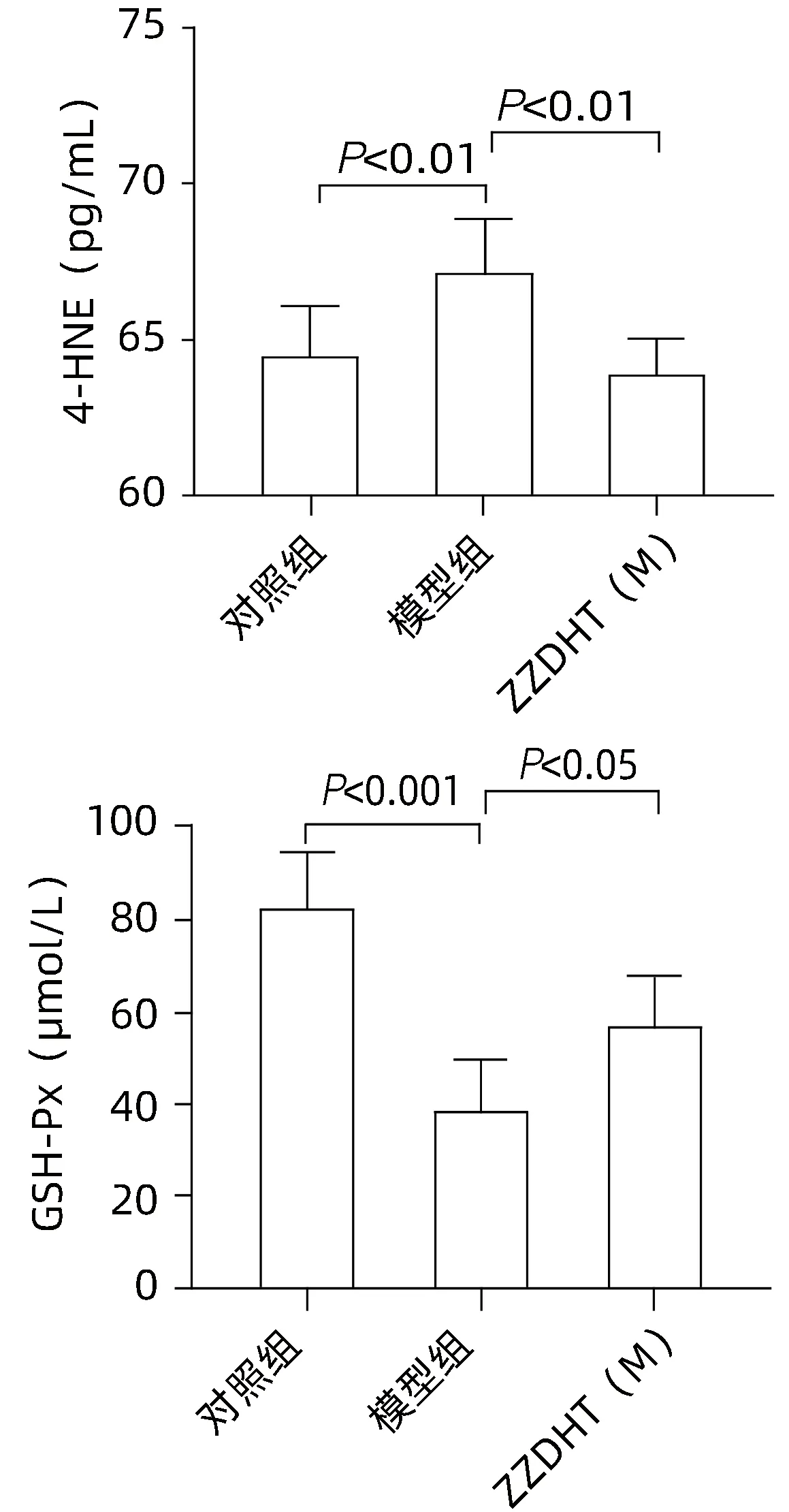
图15 ZZDHT对NIAAA模型小鼠血清4-HNE和GSH-Px的调节作用Figure 15 The regulatory effect of ZZDHT on serum 4-HNE and GSH-Px in NIAAA model mice
3 讨论
栀子大黄汤出自《金匮要略》,为其治疗酒疸的方药,《金匮要略》中原文为“心中懊憹而热,不能食,时欲吐,名曰酒疸”[13]。酒疸是由于嗜酒伤中,湿热内蕴所致;酒热伤胃,所以心中懊憹而热;饮酒过多,助湿蕴热,影响脾胃的升降,故不能食,时欲吐;湿热熏蒸肝胆,胆汁外溢肌表而身黄[15]。由此可见,酒疸与嗜酒过度发病有关,所以跟ALD 病因一致,同属一类疾病。酒为湿热之品,饮酒无节会导致湿热之邪内蕴,胆热液溢,浸淫肌肤而发黄疸。栀子大黄汤由栀子、大黄、淡豆豉和枳实组成,其中栀子,归心经、肺经、三焦经,有清热利湿、泻火除烦的功效,可除酒疸之“心中懊憹而热”。大黄,归脾胃经、肝经、大肠经、心包经,有清热泻下的功用[20],《金匮要略》原文中有“酒疸,心中热,欲吐者,吐之愈”,“酒黄疸者,或无热,靖言了了,腹满欲吐,鼻燥。其脉浮者先吐之,沉弦者先下之”[21]。大黄因其清泻之力,可用“沉弦着下之”退尽酒疸之热毒,而栀子和大黄的通用功效为利胆退黄,祛除黄疸尿赤,“酒疸”属于“黄疸”一类,病情严重者会有身目黄赤之状,此二味药可共奏祛黄之效。淡豆豉由遍身湿热导致的心中懊憹或热痛,可通过栀子大黄汤的上下分消尽数消除,淡豆豉、栀子可上清湿热,枳实、大黄可中泄热湿,使湿热从上、下(二焦)分消而解。其中酒疸脉浮者,当先吐之,吐之可用淡豆豉;脉沉弦者,当先下之,下之用大黄,因此栀子大黄汤同时兼有吐、下的功能。
随着网络药理学的兴起与发展,利用网络药理学方法分析中药复方“多成分-多靶点-多通路”的技术日益成熟。通过网络药理学方法筛选ZZDHT 中化学成分的靶点基因,并与ALD 靶点基因进行映射,发现222 个交集靶点基因。将这些靶点基因进行GO 富集和KEGG 通路分析、化学成分-靶点-通路及蛋白互作网络分析,探讨ZZDHT“多成分-多靶点-多通路”的作用机制。
ALD 因过量饮酒导致,后期体内病理变化涉及多基因突变、一系列分子事件的动态变化,如信号通路活化、炎性细胞聚集、炎性因子过表达及氧化应激等。本研究通过网络药理学分析得出ZZDHT 与ALD 的核心靶点基因多富集在氧化应激和炎症相关通路,非靶代谢组分析得出ZZDHT 与ALD 核心通路与氧化应激和炎症相关通路有关。Chu 等[22]动物和细胞研究显示,氧化应激是导致ALD 的重要原因,具有抗氧化和抗炎作用的药物才能更有效的保护肝脏。而Ncf1 和Ncf2 是NADPH 氧化酶复合体的重要功能亚基[23-24]。Kim 等[25]动物研究显示,与抗氧化应激相关基因的缺失会导致小鼠肝损伤。ALD 的发病机制复杂,但是乙醇的氧化代谢产物ROS 和乙醛在ALD 中起着促进疾病发生发展的作用[26],乙醛同时还促进ROS 的产生,ROS 的增加会诱导氧化应激[27]。ALD 的特征之一是肝脏中性粒细胞的浸润,它通过产生ROS、释放蛋白酶和产生促炎介质来对抗细菌感染,并加重肝细胞损伤、肝脏炎症和纤维化。酒精会增加中性粒细胞向肝脏的募集,募集的中性粒细胞可以通过其标志物Ly6G和MPO 来检测到[9]。中性粒细胞募集后释放有害介质,如过氧化氢、弹力酶、氯胺和蛋白酶-3,这些物质都与ALD 的发生发展有关[28]。中性粒细胞的移动促进了它们与趋化因子修饰的内皮细胞的接触,从而被诱导激活。完全激活可能是一个由促炎性细胞因子,如TNF-α、IL-1β 和IL-6,启动的两个步骤的过程。而中性粒细胞被激活时,会产生大量的ROS 和自由基。有研究表明,AMPK 通路的激活可调节自噬,自噬在去除脂滴中起重要作用[29],活化AMPK可以减少脂质堆积[30-31],促进脂肪酸氧化[32]。有临床研究[28]表明,IL-6 的活性改变在ALD 的发展过程中起着重要作用。同时有动物研究[11]显示,抑制IL-6的表达可改善乙醇诱导的肝损伤。而IL-1β对ALD中的脂肪变性和炎症反应有促进作用[33]。本研究结果显示,ZZDHT 能显著降低ALD 小鼠模型炎症因子TNF-α、IL-6、IL-1β 和中性粒细胞相关指标Ly6g、Ncf1、Ncf2 的水平,同时能显著改善肝组织SOD、MDA、4-HNE 和血清氧化应激指标4-HNE、GSH-Px,有效降低肝脏ALT、AST、TG 水平,提示ZZDHT 可能通过调节肝脏炎症和氧化应激状况,改善ALD。
综上所述,ZZDHT 可有效改善NIAAA 模型小鼠的肝脏脂质沉积和炎症损伤,非靶向代谢组学结果提示,ZZDHT 可能通过多条通路干预ALD 小鼠肝脏中氧化应激和中性粒细胞浸润,改善小鼠肝脏状态,为后续进一步研究其具体分子作用机制提供了一定参考方向。
伦理学声明:本研究方案于2023年2月9日经由上海南方模式生物研究中心伦理委员会审批,批号:2023-0003,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:侯逸文负责课题设计,资料分析,撰写论文;张荣杰、纪龙珊、李茜参与收集数据,修改论文;高月求、李曼负责拟定写作思路,指导撰写文章并最后定稿。

