肝硬化发生骨量丢失的临床特征及其与肌少症的相关性
金 秋, 杨 婧, 马红琳, 孙正豪, 刘清清, 胡绍山, 李苹菊
昆明医科大学第二附属医院消化内科, 昆明 650000
骨质疏松症(osteoporosis,OP)是一种全球性的影响健康的隐匿性疾病,由于骨矿物质和骨量减少、骨小梁与皮质骨微观结构的改变导致骨脆性增加,骨折风险随之上升。骨量减少是指介于正常骨量和OP 之间的状态,通常认为骨量减少是OP 的前阶段,若不能早期发现和干预则易逐步发展为OP,骨量丢失包括OP和骨量减少。肝硬化人群中OP的发生率为20%~43%[1],骨量减少发生率为50.3%[2],显著高于普通人群,肝硬化本身和低骨密度(bone mineral density,BMD)相关。目前,肝硬化患者发生骨量丢失的危险因素尚未完全明确,研究认为肌肉-骨骼-脂肪三者之间相互影响,关于合并肌少症对骨量丢失影响的相关研究主要集中于原发性骨质疏松、2 型糖尿病和风湿免疫系统疾病的患者中,针对肝硬化患者的研究甚少,且当前尚无肝硬化人体成分分析和骨密度相关性的报道。本研究旨在探讨肝硬化患者发生骨量丢失的影响因素,探讨人体成分分析和骨密度的相关性,为防治肝硬化患者骨量丢失提供依据。
1 资料与方法
1.1 研究对象 选取2022年4月—2022年12月于本院住院治疗并确诊的肝硬化患者为研究对象。纳入标准:(1)肝硬化诊断符合2019年《肝硬化诊治指南》[3];(2)病例资料齐全者。排除标准:(1)年龄<18岁、妊娠、哺乳期患者;(2)伴有恶性肿瘤、血液系统疾病、肾衰竭、心脏衰竭患者;(3)长期使用双膦酸盐、钙片、维生素D 和性激素患者;(4)甲状腺功能亢进、甲状腺功能减退病史患者;(5)瘫痪、截肢者;(6)风湿免疫系统疾病患者;(7)肝硬化病因2种及以上者;(8)具有心脏起搏器者;(9)未绝经女性。
1.2 资料收集 收集患者住院期间的一般资料[包括年龄、性别、BMI、握力、肝硬化病因、Child-Pugh 分级、糖皮质激素使用史、富马酸替诺福韦二吡呋酯(TDF)服用史、吸烟史、饮酒史、高血压史、糖尿病史],实验室指标[包括Alb、ALT、AST、ALP、GGT、胆碱酯酶、TBil、TC、TG、钙、磷、PT、活化部分凝血活酶时间(APTT)、INR、25 羟基维生素D、Ⅰ型胶原羧基末端肽交联(β-C-terminal telopeptide of type 1 collagen,β-CTX)、骨 钙 素N 端 中 分 子 片 段(N-terminal mid-fragment of osteocalcin,N-MID)、甲状旁腺激素(parathyroid hormone,PTH)、降钙素(calcitonin,CT)]、影像学资料[包括双能X 线吸收骨密度检测(dual energy X-ray absorptiometry,DXA)、腹部CT]和人体成分分析。
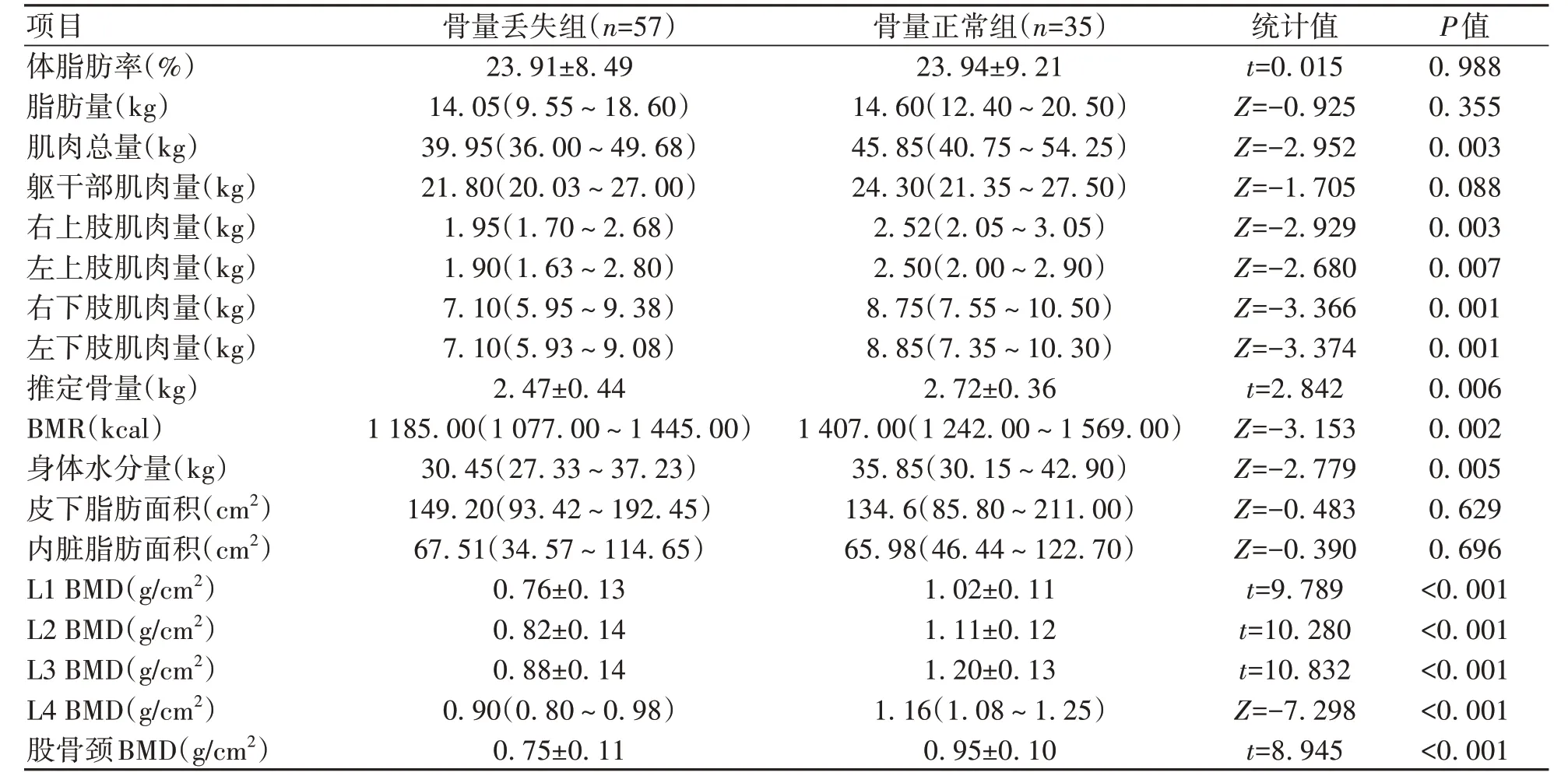
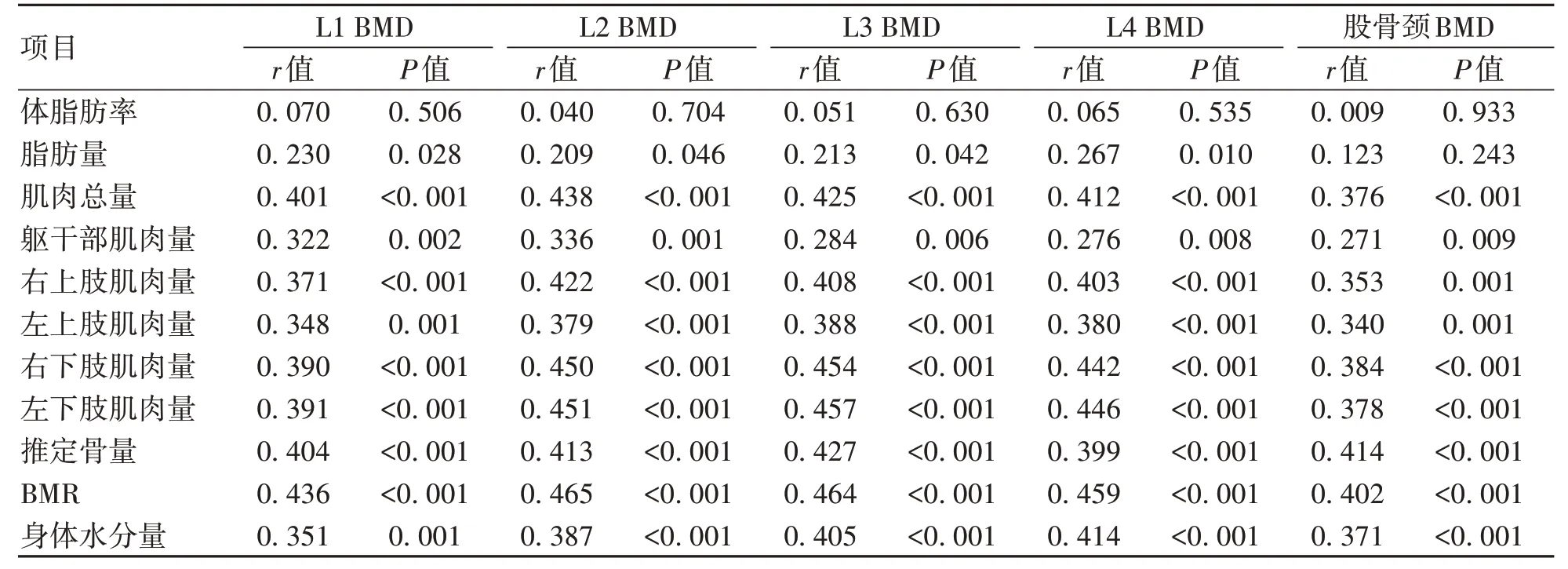
1.3 骨密度检测 由固定专业医生使用GE Health care13.31 的双能X 射线骨密度仪进行检测。受试者在检查前避免使用影响射线的药物、移除首饰等。指导受试者摆放正确体位,将测量部位暴露在X 线能够照射范围内。测定L1~L4 和股骨颈BMD(g/cm2),记录BMD、T-值和Z-值,根据我国《原发性骨质疏松症诊疗指南(2017)》[4],结合T-值、Z-值和脆性骨折史,对于≥50 岁的男性以及绝经后女性,T-值≥-1.0 诊断骨量正常,-2.5 1.4 L3-骨骼肌指数(SMI)测量 所有肝硬化患者均进行腹部CT 扫描,由同一名医生截取L3 水平横截面的图像,使用sliceOmatic 5.0 Rev-9 Alberta Protocol 软件进行图像处理,手动勾画L3 横截面CT 值在-29~150 的骨骼肌区域,由软件自动计算该区域面积即得L3-骨骼肌面积(图1),L3-SMI=L3-骨骼肌面积(cm2)/身高2(m2)。肝硬化患者肌少症的诊断:根据2019 年北美专家意见声明[5],推荐诊断肝硬化肌少症的L3-SMI临界值为男<50 cm2/m2,女<39 cm2/m2。 图1 L3-骨骼肌面积Figure 1 L3-skeletal muscle area 1.5 腹部脂肪面积测量 对肝硬化患者进行腹部CT 扫描,由同一名医生截取脐水平的横截面图像,使用sliceOmatic 5.0 Rev-9 Alberta Protocol 软件分别手动勾画出CT 值在-190~-30的皮下脂肪区域和CT 值在-150~-50 的内脏脂肪区域,通过软件自动计算皮下脂肪面积以及内脏脂肪面积(图2)。 图2 腹部脂肪面积Figure 2 Abdominal fat area 1.6 人体成分分析 由经验丰富的临床营养科医生使用百利达公司(TANITA Corporation)生产的型号MC-180身体成分分析仪,通过生物电阻抗法分析测量人体成分。具体方法为:测试开始前需明确患者体内未放置金属避免对结果产生干扰,交代患者排空尿液、脱去金属饰品、厚重衣物以及鞋袜,于系统上输入患者的基本信息(包括姓名、性别和身高等),在受试者安静状态下,受试者将双足分别站立在不锈钢电极材料上,根据系统提示,双手分别握住两个测量把手,双上肢自然下垂,保持身体站立,待测量完毕后获得人体成分相关数据,记录体脂肪率、脂肪量、肌肉总量、躯干部肌肉量、右上肢肌肉量、左上肢肌肉量、右下肢(含臀部)肌肉量、左下肢(含臀部)肌肉量、推定骨量、基础代谢率(basal metabolic rate,BMR)和身体水分量。 1.7 统计学方法 应用SPSS 25.0统计学软件进行数据分析。计量资料服从正态分布的以xˉ±s表示,两组间比较采用成组t检验;计量资料服从偏态分布的以M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验;计数资料两组间比较采用χ2检验、连续性修正χ2检验。Pearson 相关性分析用于服从双变量正态分布的计量资料,Spearman 相关性分析用于不服从双变量正态分布的计量资料。二元Logistic 回归分析骨量丢失的危险因素。P<0.05为差异有统计学意义。 2.1 一般资料 共纳入肝硬化患者92例,其中,骨量丢失组57例,男23例,女34例,平均(58.70±8.76)岁;骨量正常组35例,男25例,女10例,平均(51.91±8.83)岁。骨量丢失组患者的年龄、女性占比明显大于骨量正常组(P值均<0.05)。两组间BMI、握力、病因、Child-Pugh 分级、糖皮质激素使用史、TDF 服用史、吸烟史、饮酒史、高血压史、糖尿病史差异无统计学意义(P值均>0.05)(表1)。 表1 两组间一般资料比较Table 1 Comparison of general data between the two groups 2.2 骨量丢失组和骨量正常组实验室指标比较 与骨量正常组相比,骨量丢失组的N-MID、β-CTX 水平较高(P值均<0.05),CT水平较低(P<0.05),其余指标差异无统计学意义(P>0.05)(表2)。 表2 两组间实验室资料比较Table 2 Comparison of laboratory data between the two groups 2.3 骨量丢失组和骨量正常组发生肌少症的情况对比 骨量丢失组的L3-SMI 低于骨量正常组(P<0.05),合并肌少症的比例高于骨量正常组(P<0.05)(表3)。 2.4 骨量丢失组和骨量正常组人体成分分析、腹部脂肪面积和骨密度对比 骨量丢失组的肌肉总量、四肢肌肉量、推定骨量、BMR、身体水分量、L1~L4 BMD、股骨颈BMD均低于骨量正常组(P值均<0.05),两组间体脂肪率、脂肪量、躯干部肌肉量、皮下脂肪面积以及内脏脂肪面积差异均无统计学意义(P值均>0.05)(表4)。 表4 两组间人体成分分析、腹部脂肪面积和骨密度比较Table 4 Comparison of body composition analysis, abdominal fat area and bone mineral density between the two groups 2.5 人体成分分析和骨密度的相关性分析 相关性分析显示,肌肉总量、躯干部肌肉量、四肢肌肉量、推定骨量、BMR、身体水分量均与L1~L4 BMD和股骨颈BMD 呈正相关(P值均<0.05),脂肪量与L1~L4 BMD呈正相关(P值均<0.05)。未发现体脂肪率和BMD 的相关性(P值均>0.05)(表5)。 表5 人体成分和骨密度的相关性分析Table 5 Correlation analysis between body composition and bone mineral density 2.6 肝硬化骨量丢失的危险因素 根据肝硬化患者是否发生骨量丢失为因变量,以年龄、女性、N-MID、β-CTX、CT、肌少症、身体水分量和BMR 作为自变量纳入单因素Logistic 回归分析,因肌肉量和肌少症为同一类指标,故未纳入单因素Logistic 回归分析。进一步将单因素Logistic 回归分析中有意义的指标纳入多因素Logistic 回归分析,结果显示年龄、N-MID 和肌少症是肝硬化患者发生骨量丢失的独立危险因素(P值<0.05)(表6)。 表6 肝硬化骨量丢失危险因素的Logistic回归分析Table 6 Logistic regression analysis of risk factors for bone mass loss in cirrhosis 骨量丢失呈慢性起病,常因发生骨质疏松性骨折和慢性疼痛才引起患者重视。Zheng 等[6]研究证明,肝硬化患者的腰椎和股骨颈骨密度[分别为(1.02±0.16)g/cm2和(0.88±0.14)g/cm2]均明显低于健康同龄人[分别为(1.06±0.16)g/cm2和(0.93±0.11)g/cm2],且肝硬化患者低骨密度发生率较高[7]。增龄是公认导致低骨密度的危险因素之一,本研究结果显示,年龄是肝硬化患者发生骨量丢失的独立危险因素,提示随着年龄增长应注意防范骨量丢失的发生。本研究结果显示,女性更容易发生骨量丢失。 肝硬化营养不良发生率为50%~90%[8],这将导致患者的人体成分发生改变,具体表现为脂肪和肌肉组织含量随着肝硬化严重程度增加而降低[9]。肌肉对骨骼的机械附着有助于保护骨骼,肌少症和增龄密切相关,一项Meta 分析[10]表明我国社区老年男性和女性肌少症发生率分别为12.9%和11.2%。肝硬化患者肌少症发生率高于普通人群,为40%~70%[11],肝硬化发生肌少症存在其特殊的发病机制,涉及的机制包括促炎因子增加、胰岛素样生长因子1 水平降低、门体分流和氨基酸代谢改变导致血氨升高等[12]。肌细胞分泌的肌肉生长抑制素和鸢尾素等均对骨密度产生影响[13],肌肉与骨骼紧密联系。本研究发现,肌肉总量、躯干部及四肢肌肉量均和L1~L4 BMD、股骨颈BMD 呈正相关,证明了高肌肉质量对肝硬化患者的骨密度具有积极的作用,进一步研究表明肌少症是肝硬化发生骨量丢失的独立危险因素(OR=8.737,95%CI:2.237~34.129),和张静怡等[14]对慢性乙型肝炎患者的研究结论一致。 脂肪组织对骨骼的影响尚存争议,皮下脂肪可分泌芳香化酶促进成骨,内脏脂肪则能上调炎症因子的表达促进破骨细胞分化。瘦素和脂联素作为脂肪因子均具促骨形成和骨吸收的双重作用,但具体以哪一种作用为主尚无定论[15-16]。本研究发现皮下脂肪面积和内脏脂肪面积的组间差异不具有统计学意义。Fan 等[17]对绝经后女性的研究发现总脂肪质量和骨密度呈正相关,本研究同样证明脂肪量和骨密度呈正相关,但相关性较弱,表明脂肪组织可能具有保护骨密度的作用,未来仍需进一步研究。 BMR是人体维持心跳、呼吸等基本生命所需最低的能量消耗。Hsu等[18]研究发现,BMR和中老年女性股骨颈骨密度呈正相关。和上述研究结果相似,本研究中骨量丢失组BMR 显著低于骨量正常组,BMR 和L1~L4 BMD 以及股骨颈BMD 呈正相关,表明低BMR可能是肝硬化患者骨量丢失的预测因子。肌少症和衰弱的存在与BMR 降低相关[19],本研究骨量丢失患者中合并肌少症的人数较多,患者因衰弱以及长期久坐导致活动减少,以上因素可能导致骨量丢失组的BMR显著降低。 人体水分约占体质量的40%~60%。针对健康中年男性体成分的研究[20]表明,身体水分量随着增龄而逐渐降低,骨量减少组的身体水分量低于骨量正常组。本研究结果同样显示,肝硬化骨量丢失组的身体水分量明显降低,相关性分析显示身体水分量和骨密度呈正相关,对于身体水分量减少的患者需警惕骨量丢失的发生。 N-MID 和β-CTX 分别作为骨形成和吸收的指标,不仅能够反映OP患者的疗效,还能够预测骨质疏松性骨折的发生[21-23]。本研究结果显示,骨量丢失组N-MID和β-CTX 均高于骨量正常组,且N-MID 是骨量丢失的独立危险因素。本研究证明骨量丢失患者的骨形成和骨吸收均增加,提示肝硬化骨量丢失和高骨转换密切相关,可能的原因是骨吸收大于骨形成而逐步导致骨量丢失,和江雅平等的研究结果一致[24]。本研究中,骨量丢失组降钙素低于骨量正常组,值得注意是,25羟基维生素D 的组间差异虽无统计学意义,但两组均处于缺乏状态。骨密度仅能反应骨骼强度,而测定骨代谢标志物有助于了解当前骨代谢变化情况。 长期使用糖皮质激素可致低骨密度,本研究未发现糖皮质激素使用史是骨量丢失的独立危险因素,可能系本研究中自身免疫性肝炎患者和有糖皮质激素使用史的人数较少,部分患者既往使用激素时长较短尚未对骨骼带来不利影响。 综上,高龄、女性与合并肌少症者更易发生骨量丢失,N-MID 和β-CTX 水平升高,CT、肌肉量、推定骨量、BMR和身体水分量降低者同样易骨量丢失。肌少症、年龄和N-MID 是肝硬化骨量丢失的独立危险因素。人体成分和骨密度具有相关性,通过生物电阻抗法测定人体成分的变化有助于评估患者骨骼状态,优化人体成分利于保护骨骼健康。本研究存在一定局限性,这是一项单中心的横断面研究,仍存在样本量较小的问题,未能将患者按照性别分组单独分析男性和女性发生骨量丢失的临床特征。由于Child-Pugh C级患者病情重,考虑患者外出检查的安全性,纳入该类患者的人数较少,未来仍需多中心、大样本的研究给予验证。 伦理学声明: 本研究方案于2022年4月8日经由昆明医科大学第二附属医院伦理委员会审批,批号:审-PJ-科-2022-66,所有入组对象均已签署知情同意书。 利益冲突声明: 本文不存在任何利益冲突。 作者贡献声明:金秋负责课题设计,数据收集,文章构思并撰写论文;马红琳、孙正豪、李苹菊、胡绍山、刘清清参与数据收集,查阅分析文献;杨婧负责指导论文撰写与定稿。

2 结果


3 讨论

