《2023年欧洲肿瘤内科学会临床实践指南:胰腺癌的诊断、治疗和随访》意见要点
陈哲然, 辛 磊, 王洛伟
海军军医大学第一附属医院消化内科, 上海 200433
2023 年9 月欧洲肿瘤内科学会(ESMO)发表了有关胰腺癌(PC)临床评估和管理实践的指南[1]。该指南由来自欧洲、亚洲和美国多家单位的多学科专家制定,涵盖了诊断、分期、风险评估、治疗、疾病监测和随访等多个方面。该指南基于现有的研究数据和专家的集体意见制定,并强调在临床实践中所有建议均应与患者进行共同讨论并决策;证据水平和推荐等级采用了美国感染病学会-美国公共卫生服务分级系统,证据级别由强至弱分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ五个等级,推荐强度由强至弱分为A、B、C、D、E五个等级。
1 发病率与流行病学
推荐意见:
(1)强烈建议戒烟、限制酒精摄入量、保持健康体质量,以降低PC的发病风险(Ⅲ,A)。
(2)有高危家族史的人群应接受遗传咨询,并考虑纳入筛查范围(Ⅲ,A)。
(3)建议高危人群从50 岁(或比最年轻的患病亲属发病年龄早10 岁)后在专业医疗中心进行PC 监测(Ⅲ,A)。监测手段首选每年进行超声内镜(EUS)或胰腺MRI检查(Ⅳ,B)。
2 诊断、病理学与分子生物学(图1)
2.1 影像学
推荐意见:
(4)怀疑PC 的患者影像学检查首选多期对比增强胸腹部和盆腔CT(包括动脉晚期和门静脉期)(Ⅲ,A)。
(5)若因胰头梗阻出现黄疸,应在胆管引流或支架置入前行影像学检查(Ⅳ,A)。
(6)应在开始治疗前4 周内进行影像学检查(Ⅲ,A)。
(7)当无法接受CT检查、CT诊断不明或存在胰腺囊性病变时,可选择腹部MRI(Ⅳ,A);胸部CT 是必要的(Ⅲ,A)。
(8)建议采用专用成像方案(Ⅳ,B),影像学检查的综合分析应采用标准化报告模板(Ⅳ,A)。
(9)不建议使用PET-CT 诊断PC 原发肿瘤(Ⅲ,D),但可用于对局部PC 进行分期以及判断是否存在远处转移(影像学可疑或CA 19-9水平升高)(Ⅲ,B)。
(10)建议在手术前进行肝脏MRI,以确认是否存在肝脏小转移灶(Ⅲ,B)。
(11)应在化疗开始之前获得PC 的细胞学或活检证据,首选经EUS引导下获得(Ⅲ,A)。
(12)所有局部PC 患者的影像学检查都应经过多学科团队阅片,多学科团队应包括影像科、外科和肿瘤科专家(Ⅲ,A)。
2.2 分子生物学
推荐意见:
(13)有高危家族史的人群应接受遗传咨询(Ⅲ,A)。
(14)通常建议患者进行KRAS 和BRCA 检测(Ⅳ,B)。
(15)如果二代测序显示为KRAS 野生型,可进一步对罕见、但对治疗有积极意义的基因突变进行测序(Ⅳ,B)。
①对于KRAS野生型转移性PC患者,应评估微卫星不稳定状态、NTRK 融合情况和其他罕见的融合突变(Ⅲ,B)
②若未行多基因测序,可使用标准方法检测微卫星不稳定和NTRK融合(Ⅳ,B)。
(16)CA19-9可作为评估疾病负担、指导治疗决策的血清标志物(Ⅲ,B)。
3 分期及危险评估
推荐意见:
(17)应根据国际抗癌联盟TNM 第8 版分期系统对肿瘤进行分期(Ⅲ,A)。
(18)肿瘤可切除性的评估可依据NCCN 解剖学标准以及国际胰腺病协会关于生物学和条件性标准的共识(Ⅲ,B)。
(19)对PC 患者的推荐治疗策略需要经过有经验的多学科团队讨论(Ⅲ,A)。
4 局部和局部区域PC的治疗(图2)
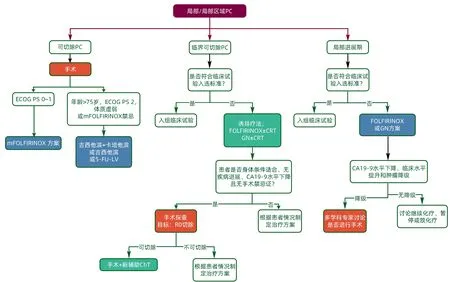
图2 局部和局部区域PC的治疗流程Figure 2 Treatment algorithm for local and locoregional PC
4.1 可切除PC
推荐意见:
(20)建议对胰颈和胆总管横断切缘进行冰冻切片分析(Ⅳ,B)。
(21)应针对外科医生确定的所有切缘定义肿瘤清除(Ⅲ,B)。
(22)对胰体尾肿瘤,建议进行根治性顺行性模块化胰脾切除术联合SMA 左半周至腹腔干左侧切除(Ⅳ,A)。
(23)应根据国际抗癌联盟TNM 第8 版分期系统对肿瘤的播散进行分期(Ⅲ,A)。
(24)建议进行标准淋巴结清扫术,切除的淋巴结数量应大于或等于16 个,以充分评估淋巴结分期(Ⅳ,A)。
(25)病理分析中应报告检查的淋巴结总数和淋巴结比(受累淋巴结数量占所检查淋巴结数量的比例)(Ⅳ,A)。
(26)接受手术的患者应使用普通肝素或低分子肝素进行围手术期血栓预防,有禁忌证的患者除外(Ⅰ,A)。
(27)若胆红素水平大于250 µmol/L,且患者合并胆管炎、或计划接受新辅助治疗、或手术时间预计超过2周,建议内镜下引流(Ⅰ,B)。
(28)由于现有Ⅲ期临床试验证据有限,除新入组临床试验外,不建议对可切除PC 患者进行新辅助治疗(Ⅱ,E)。
(29)胰腺切除术后,强烈建议完成6 个月的辅助化疗(Ⅰ,A)。
(30)建议对行PC 切除且ECOG PS 0~1 分的患者进行mFOLFIRINOX辅助治疗(Ⅰ,A)。
(31)对于不适合接受mFOLFIRINOX 治疗的患者(年龄>75 岁、ECOG PS 2 分或有 mFOLFIRINOX 禁忌证),吉西他滨联合卡培他滨可作为替代选择之一(Ⅰ,A)。
(32)吉西他滨或5-FU-LV 辅助治疗仅限于体能状态较差的患者(Ⅰ,B)。
(33)除入组临床试验外,不建议对患者进行术后辅助放化疗(Ⅰ,E)。
4.2 交界可切除PC
推荐意见:
(34)交界可切除PC 直接手术的R1 切除率很高,故应考虑先行全身诱导治疗(Ⅲ,A)。
(35)应尽可能将交界可切除PC 患者纳入临床试验(Ⅲ,A)。
(36)若无法纳入临床试验,则建议首选诱导治疗而非首选手术(Ⅱ,A)。
(37)建议先行诱导化疗(FOLFIRINOX 或GN 方案),然后根据具体情况进行CRT,之后行手术(GN 方案用于该适应证尚未获欧洲药品管理局和美国食品药物管理局批准)(Ⅲ,B)。
(38)若FOLFIRINOX 或GN 方案不可行,可考虑使用吉西他滨联合奥沙利铂或卡培他滨(Ⅱ,C)。
(39)诱导化疗后可考虑行基于卡培他滨的CRT(Ⅲ,C)。
(40)诱导治疗后无疾病进展、血清CA19-9 水平下降且状态良好的患者,除有禁忌证外,应接受手术探查(Ⅲ,A)。
4.3 局部进展期PC的治疗
推荐意见:
(41)所有局部进展期PC患者需每2~3个月由当地的多学科团队进行可切除性评估(Ⅲ,A)。
(42)应尽可能将局部进展期PC 患者纳入临床试验(Ⅲ,A)。
(43)可选择化疗(FOLFIRINOX 或GN)转化治疗(最多6个月)后行手术治疗;GN方案尚未获欧洲药品管理局和美国食品药物管理局批准(Ⅰ,B)。
(44)若CA19-9 水平显著下降、出现临床缓解或肿瘤降期,可以讨论肿瘤切除的可能性(Ⅳ,B)。
(45)不建议在诱导治疗后行动脉切除术,但在经验丰富的医疗中心可以根据患者具体情况行动脉切除术(Ⅳ,D)。
5 进展期和转移性PC的治疗(图3)

图3 晚期和转移性PC的系统治疗Figure 3 Systemic treatment of advanced and metastatic PC
5.1 一线治疗
推荐意见:
(46)转移性PC的治疗取决于体力状况评分:
①对于ECOG PS 0~1 分且胆红素水平<1.5 倍正常值上限的患者,应考虑FOLFIRINOX 或GN 方案(Ⅰ,A);
②对于ECOG PS 2 分、Karnofsky PS(KPS)≥70 且胆红素水平≤1.5 倍正常值上限的患者,可考虑GN 方案(Ⅱ,B);
③对于ECOG PS 2分、KPS<70和/或胆红素水平>1.5 倍正常值上限的患者,应考虑吉西他滨单药治疗(Ⅰ,A);
④对于ECOG PS 3~4 分的患者,应考虑对症处理,此时行化疗的风险超过获益(Ⅳ,A)。
(47)通常应每8~12 周,基于临床状态、CA19-9水平和影像学检查,评估一次治疗效果(Ⅲ,A)。
(48)携带BRCA 突变的患者应行铂类为基础的化疗(Ⅲ,A)。
5.2 二线治疗
推荐意见:
(49)ECOG PS 0~1 分且体能状态良好的患者在行FOLFIRINOX 方案治疗后可接受GN 方案(尚未获欧洲药品管理局和美国食品药物管理局批准为二线治疗)或吉西他滨单药化疗(Ⅲ,C)。
(50)ECOG PS 0~1 分或已恢复至ECOG PS 0~1分且接受以吉西他滨为基础的既往治疗患者,可以考虑纳米脂质体伊立替康与5-FU、LV三药联用(Ⅰ,B)。
(51)基于奥沙利铂的二线治疗仍有争议,可考虑将其作为ECOG PS 0~2 分患者首次治疗的替代方案(Ⅱ,C)。
(52)对于ECOG PS 3~4 分的患者,建议以症状为导向进行治疗,任何类型的化疗风险都可能大于获益(Ⅳ,A)。
5.3 三线治疗
推荐意见:
(53)如果患者营养状况不佳和/或PS 评分不良,则不适合接受三线治疗。在这种情况下,没有推荐的标准治疗方案,最佳支持治疗更为适合。
(54)PS 评分良好的患者,如有条件,应首选加入临床试验。
5.4 转移性PC的精准治疗(图4)

图4 转移性PC的精准医疗Figure 4 Precision medicine in metastatic PC
推荐意见:
(55)所有转移性PC患者都应行BRCA基因检测,从而确定是否适宜接受铂类化疗,随后使用奥拉帕利维持治疗(Ⅰ,B)。对于携带BRCA1/2 胚系突变且疾病稳定或对铂类化疗反应较好的患者,可选择奥拉帕利维持治疗(Ⅰ,B)。
(56)对于微卫星高度不稳定或错配修复缺陷的PC患者,推荐帕博利珠单抗作为二线及以上治疗(Ⅱ,B)。
(57)对于NTRK 基因融合的患者,推荐使用拉罗替尼或恩曲替尼(Ⅲ,A)。
6 随访、支持性治疗、长期影响与生存
6.1 随访
推荐意见:
(58)建议对接受PC 切除术的患者进行定期随访,虽然尚无充足的证据表明随访对于总生存期有影响(Ⅳ,B)。
6.2 支持性和姑息性治疗
推荐意见:
(59)接受化疗的晚期PC 患者应考虑行血栓一级预防(Ⅰ,B)。
(60)若患者发生胆管梗阻,建议内镜下放置全覆膜金属支架(Ⅱ,B)。
(61)十二指肠梗阻首选内镜下放置金属支架,而非手术(Ⅳ,B)。
(62)强烈建议有效控制患者的疼痛,必要时应请疼痛科专家会诊(Ⅲ,A)。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:陈哲然负责文章翻译;辛磊与王洛伟负责文章审校。

