治疗性低温对大鼠心肌细胞收缩功能的保护作用
周晓辉,蔡玥,郭珊珊,吴清华,王淑梅,王娜,张博
(1.沧州市人民医院,河北 沧州 061001;2.河北省人民医院,河北 石家庄 050051;3.沧州市中心医院,河北 沧州 061001)
随着体外循环技术的进步、高质量心肺复苏技术的普及和血流动力学支持的日益完善[1-2],越来越多的心脏骤停患者和需心脏手术的患者得到了及时的救治,心脏骤停患者的死亡率从90%下降到50%左右,成人心脏手术术后长期存活率也得到了提高[3]。从20世纪50年代开始,亚低温治疗被应用于心脏骤停和心脏手术中[4],但有研究[1]认为低温会引发心血管系统的不良效应,包括心血管收缩导致的心肌灌注不足,增加缺血心肌能量消耗,导致心肌代谢、功能障碍甚至结构破坏等。
心肌细胞收缩力是心肌细胞最有代表性的功能之一,主要反应了心肌细胞发生缩短的内在动力[5],因其能够对内外源刺激做出反应,可作为预测健康和疾病心肌的重要指标。体外急性分离的大鼠心肌细胞的收缩与整体心脏功能具有良好的相关性,过去的对于心肌力学的研究往往需要将酶解分离的心肌细胞附着到力学传感器上,侧重于测量肌节长度,这些技术具有劳动密集型和成本高的缺点。但目前应用钙成像、电生理、细胞力学、免疫组化等方式在工具药物的作用下对心肌细胞进行观察研究及定量分析,尤其是使用可视化动缘探测系统直接测量离体心室肌细胞力学特性,能够帮助我们对心脏功能、相关疾病发病机理及相关药物的作用机制进行更深入的研究[6-8]。但是这类实验对细胞质量要求极高,不仅需要细胞持续兴奋,而且要求细胞的收缩舒张功能极为稳定,为了提高心肌细胞质量,大量研究[9]对灌流液成分及酸碱度、消化酶等分离细胞的条件进行了改进,但往往忽略温度对于心肌细胞状态的影响。且本课题组以往的实验也发现细胞的收缩力随着季节交替和温度变化而变化,对于之后的药物干预研究影响很大,无法判断最终的作用是来自药物还是温度变化的影响。基于此,本研究以急性分离大鼠心肌细胞收缩舒张功能为指标,观察测定逐步升温和固定恒温孵育两种方式对大鼠心肌细胞收缩舒张功能的影响,探讨温度对心脏的影响,为治疗性低温的心脏保护作用提供细胞水平的依据。
1 材料与方法
1.1 主要试剂
哇巴因(美国Sigma公司),用二甲基亚砜溶液配制成100 mmol/L的母液,贮存于-20 ℃的冰箱中。Src抑制剂PP2(英国Tocris公司)、ROS抑制剂NAC(美国Sigma公司)、MAPK抑制剂PD98059(美国Cyman公司)、PLC抑制剂U73122(美国Cyman公司)和IP3抑制剂Xestospongin C(美国Cyman公司)的配制与保存参见药品说明书。Collagenase B购于瑞士Roche公司;BSA购于澳大利亚Maverick公司;EGTA购于比利时Acros Organics公司。
1.2 液体配置
无钙台氏液:NaCl 140.0 mmol/L,KCl 5.4 mmol/L,MgCl21.0 mmol/L,HEPES 1.0 mmol/L,glucose 10.0 mmol/L(用NaOH调pH值至7.4);台氏液:NaCl 140.0 mmol/L,KCl 5.4 mmol/L,MgCl21.0 mmol/L,HEPES 1.0 mmol/L,glucose 10.0 mmol/L,CaCl21.0 mmol/L(用NaOH调pH值至7.4);KB液:KOH 80.0 mmol/L,KCl 40.0 mmol/L,KH2PO425.0 mmol/L,MgSO43.0 mmol/L,L-Glutamic 50.0 mmol/L,Taurine 20.0 mmol/L,HEPEs 10.0 mmol/L,EGTA 1.0 mmol/L,D-Glucose 10.0 mmol/L(用KOH调节至pH 7.2)。消化液:含0.6% Collagenase B、0.6% BSA(Bovine serum albumin)及30 μmol/L Ca2+的无钙台氏液30 mL。复钙液:复钙液a:取无钙台式液加入CaCl2至0.1 mmol/L。复钙液b:取无钙台式液加入CaCl2至0.5 mmol/L。
1.3 实验动物
选用清洁级成年雄性SD大鼠,180~200 g[河北医科大学实验动物中心,许可证号:SYXK(冀)2018-004,动物合格证编号:2001137]。
1.4 单个大鼠心室肌细胞分离
参照文献[9]采用改进的Langendorff灌流装置和方法分离大鼠的心室肌细胞,初始细胞成活率大于80%。室温静置1 h。实验前,用复钙液a、复钙液b和正常台式液对细胞进行三步不同梯度复钙,最终得到状态较好的游离杆状心肌细胞用于实验研究。
1.5 大鼠心肌细胞收缩功能的测定
采用可视化单细胞动缘探测系统,将复钙后的心肌细胞放入浴槽内,用含氧饱和台式液以2 mL/min的速度恒速灌流5 min。通过浴槽两侧电极给予电压15 V、波宽4 ms和频率1 Hz持续电刺激,用10×物镜寻找收缩良好、边缘清晰的细胞,再用40×物镜放大细胞,让细胞在计算机上成像,并实时跟踪细胞边缘,记录大鼠心室肌细胞的收缩/舒张功能。用温控装置调节灌流液的温度,逐步升温分别测定于25、27、29、30、31、33、35、37 ℃时稳定收缩5 min以上的细胞收缩舒张功能变化;之后将心肌细胞在25 ℃、30 ℃或35 ℃固定恒温孵育1 h,测定3个温度孵育后能够稳定收缩5 min以上的细胞收缩舒张功能变化。以标准化的收缩幅度%(Standardized bl%peak h)%或收缩幅度(bl%peak h)相对变化评价逐步升温和固定恒温孵育对大鼠心肌细胞收缩功能的影响。
1.6 统计学分析
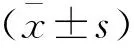
2 结果
2.1 逐步升温对大鼠心肌细胞收缩和舒张功能的影响
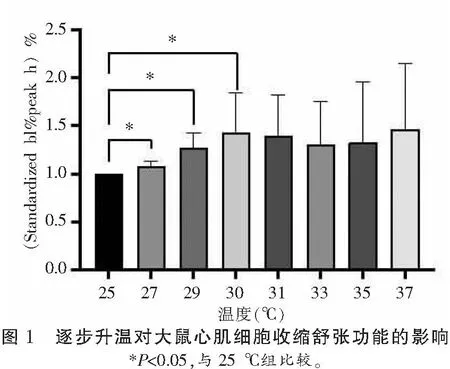
在27~37 ℃逐步升温的过程中,大鼠心肌细胞接受持续电刺激后稳定收缩的比例也会随着温度的升高而下降(P<0.05)。27、29、30 ℃组大鼠心肌细胞收缩幅度高于室温25 ℃组,差异有统计学意义(P<0.05)。31、33、35、37 ℃组大鼠心肌细胞收缩幅度与25 ℃组相比,差异无统计学意义(P>0.05),且30 ℃之后随着温度继续上升,心肌细胞收缩状态极不规律,部分细胞甚至会挛缩死亡。提示在25~37 ℃逐步升温过程中,30 ℃时大鼠心室肌细胞可达最佳收缩。见表1-表2、图1-图2。

表1 逐步升温不同温度下接受持续电刺激大鼠心肌细胞稳定收缩的细胞百分比
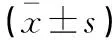
表2 逐步升温对大鼠心肌细胞收缩和舒张功能的影响
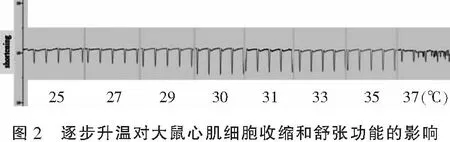
2.2 固定恒温孵育对大鼠心肌细胞收缩和舒张功能的影响
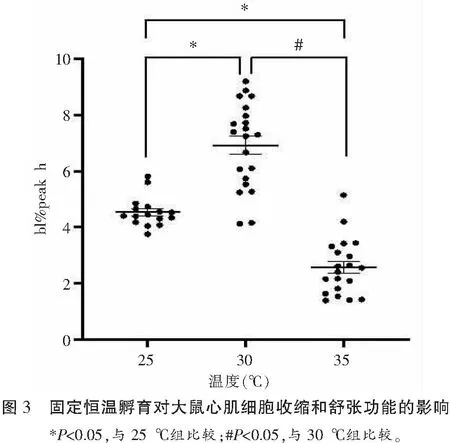
25 ℃组、30 ℃组、35 ℃组恒温孵育后的心肌细胞收缩幅度两两比较,差异均有统计学意义(P<0.05)。其中,30 ℃孵育的心肌细胞收缩幅度最大最稳定,是25 ℃时收缩幅度的152%,此温度孵育的心肌细胞收缩的增加比例较连续升温至30 ℃时的增幅更大(142%);35 ℃时心肌细胞收缩幅度最小且部分细胞收缩不规律,仅为25 ℃时收缩幅度的57%。见表3及图3。
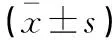
表3 固定恒温孵育对大鼠心肌细胞收缩和舒张功能的影响
3 讨论
以往的研究[10-14]显示温度显著影响心脏的收缩特性,但结果报道不一。有研究[10]证明在低温(25~30 ℃)时,离体乳头肌收缩的主动张力和收缩、舒张速度最高。Stephnson等[11]的实验证明,在22 ℃时离体乳头肌收缩张力及收缩速度最高,因为此温度下肌丝对钙的敏感性最高。Kanaya等[12]证实离体心肌的收缩幅度和持续时间会随温度的升高而减小。但也有文献[13]报道,在30~39 ℃的范围内,Wistar大鼠培养的心肌细胞的力学特性随温度升高逐渐升高。在一些临床试验[14]中,也显示不同温度对于心脏骤停患者的结局及不同指标的影响具有统计学差异。由于以上研究存在矛盾性,所以本研究采用急性分离的大鼠心肌细胞,观察不同温度对心肌细胞收缩功能的影响,从而寻找可用于心肌保护的最佳温度。
本研究采用IonOptix单细胞动缘检测系统测定25~37 ℃不同温度下急性分离的大鼠心肌细胞收缩舒张功能的变化,证实温度变化能够影响急性分离的大鼠心肌细胞收缩舒张功能。逐步升温发现从27~30 ℃,随着温度逐渐升高急性分离的大鼠心肌细胞收缩幅度与25 ℃室温相比逐渐增大(P<0.05);31~37 ℃时,随着温度继续上升,心肌细胞会出现不规律收缩、形态改变,甚至挛缩死亡,且收缩幅度与25 ℃相比差异无统计学意义(P>0.05),此现象与Wistar大鼠培养的心肌细胞的力学特性不同[13]。故的固定恒温实验选择25、30、35 ℃作为心肌细胞的孵育温度。固定恒温孵育发现,30 ℃大鼠心肌细胞收缩幅度最大最稳定(P<0.05),其次为25 ℃(P<0.05),35 ℃孵育的大鼠心肌细胞收缩幅度最小且不规律 (P<0.05)。
文献报道[15-16]钙离子介导心肌细胞兴奋收缩耦联是引起心肌细胞收缩舒张的关键,其中,心肌细胞内钙调控的改变和肌丝对钙敏感性发生改变是心肌细胞收缩舒张功能发生变化的主要因素。心肌细胞内的钙调控主要与L-型钙通道、肌浆网Ryanodine受体、钠钙交换体和钙泵有关。首先,温度变化可影响心肌细胞胞浆的升钙因素。文献报道,降低体温既可以通过增加L型钙通道的开放时间[17],使外钙内流增加,胞浆内钙浓度升高;又能增加肌浆网的钙储备并能增加Ryanodine受体的开放频率,使胞浆中的钙瞬时性增高,显著增加心肌细胞收缩力[18]。本研究也发现在30 ℃时测定的心肌细胞收缩力高于35 ℃时,可能与低温使得心肌细胞的L型钙通道开放时间延长和Ryanodine受体的开放频率增加导致的胞浆内钙浓度增加有关。其次,温度会影响心肌细胞胞浆的降钙因素。心肌细胞主要是通过钠钙交换体和钙泵进行排钙的,而降低体温可抑制钠钙交换体介导的钙外流和钙泵排钙[19],从而使细胞内钙增加,心肌细胞收缩力增强。本研究发现30 ℃时测定的心肌细胞收缩力明显高于35 ℃,其原因可能是由于低温抑制了细胞膜的钙泵和钠钙交换体功能,从而减少了细胞内钙的外排,造成胞浆钙浓度升高,导致心肌细胞收缩力升高。研究[19-20]也发现,低温(32 ℃)可以增加肌丝对钙的敏感性,从而使心肌细胞收缩力增强。至于温度升高降低心肌收缩力的原因,可能与氧耗增加造成的心肌损伤有关。温度升高可以加速心肌细胞耗氧,影响细胞代谢,造成酸性物质堆积,进而影响心肌细胞收缩和形态学改变。另外,在34~37 ℃时,同时出现的胞内ATP耗竭和胞内酸化能抑制钠钙交换,导致细胞内钙增多,从而造成细胞内钙超载[21],损伤细胞。这可能是实验中逐步升温时高温阶段造成细胞不规律收缩,甚至挛缩死亡的重要原因。25 ℃孵育心肌细胞的收缩力要小于30 ℃的原因,推测可能与深度低温可能在细胞和组织水平上破坏心肌的兴奋收缩耦联[22]、使心肌收缩蛋白对Ca2+的亲和力降低[23]、以及低温可能会引发心肌细胞Na+-K+-ATP酶和Ca2+ATP酶活性下降、ATP生成减少、细胞内Na+蓄积导致细胞水肿、细胞内外pH值失衡、无氧酵解增多导致心肌细胞酸中毒、心肌细胞Ca2+超载产生“冷挛缩”增加缺血心肌能量消耗[21]等因素有关。
治疗性低温分为:轻度低温33~35 ℃;中度低温28~32 ℃;深度低温17~27 ℃;超深度低温4~16 ℃[24-25]。其中,前两者又被合并称为亚低温[25]。既往研究[24-25]表明,治疗性低温可抑制缺血和缺血再灌注损伤引起的细胞死亡与凋亡,对减少心肌梗死面积、改善再灌注损伤、改善心肌重构和维持心脏功能等方面有重要作用。而Chien[26]等通过研究体温与心肌梗死面积的关系,指出血液温度每升高1 ℃,心肌梗死面积会增加10%,证实了心脏温度是心肌梗死面积的一个独立预测因素。Post等[27]和Nishimura等[28]在猪和狗的心脏的研究中发现,低温降低心率及机体耗氧量,而心输出量却并未改变,进一步证实了降低温度更够增强心肌收缩力。
综上,温度变化影响急性分离的大鼠心室肌细胞的收缩舒张功能,随着温度从25 ℃逐渐升高至37 ℃,急性分离大鼠的心室肌细胞收缩幅度出现先增强后减弱的情况。无论逐步升温,还是固定恒温孵育,都显示急性分离大鼠的心室肌细胞在30 ℃左右收缩幅度最大最稳定。

