快速眼动睡眠行为障碍和帕金森病患者血浆外泌体α-syn的变化
张新雨, 张婷婷, 许鹏飞, 王梦云, 王升辉, 周 瑶, 白莹莹, 张红菊
快动眼睡眠行为障碍(rapid eye movement sleep behaviour disorder,RBD)是一种异态睡眠,表现为快速眼动睡眠期出现与梦境相关的异常行为[1];分为特发性RBD(idiopathic RBD, iRBD)和继发性RBD。约有30%~50%的PD患者伴有RBD[2],因此又称 iRBD是帕金森病(Parkinson disease, PD)的临床前期。iRBD 转化为PD 间隔约5~10年[3], 预测iRBD 转化的早期诊断可为PD的干预提供广阔的窗口。
PD 的病理改变是黑质细胞出现α-突触核蛋白(α-synuclein,α-syn)的沉积和路易小体的形成,当黑质细胞损害达到50%~60%时才出现运动损害症状,因此iRBD 期间可能存在α-syn 的沉积。尸检研究证明iRBD 和PD 患者的胃肠道、涎腺和皮肤活检样本均存在α-syn[4-6],部分iRBD 患者嗅黏膜[7]及肠黏膜[8]活检也发现了α-syn。
外泌体(exosome,EXO)是一种特殊的细胞外囊泡,通过胞体内陷与质膜融合释放。通过转运蛋白质、脂质、DNA、mRNA 和miRNA 等物质调节受体细胞的功能,参与细胞间交流、抗原提呈、病原体传播、免疫应答、程序性细胞死亡、血管生成、炎症反应和凝血等过程;可穿透血脑屏障传递中枢与外周信息。可在血清/血浆、脑脊液、尿液中均检到,对疾病早期诊断更加敏感和特异。越来越多的研究发现PD 血浆神经元外泌体中α-syn 较正常健康人升高[9],而iRBD血浆外泌体α-syn研究报道结果不一。
本研究拟通过定量比较iRBD、早期不伴RBD的PD 患者(PD-nRBD)血浆外泌体α-syn 水平,寻找iRBD 转化的早期生物学标志物;通过对比分析血浆外泌体α-syn水平与iRBD夜间运动症状及PD-nRBD运动损害的评分相关性,探讨iRBD 的REM 睡眠异常行为的病理机制。
1 对象与方法
1.1 对象 从河南省人民医院神经内科招募符合欧洲运动障碍协会(MDS)PD 标准但不伴RBD的受试者21例为PD-nRBD 组,符合睡眠障碍国际分类第3 版iRBD 诊断标准的受试者20 例外为iRBD组,选取年龄、性别匹配的门诊健康体检者20 例为健康对照组(healthy control,HC)。
排除标准:(1)排除脑血管病、脑炎、癫痫、外伤等引起脑部结构功能改变的疾病;(2)排除家族性帕金森综合征、帕金森叠加综合征、药物导致的帕金森综合征、特发性震颤患者;(3)剔除重度心肺肝肾疾病及恶性肿瘤可能;(4)排除合并其他睡眠障碍患者;(5)排除药物、酒精依赖的人群;(6)排除焦虑、抑郁等精神疾病患者;(7)排除文盲、失聪等不配合者。iRBD 组需排除继发性RBD 患者;PD-nRBD组需排除伴RBD 的PD 患者,即快眼动睡眠障碍量表-香港版(RBDQ-HK)评分>18排除。
1.2 临床量表评估 对所有受试者进行行为学评估,利用统一帕金森病评定量表第3 部分(The unified Parkinson disease rating scale,UPDRS Ⅲ)和Hoehn-Yahr(H-Y)分期量表评估运动损害症状,使用RBDQ-HK评估夜间梦境及异常行为。
1.3 血浆样本采集及外泌体提取 在取得受试者知情同意的情况下从每位受试者采集约10 ml血液,然后在4 °C 下静置6 h,并以3 000 g 离心15 min收集血浆,并储存于-80 °C冰箱待使用。
利用ExoQuickTM外泌体提取试剂盒(SBI,Cat EXOQ5A-1,Palo Alto,CA,USA)提取外泌体,通过透射电子显微镜证实分离的外泌体的形态;同时进行Western blotting 评估外泌体标志物(CD63、TSG101)的表达。
1.4α-syn 定量分析 为了量化和比较血浆外泌体α-syn 含量,我们使用ELISA 试剂盒(Elabscience Biotechnology,E-EL-H0983c,Wuhan,China)进行测量。
1.5 统计分析 采用SPSS 26.0软件进行统计分析。正态分布的计量资料采用(±s)表示,方差齐性的多组比较采用单因素方差分析,两独立样本比较采用t检验;非正态分布的计量资料以中位数和(四分位数)[M(P25,P75)]表示,组内比较采用秩和检验,组间比较采用U检验;计数资料以相对数构成比(%)或率(%)表示,采用Fisher 确切概率分析;符合正态分布的数据采用Pearson 相关分析,不符合正态分布的数据采用Spearman 相关分析。P<0.05 被认为具有统计学意义。
2 结 果
2.1 人口信息学资料及临床量表评估结果
研究期间共纳入61 例受试者,其中iRBD 组20 例,平均年龄(63.05±6.94)岁,男性12 例;PD-nRBD 组21例,平均年龄(62.24±6.09)岁,男性12例;HC组20例,平均年龄(61.7±6.88)岁,其中男性12例(见表1)。
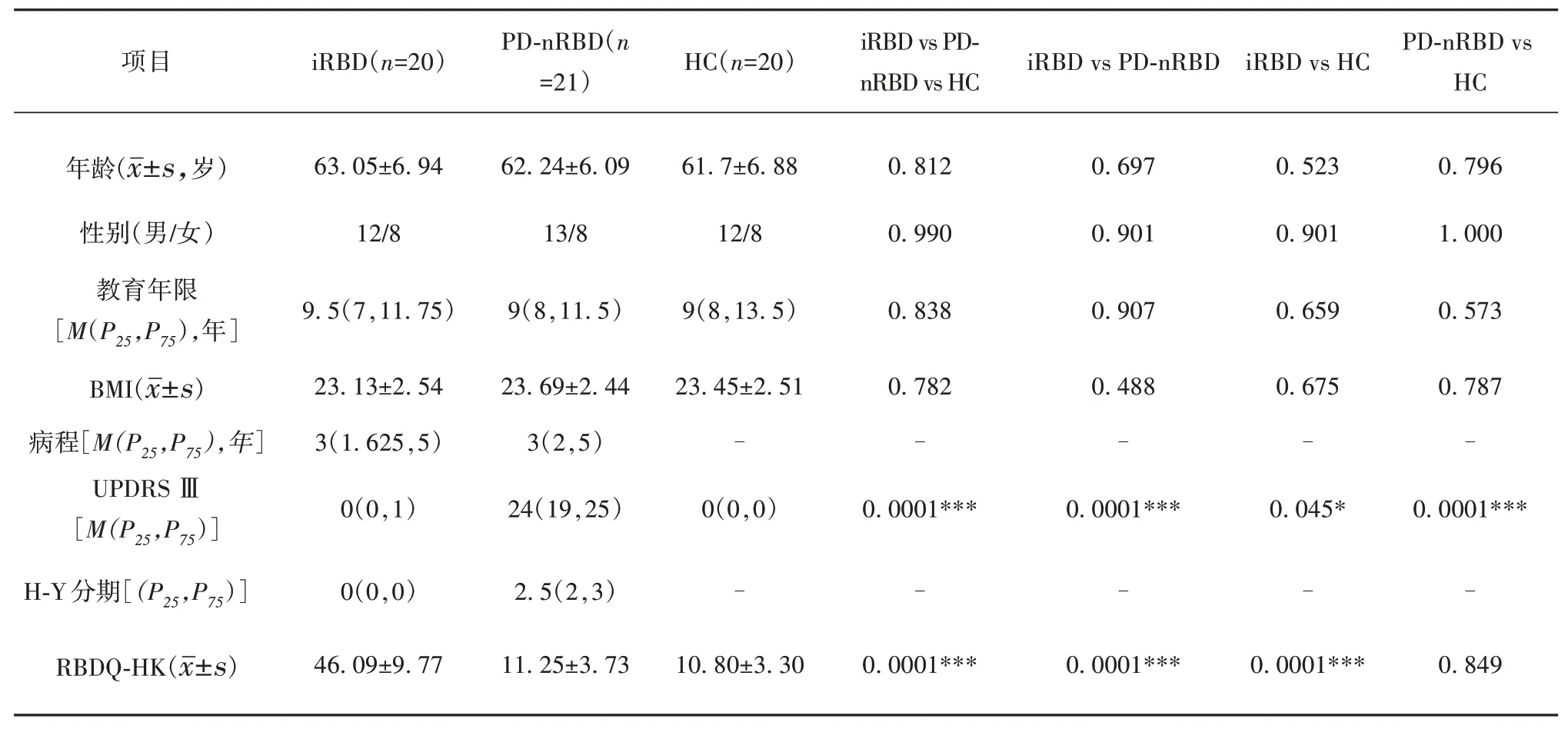
表1 iRBD、PD-nRBD、HC组人口信息资料及临床量表评分比较
iRBD、PD-nRBD、HC 组在年龄、性别、受教育程度、BMI 上不具有统计学意义(P>0.05),iRBD 组和PD-nRBD 组病程不具有统计学差异(P>0.05)(见表1)。
iRBD、PD-nRBD、HC组RBDQ-HK评分具有统计学差异(P=0.000 1),其中iRBD 组评分分别高于PDnRBD、HC 组(P=0.000 1,0.000 1),PD-nRBD 与HC组不具有统计学差异(P>0.05)。3组UPDRS III评分具有统计学差异(P=0.000 1),其中iRBD、PD-nRBD组评分分别高于HC组(P=0.045,0.000 1),PD-nRBD组评分明显高于iRBD组(P=0.000 1)(见表1)。
2.2 血浆外泌体的鉴定
2.2.1 透射电镜检测血浆中提取的外泌体形态学 取出冻存于-80 ℃冰箱中的外泌体重悬液,置于透射电镜下检测,观察iRBD组(见图1A)、PD-nRBD组(见图1B)、HC组(见图1C)均可见多个大小均一的囊泡状结构,直径为30~150 nm,与其他文献报道结果一致[10],经上述鉴定证实提取的囊泡结构为外泌体颗粒。

图1 血浆外泌体的鉴定
2.2.2 血浆外泌体内源性特异性蛋白检测
根据蛋白组学,外泌体可表达特定的蛋白分子,称之为内源性特异性蛋白,如CD9、CD63、TSG101等[11]。利用Western blotting 检测CD63、TSG101 表达情况,结果显示3 组提取物均有大量CD63、TSG101 表达(见图1D),说明提取物中含有大量外泌体颗粒。
2.3 血浆及血浆外泌体α-syn 的比较 使用ELISA 法检测血浆外泌体中α-syn 的含量,结果显示3 组血浆外泌体α-syn 存在差异(P=0.001),iRBD 组和PD-nRBD 组血浆外泌体α-syn分别高于HC 组(P=0.010,P=0.007),PD-nRBD 组与iRBD 组间无明显差异(P>0.05)(见图2)。

图2 ELISA法检测血浆及血浆外泌体中α-syn含量
2.4 iRBD、PD-nRBD 组血浆外泌体α-syn 与临床量表评分的相关性分析 见表2,结果显示:iRBD组血浆外泌体α-syn 与RBDQ-HK 呈正相关(r=0.842,P=0.000 1)(见图3A);PD-nRBD 组血浆外泌体α-syn 水平分别与UPDRS Ⅲ评分和H-Y 分期正相关(r=0.817,P=0.000 1;r=0.592,P=0.005)(见图3B,3C)。

图3 血浆外泌体α-syn与PD-nRBD、iRBD临床资料的相关性分析
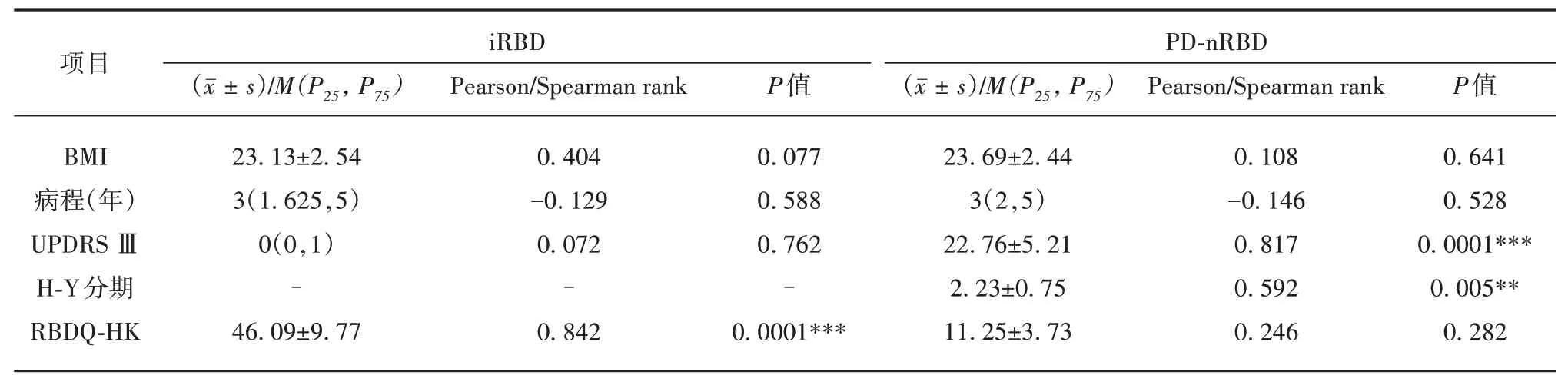
表2 血浆外泌体α-syn与PD-nRBD、iRBD临床资料的相关性分析
3 讨 论
iRBD是指患者在快速眼动睡眠期出现与梦境相关的异常行为[1];多导睡眠监测显示患者在REM睡眠期出现失张力障碍[12]。纵向研究发现90%以上的iRBD历经10年后发展成了α-突触核蛋白病[13],PD是α-突触核蛋白病中发病率最高的神经变性病之一,RBD 是PD 的非运动症状[14],又被称为PD 的临床前期,寻找iRBD转化的早期生物学指标可为PD的干预提供广阔的窗口。外泌体是中枢与外周对话的重要信使,可携带大量的中枢信息穿过血脑屏障;研究证明部分血浆外泌体α-syn来源于中枢神经系统[9],并发现PD血浆神经元外泌体增加[10,15],α-syn通过外泌体传递是PD发病机制的重要环节[16]。因此推测未来转化的iRBD血浆外泌体也存在α-syn聚集。
我们的行为学结果显示:iRBD 患者夜间梦境及异常,明显高于PD-nRBD 患者和正常人群,3 组UPDRS Ⅲ评分具有统计学差异,且存在组间差异,其中PD-nRBD 评分最高,HC 评分最低。说明iRBD组夜间运动症状最显著,而日间运动损害较PDnRBD低。
iRBD、PD-nRBD 组血浆外泌体α-syn 分别较HC组升高。既往研究发现PD 血浆外泌体α-syn 较HC升高[17-21],与我们的研究结果一致。另一项研究报告PD 血浆神经元外泌体α-syn 降低,并认为外泌体在中枢神经系统中发挥保护/危害双重作用,黑质纹状体的星形胶质细胞分泌的外泌体对PD 具有神经保护作用[22,23],外泌体也具有触发、加速靶细胞α-syn寡聚[24,25],而加剧细胞的损害。
有关iRBD 外泌体α-syn的报道较少,结果不一。Zhao等人[26]的研究报告与我们的结果一致,即iRBD血浆外泌体中α-syn较HC组升高;也有不同的报告:iRBD 与HC 的血浆外泌体α-syn水平无差异[15],但血浆神经元外泌体α-syn 升高[10,15]。我们的结果未发现iRBD 与PD-nRBD 患者血浆外泌体α-syn 存在差异,但有研究发现PD 血浆外泌体α-syn 较iRBD 组升高[27]。这可能与受试者入选排除标准不同以及病程不同有关。我们的结果提示iRBD 患者血浆外泌体存在α-syn,说明了iRBD 存在α-syn 的病理损害;其含量较PD-nRBD 偏低,但无统计学差异,说明iRBD的α-syn 病理损害类似于PD-nRBD,也提供了iRBD是PD临床前期的病理证据。
我们的相关分析显示:PD-nRBD 血浆外泌体α-syn 与UPDRS Ⅲ评分和H-Y 分期正相关,进一步说明了血浆外泌体α-syn 的含量与疾病的运动损害程度显著相关[9,15,28,29];一项纵向研究表明晚期PD患者较早期PD 患者血浆外泌体α-syn 增高[15],说明了PD 越严重α-syn 越多。iRBD 特征性表现是夜间REM 睡眠期与梦境相关的异常行为,RBDQ-HK 可主观评估iRBD 患者夜间梦境及异常运动情况,我们的结果显示:iRBD 的血浆泌体α-syn 的含量与RBDQ-HK 正相关,说明α-syn 越多梦境相关的异常行为越严重。Yan 等人[27]发现iRBD 患者血浆神经元外泌体α-syn与病程相关,梦境相关的异常行为随病程的延长而更加明显,间接支持了我们的相关结果。进一步说明iRBD 梦境相关的异常行为的病理生理机制与α-syn沉积有关。
综上所述,血浆外泌体α-syn 有望成为iRBD 转化的早期生物标记物,也可作为PD、iRBD 疾病监测的评价指标,同时可作为评估疾病运动损害的重要标志。我们的研究仍存在一些局限性,首先我们的样本量较小;其次,RBD 是通过RBDQ-HK 进行的主观评估,可能会影响入组患者的精准性;未来我们将继续扩大样本量并进行纵向研究,同时利用多导睡眠监测对RBD 进行的精准筛选,进一步探索血浆外泌体α-syn水平在iRBD向PD转化过程中作用。
伦理学声明:本研究获得河南省人民医院医学伦理委员会(201715)批准。所有参与者或其监护人均签署知情同意书。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:张新雨负责撰写论文、研究过程的实施、统计学分析、绘制图表、文献收集、论文修改、拟定写作思路;张婷婷、许鹏飞、王升辉、周瑶、白莹莹负责数据收集、实验操作;张红菊负责指导撰写文章并最后定稿。

