香菇多糖通过IL-6/STAT3/Notch 信号通路调控胰腺癌细胞增殖、迁移及化疗敏感性
张 冬,邓同兴,王丰刚,林小博,程杰西,马永超
(漯河医学高等专科学校,河南漯河 462002)
胰腺癌(Pancreatic cancer,PC)是最具侵袭性的消化系统致命癌症,预后严重,死亡率高,5 年生存率小于5%[1]。虽然胰腺癌的发病机制和病因尚未完全阐明,但一些常见的胰腺癌危险因素已被报道,包括吸烟、肥胖、遗传、糖尿病、饮食,甚至胰腺炎和饮酒。胰腺癌的治疗包括手术、放射治疗、化疗和姑息治疗[2]。然而,复杂的胰腺癌手术或联合治疗并不能取得良好的疗效,迫切需要更有效的治疗方法[3]。而食品来源的活性物质具有毒副作用小等特点,因此,研究香菇多糖对胰腺癌细胞增殖、迁移及化疗敏感性的影响及其机制,可以为胰腺癌的辅助治疗提供实验依据。
胰腺癌的发生不仅受到丝氨酸/苏氨酸激酶11(STK11)、蛋白酶、丝氨酸1/蛋白酶、丝氨酸2 (PRSS1/PRSS2)、Pim-1 等基因突变的高度影响,也受到炎症细胞、趋化因子和细胞因子为主的微环境的影响[4]。研究显示,白细胞介素-6(IL-6)与自身免疫性疾病、癌变等有关,并已证明其影响PC 的发生、进展、预后和转移[5]。研究显示,Notch 信号通路在癌症的进展、自我更新中起着重要作用,能调节肝癌细胞的增殖[6],而且Notch 信号传导和IL-6 相互作用在肝细胞癌、乳腺癌中作用已经得到证实,能有效的调控癌症的进展[7-8]。而调节IL-6/STAT3 信号通路能有效调控药物对癌细胞的化学增敏作用[9],包括IL-6 通过STAT3/Notch 信号通路调节多发性骨髓瘤细胞系对硼替佐米的耐药及化学敏感性[10]。
香菇多糖(Lentinan)是从香菇中分离出来的β-(1,3)-葡聚糖多糖,具有低毒和抗肿瘤、抗炎和免疫增强等多种活性,能通过增强宿主的免疫应答(特别是T 淋巴细胞介导的应答间接发挥抗)肿瘤作用[11]。与单纯化疗相比,香菇多糖联合化疗可显著延长结直肠癌患者的生存率,改善免疫反应,减少不良反应,表明香菇多糖对抗肿瘤作用具有一定的辅助作用[12]。已有研究显示,香菇多糖治疗胰腺癌具有一定的效果[13],且胰腺癌组织中,IL-6/STAT3 信号通路和Notch 信号通路均处于激活状态[14-15],而香菇多糖能否通过IL-6/STAT3/Notch 信号通路发挥抗癌作用并不明确。本研究重点分析香菇多糖对胰腺癌细胞增殖、迁移及化疗敏感性的影响,并分析其机制,为香菇多糖的开发提供依据。
1 材料与方法
1.1 材料与仪器
BALB/c 裸鼠 30 只SPF 级5~6 周龄,雄性,体重(16~20 g),购自中国科学院上海动物实验中心,动物合格证号SCXK(沪)2017-0005。标准动物房饲养,温度(22±5)℃ , 湿度(57±8)%,光暗交替各 12 h,自由获得标准的饲料和水;人胰腺癌Capan-1 细胞株 碧云天生物技术有限公司;干香菇 购自漯河市许慎市场;MTT 试剂盒、IL-6 北京索莱宝科技有限公司;兔抗p- STAT3、STAT3、Notch1、Hes1、Ki-67、MMP-9、MRP1、P-gp、HRP 标记的羊抗兔IgG二抗 美国Sigma 公司。
DMIL LED 倒置荧光显微镜 德国徕卡公司;ELx800 全自动酶标仪 美国BioTek 公司;Gel Doc XR+凝胶成像系统 美国BIO-RAD 公司。
1.2 实验方法
1.2.1 香菇多糖的提取 准确称取500 g 香菇,粉碎后过40 目筛,料液比1:60(g:mL)加水混匀,70 ℃超声辅助提取2 h,提取2 次,过滤,减压至250 mL,D101 大孔树脂纯化,蒸馏水洗脱,浓缩至250 mL,加入终浓度为 80%乙醇,静置过夜,抽滤,溶解,二次醇沉,无水乙醇、丙酮冲洗,得香菇多糖。选择葡萄糖为标准品,苯酚-硫酸法检测多糖水平[16]。标准曲线方程为y=51.432x-0.0213(r=0.9998)。线性范围0.00287~0.01762 mg/mL,纯度为91.27%。溶于0.1%二甲基亚砜中,培养基稀释;动物实验进行时,采用PEG400 溶解,生理盐水稀释,4 ℃ 保存备用。
1.2.2 细胞培养 Capan-1 细胞培养于DMEM 培养基中,添加10%胎牛血清、100 单位/mL 青霉素和100 μg/mL 链霉素,37 ℃,5% CO2条件下标准加湿培养箱孵育。
1.2.3 MTT 法检测细胞抑制率 选择对数生长期的细胞(5×103个细胞/孔)转移到96 孔板中,5% CO2培养箱中37 ℃孵育,贴壁后,加入终浓度分别为0、7.5、15、30、60、120、240 µg/mL 的LNT 的培养基溶液,空白对照组只加等量的培养基,另设置阳性对照组(60 µg/mL 顺铂,预实验获得)、0.1%的二甲亚砜(DMSO)组(对照组)、空白对照组(完全培养液)和只加培养基无细胞的空白组,每组设置3 个复孔,孵育48 h。每孔加入20 μL MTT 溶液。充分混合后,37 ℃孵育4 h,除去上清,加入150 μL 二甲亚砜溶液,37 ℃孵育30 min。随后,通过酶标仪检测490 nm 处的光密度(OD)值。抑制率(%)=(OD对照组-OD给药组)×100/(OD对照组-OD空白组)。GraphPad Prism 8 统计软件计算香菇多糖对Capan-1 细胞的IC50。
1.2.4 细胞分组及增殖率检测 选取对数生长期胰腺癌细胞,随机分组:对照组,正常培养;IL-6 组:IL-6 终浓度为50 ng/mL 的培养基培养[9];IL-6+LNT 组:含50 ng/mL IL-6 和60 µg/mLLNT 的培养基培养。培养48 h 后,参照“1.2.3”采用MTT 法检测增殖率,增殖率(%)=(OD给药组-OD空白组)×100/(OD对照组-OD空白组)。
1.2.5 Western blot 检测相关蛋白水平 参照“1.2.4”分组,孵育48 h,RIPA 细胞裂解液裂解细胞,BCA法测定总蛋白水平。使用10% SDS-PAGE 分离蛋白,并转移到PVDF 膜上,5%脱脂奶粉封闭1 h。膜与一抗孵育过夜:p-STAT3(1:1000)、STAT3(1:1000)、Notch1(1:2000)、Hes1(1:2000),TBST 洗涤三次,加入辣根过氧化物酶标记的羊抗兔IgG (1:1000),37 ℃孵育1 h,TBST 洗涤三次,增强型化学发光试剂 (ECL)显现蛋白条带,Image J 软件分析结果。
1.2.6 细胞迁移能力检测 参照“1.2.4”分组,将Capan-1 细胞重悬于200 µL 无FBS 的培养基(1×105个细胞/孔)中,加入transwell 小室顶室。下腔添加10% FBS 的培养基。48 h 后,细胞固定染色,显微镜下随机选取6 个区域计数细胞数量。
1.2.7 细胞顺铂耐药模型的建立 对数生长期Capan-1 细胞置于处于含有0.1 μg/mL 顺铂(DDP)的培养基中培养2 周,调整DDP 浓度为0.2 μg/mL,继续培养2 周,将DDP 浓度分别调整至0.4、0.8 μg/mL,选择0.8 μg/mL DDP 存在下稳定生长的细胞被为抗DDP 的胰腺癌细胞Capan-1/DDP。
将Capan-1/DDP 细胞接种到96 孔板(5×103个细胞/孔),贴壁后分成3 组,包括对照组、IL-6、IL-6+LNT 组,每组加入DDP 终浓度分别为10、20、30、40 μg/mL 的培养基,孵育48 h,采用MTT 法检测490 nm 处的OD 值,计算增殖率,GraphPad Prism 8 软件计算顺铂半抑制浓度(IC50),Western blot 检测Ki-67、MMP-9、MRP1 和P-gp 表达水平。
1.2.8 裸鼠急性毒性试验 确定裸鼠最小剂量(Dm)和最大剂量(Dn),确定r值为0.7(r值代表相关系数)。设置LNT 剂量依次呈等比数列的5 个组别,每组10 只,各组裸鼠每天灌胃1 次,持续观察14 d。应用SPSS 21.0 软件中的Probit 模块计算LD50。所有动物实验均经校动物伦理委员会批准(批准号:2021-01011)。
1.2.9 动物模型建立及分组 0.2 mL 对数期Capan-1/DDP(1×107个/mL)细胞,接种于裸鼠侧腹,当肿瘤达到50~100 mm3时,分为模型组(生理盐水)、IL-6 组(5 μg/kg,预实验确定)、顺铂+IL-6 组[顺铂(4 mg/kg,预实验确定)+IL-6(5 μg/kg)]、IL-6+LNT组[LNT(80 mg /kg)+IL-6(5 μg/kg)],每组8 只,均为腹腔给药,1 次/3 d,每周用卡尺测量异种移植瘤的大小(计算体积=最短直径2×最长直径/2)。给药21 d后,裸鼠给予安乐死,记录肿瘤重量。Western blot检测肿瘤组织中p- STAT3、STAT3、Notch1 和Hes1的水平。
1.3 数据处理
2 结果与分析
2.1 香菇多糖对胰腺癌细胞给药浓度的筛选
研究表明,香菇多糖是香菇中活性成分之一,具有抗病毒、抗肿瘤、调节免疫功能和刺激干扰素形成的作用[17]。香菇多糖由于其广谱的治疗特性、相对较低的毒性和成本,成为潜在和理想的联合化疗的免疫调节有效活性成分[18]。与相同浓度的顺铂比较,60 µg/mL 的LNT 对胰腺癌Capan-1 细胞抑制率无统计学差异(P>0.05),说明相同浓度的LNT 与顺铂存在相同的药效。从图1中可以看出,与对照组比较,7.5、15、30、60、120、240 µg/mL LNT 组胰腺癌Capan-1 细胞抑制率极显著增加(P<0.01)。通过GraphPad Prism 8 统计软件计算香菇多糖对胰腺癌Capan-1 细胞的IC50值为73.34 µg/mL,后续香菇多糖依据预实验浓度选择60 µg/mL。
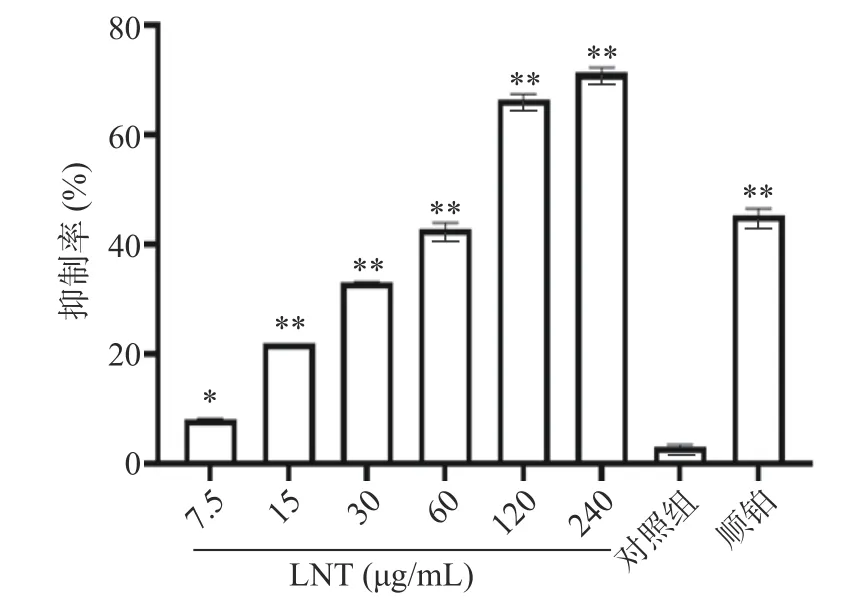
图1 香菇多糖对Capan-1 细胞活力的影响Fig.1 Inhibitory effect of lentinan on Capan-1
2.2 LNT 对胰腺癌Capan-1 细胞增殖的影响
在肿瘤细胞中STAT3 激活与IL-6 和Notch 信号通路相关。高水平的IL-6 诱导STAT3 磷酸化,从而激活Notch 信号通路,促进细胞增殖。通过阻断STAT3 磷酸化,低水平的STAT3 磷酸化能切断IL-6和Notch 信号通路之家的联系[19]。而Notch 信号通路对癌细胞的增殖具有一定的影响,对癌症的进展发挥重要的作用[20]。同样,在本研究中,与对照组比较,IL-6 组增殖率显著上调(P<0.05)(图2),提示高水平的IL-6 通过激活STAT3/Notch 信号调控胰腺癌Capan-1 细胞增殖,而LNT 可以通过抑制IL-6/STAT3/Notch信号通路抑制Capan-1 细胞增殖。
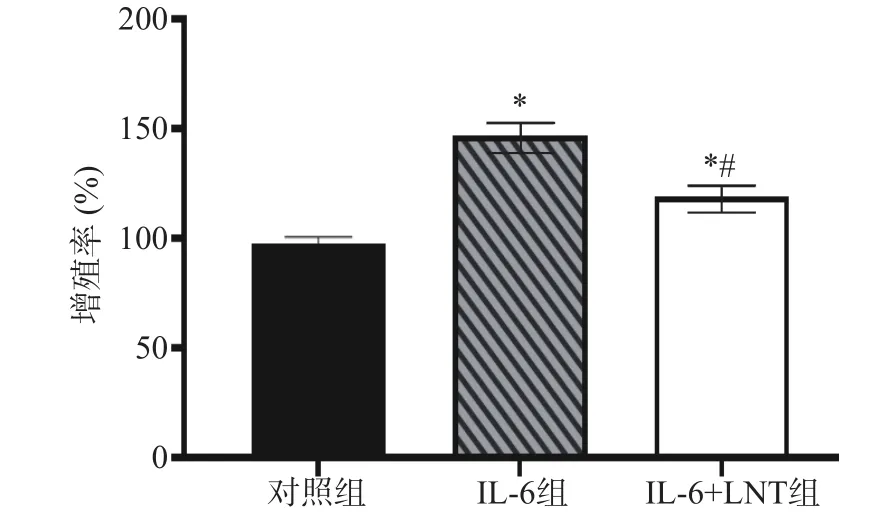
图2 LNT 对胰腺癌Capan-1 细胞增殖的影响Fig.2 LNT inhibited the proliferation of pancreatic cancer Capan-1 cells
2.3 香菇多糖对胰腺癌Capan-1 细胞中的 STAT3/Notch 信号通路的影响
已有研究表明,在部分癌细胞中,IL-6 通过STAT3 磷酸化激活Notch 信号通路,而Notch 信号通路可以促进肿瘤细胞的自我更新和增殖[21]。由图3 可知,与对照组比较,IL-6 组p-STAT3/STAT3表达水平极显著上调(P<0.01),表明IL-6 可以促进STAT3 磷酸化,而p-STAT3 可以以二聚体的形式调控Notch1 及其下游Hes1 表达水平,而60 µg/mL LNT 可以逆转IL-6 对STAT3/Notch 信号通路的影响。与IL-6 组比较,IL-6+LNT 组p-STAT3/STAT3、Notch1 和Hes1 表达水平显著降低(P<0.05),说明LNT 能够通过靶向STAT3/Notch 信号通路对Capan-1 细胞产生影响。
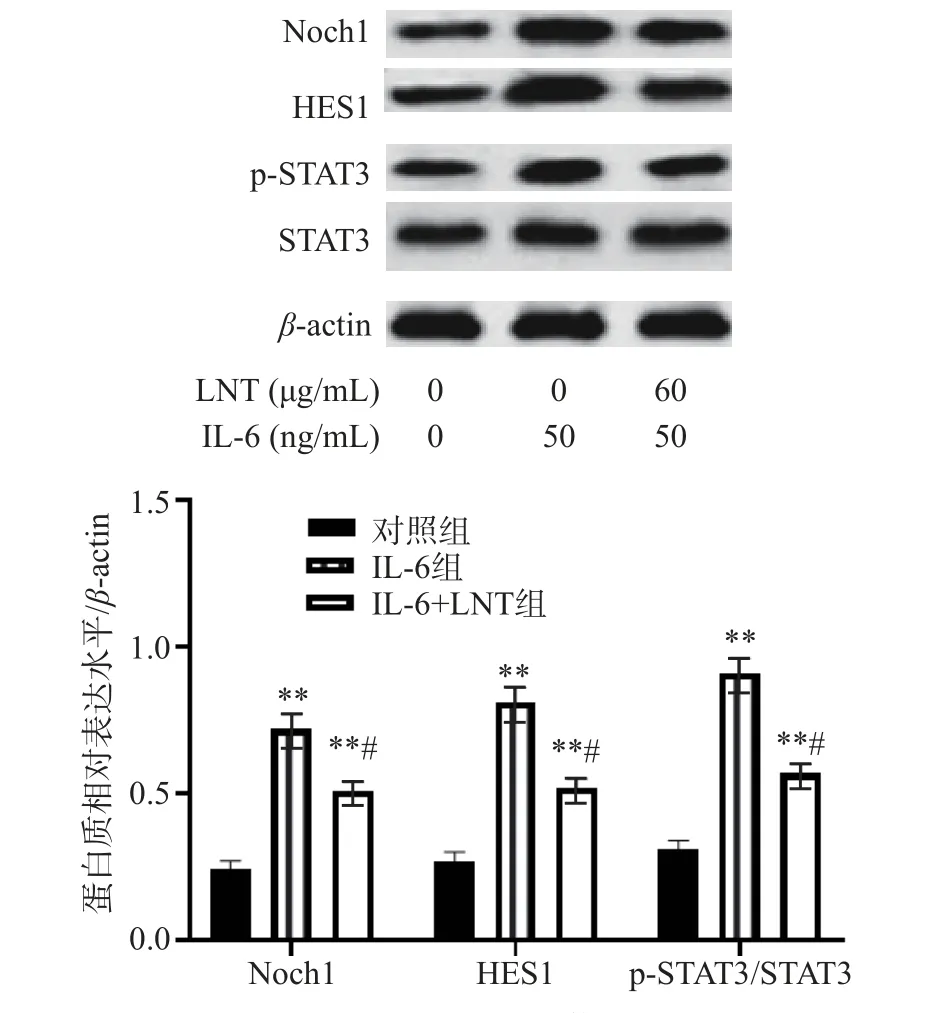
图3 LNT 对 STAT3/Notch 信号通路的影响Fig.3 Effect of LNT on STAT3/Notch signal pathway
2.4 LNT 对胰腺癌Capan-1 细胞迁移的影响
研究显示,肿瘤微环境中的促炎因子IL-6 具有激活IL-6/STAT3 信号通路,促进癌症发展的特征,包括癌细胞的迁移和侵袭[22-23]。本研究中,与对照组比较,细胞迁移率极显著增加(P<0.01)(图4),说明IL-6 能刺激胰腺癌细胞迁移。而采用LNT 处理后,与IL-6 组比较,IL-6+LNT 组Capan-1 胰腺癌细胞迁移数目显著减少(P<0.05),表明LNT 可以逆转IL-6通过STAT3 通路对Capan-1 胰腺癌细胞迁移的影响。
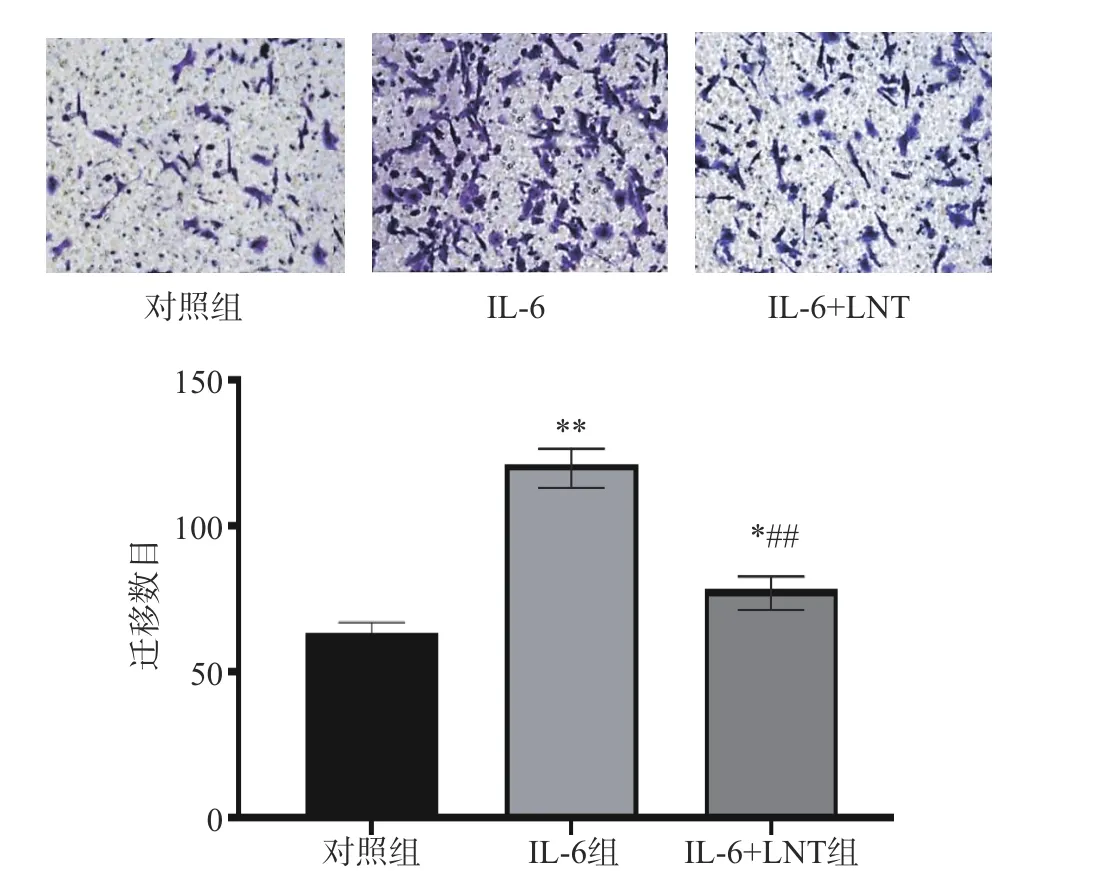
图4 LNT 对胰腺癌Capan-1 细胞迁移的影响Fig.4 LNTinhibits the migration of pancreatic cancer Capan-1 cells
2.5 LNT 对胰腺癌Capan-1 对顺铂耐药的影响
本研究中,伴随顺铂浓度的增加,对照组、IL-6 组以及IL-6+LNT 组Capan-1/DDP 细胞增殖率(极)显著下调(P<0.05,P<0.01)(图5),说明10~40 μg/mL的顺铂能有效抑制Capan-1/DDP 细胞增殖,并显示明显的浓度梯度依赖性。通过IC50值比较发现,与对照组比较,IL-6 组顺铂对Capan-1/DDP 细胞的IC50值极显著增加(P<0.01),说明IL-6 能促进Capan-1/DDP 细胞的耐药性,这与相关报道一致[24],因为IL-6 作为一种炎症相关的肿瘤细胞因子,能通过激活IL-6/STAT3 信号通路,激活下游一系列因子,导致癌细胞增殖、耐药、侵袭和转移等恶性行为的发生[25]。而采用LNT 处理后,与IL-6 组比较,IL-6+LNT 组顺铂对Capan-1/DDP 细胞的IC50值呈现极显著下调(P<0.01),胰腺癌细胞耐药明显逆转,说明LNT 可能对治疗胰腺癌以及降低耐药性具有一定的调控潜力。
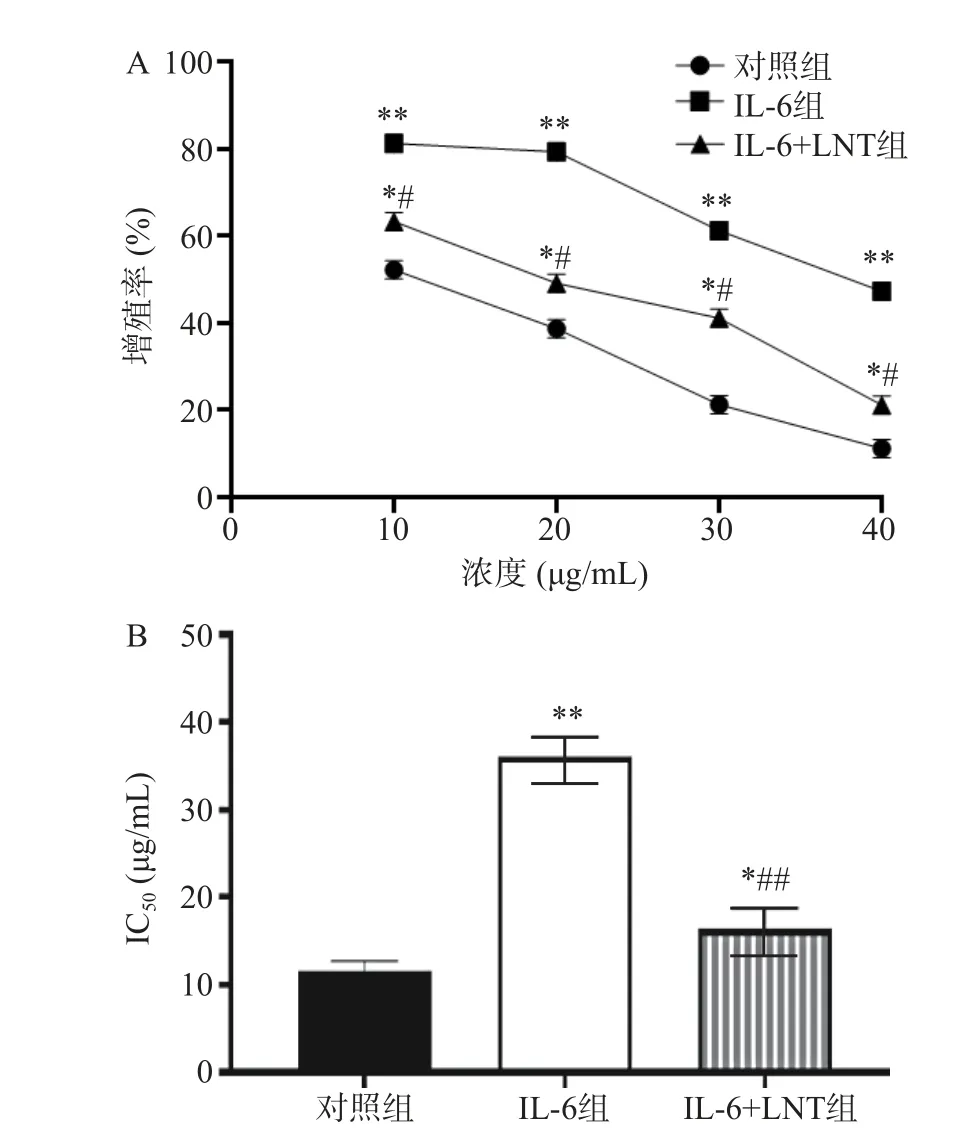
图5 LNT 抑制胰腺癌Capan-1 对顺铂耐药的影响Fig.5 Effect ofLNT inhibits cisplatin resistance in pancreatic cancer Capan-1
2.6 LNT 抑制胰腺癌Capan-1 中 Ki-67、MMP-9、Pgp 和 MRP1 的表达
Ki-67 在细胞周期的G1、S、G2 和M 阶段保持活性,为细胞增殖的标记物,而MMP-9 是基质金属蛋白酶最复杂的形式之一,具有降解细胞外基质(ECM)成分的能力,同样MRP1 的表达与癌细胞耐药有关,并激活多药耐药家族的有效成员p -糖蛋白(P-gp)的表达[26-28]。本研究中,与对照组比较,Ki-67、MMP-9、MRP1 和 P-gp 表达水平(极)显著上调(P<0.05,P<0.01)(图6),说明IL-6 能通过Ki-67、MMP-9 蛋白的表达促进胰腺癌细胞增值和迁移,并加强其耐药性。而采用LNT 处理后,与IL-6 组比较,IL-6+LNT 组Ki-67、MMP-9、MRP1 和 P-gp 表达水平显著降低(P<0.05),进一步验证了LNT 抑制Capan-1 增值、迁移和耐药的原因,同时也间接说明IL-6 可能通过STAT3/Notch 通路调节Capan-1 胰腺癌细胞增殖、迁移和耐药。
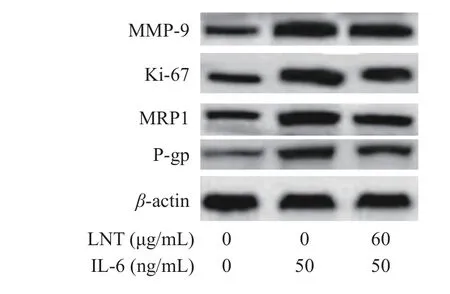

图6 IL-6 对 Ki-67、MMP-9、P-gp 和 MRP1 表达的影响Fig.6 Effect of IL-6 on the expression of Ki-67, MMP-9, P-gp and MRP1
2.7 LNT 对裸鼠急性毒性试验
本实验最大给药量为6000 mg/kg,灌胃后,出现发抖、怕冷,扎堆,半小时后恢复正常,无死亡发生,根据外源化学物相对毒性分级标准,一次经口LD50在5000 mg/kg 以上为无毒,因此实际香菇多糖无毒。按照预实验最终取剂量为80 mg/kg。
2.8 LNT 对胰腺癌移植瘤顺铂耐药的影响
由图7 可知,本研究中,与模型组比较,IL-6 组瘤体体积、瘤重(极)显著上调(P<0.05,P<0.01),说明IL-6 促进了肿瘤的增殖;而与IL-6 组比较,IL-6+LNT 组瘤体体积、瘤重极显著下调(P<0.01),说明LNT 可以发挥抑制IL-6 致瘤作用,下调瘤重水平。这与相关研究一致[29],LNT 是从香菇中分离出来的β-(1,3)-葡聚糖多糖,已知具有低毒性和抗肿瘤活性,并有可能通过增强宿主的免疫能力、降低炎症水平间接发挥抗肿瘤作用[30]。
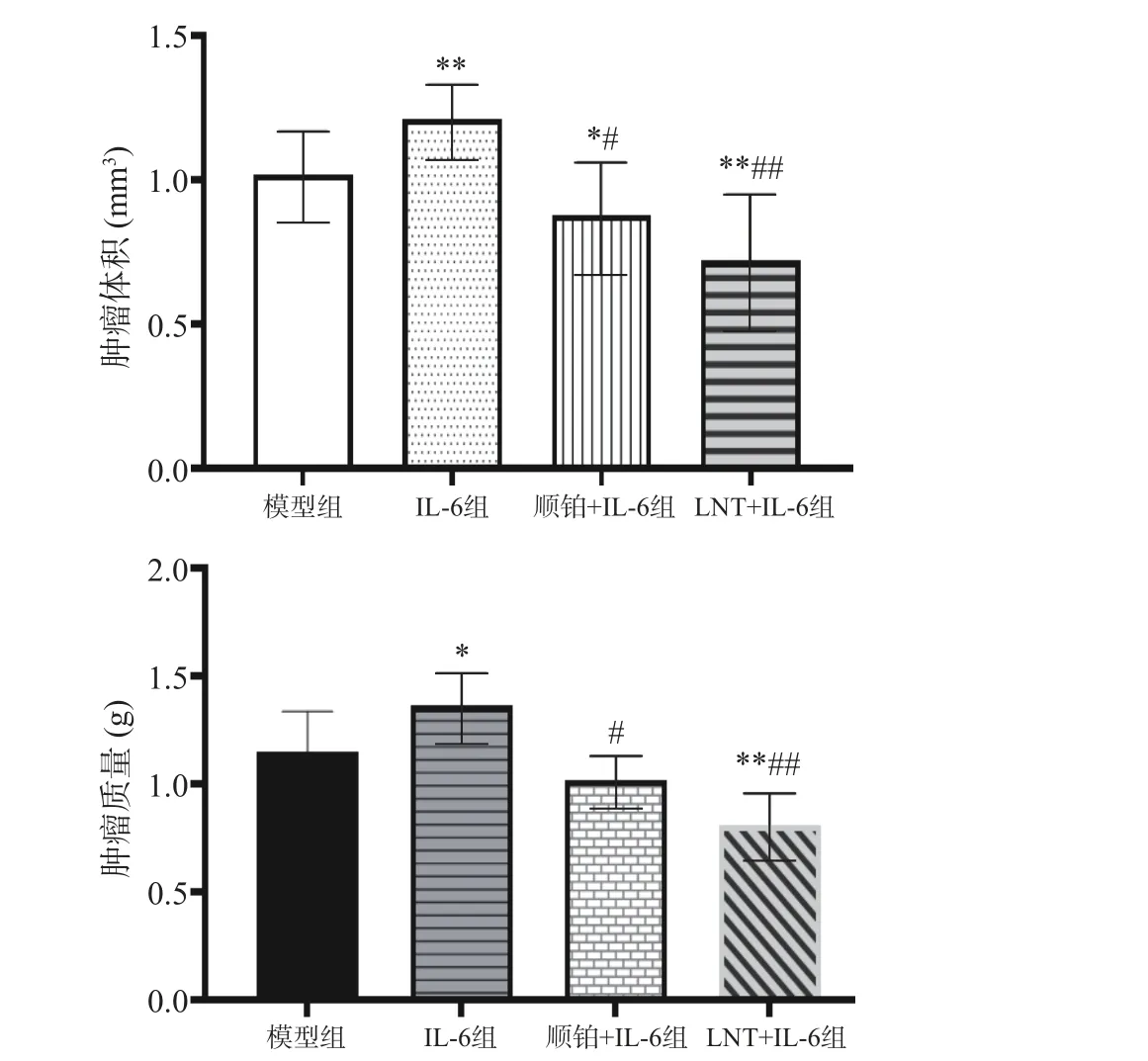
图7 LNT 对胰腺癌移植瘤顺铂耐药的影响Fig.7 Effect of L-6 on cisplatin resistance in pancreatic cancer xenografts
2.9 IL-6 对胰腺癌移植瘤 STAT3/Notch 信号通路的作用
在这项研究中,与对照组比较,IL-6 组Notch1、Hes1 表达水平极显著上调(P<0.01)(图8),证明了IL-6 靶向Notch 信号后,能导致肿瘤细胞中STAT3出现过度激活,并进一步对Notch1、Hes1 产生影响。而LNT 和顺铂处理后,与IL-6 组比较,IL-6+LNT 组p-STAT3/STAT3、Notch1、Hes1 表达水平(极)显著下调(P<0.05,P<0.01),说明LNT 和顺铂能下调IL-6 对致瘤性的影响。
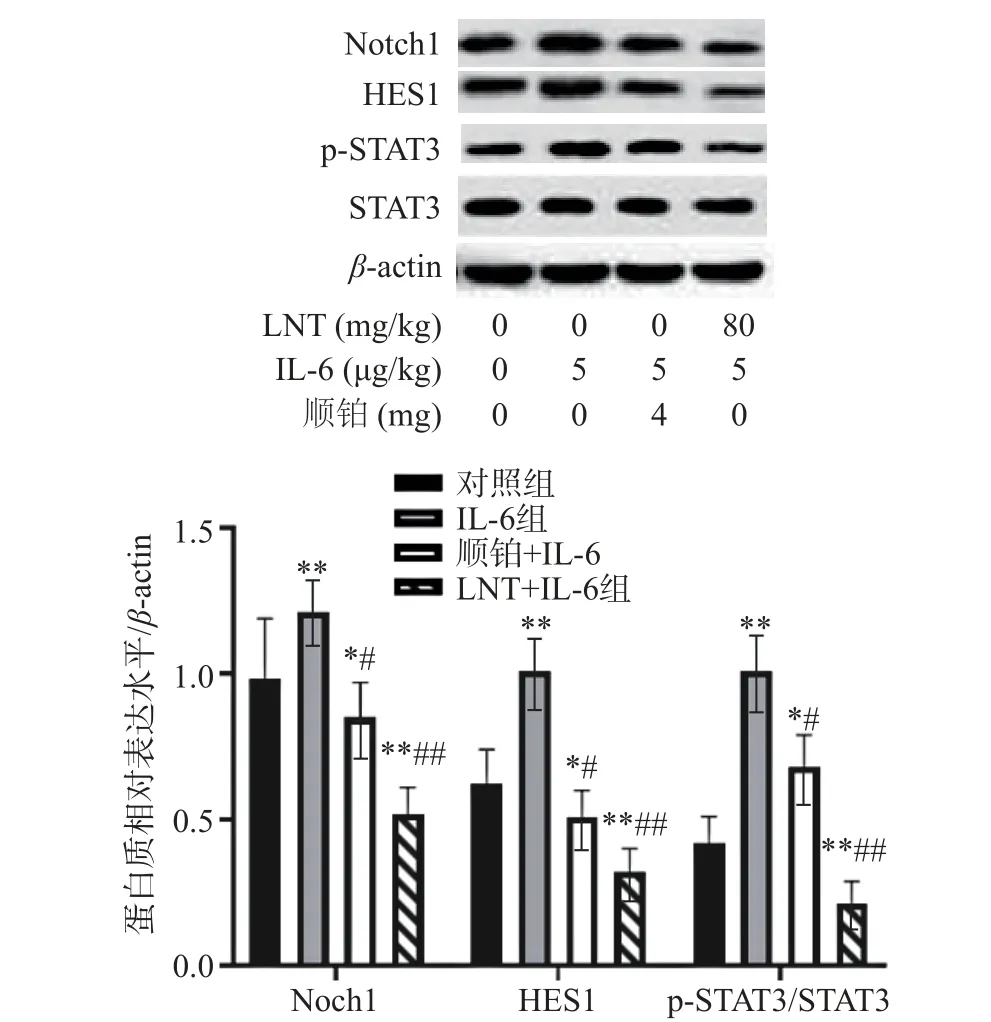
图8 IL-6 对胰腺癌移植瘤 STAT3/Notch 信号通路的作用Fig.8 Effect of IL-6 on STA T3/Notch signal pathway in pancreatic cancer xenografts
3 结论
本实验旨在研究LNT 对人胰腺癌的直接抗肿瘤作用及其对化疗敏感性的影响,并分析体内外机制。本研究中7.5~240 µg/mL 香菇多糖显著(P<0.05)抑制胰腺癌Capan-1 细胞增值和迁移,下调p-STAT3/STAT3、Notch1 和Hes1 表 达 水 平,说 明LNT 香菇多糖能通过调控IL-6/STAT3/Notch 信号通路影响Capan-1 的增殖和迁移。针对Capan-1/DDP 耐药株结果表明,LNT 能下调其对顺铂的IC50,说明LNT增强了Capan-1/DDP 对顺铂的耐药敏感性。此外,通过体内实验表明,LNT 能下调瘤体体积、瘤重,降低p-STAT3/STAT3、Notch1、Hes1表达水平,这些结果都表明LNT 能有效抑制IL-6/STAT3/Notch 信号通路,抑制癌细胞增殖,增加耐药敏感性。本研究通过体内外实验阐明了LNT 抗胰腺癌的基本机制,为LNT 作为一种辅助抗癌药提供了新的认识,为胰腺癌的发生机制、临床治疗提供参考,同时也为香菇多糖的进一步开发提供依据。

