肿瘤微环境激活的光声成像探针研究进展
许书语,梁晓龙
分子影像技术是一种在分子、细胞和亚细胞水平上以非入侵的手段对生物进行可视化的方法,近年来已广泛应用于诊断、治疗和临床研究中。光声成像(photoacoustic imaging,PAI)因其具备高穿透深度、低散射、高空间分辨率等特征使其在胎儿观察、肿瘤治疗、生殖器官检查等方向具有广泛的临床价值。然而,常规的光声成像难以检测肿瘤中低丰度的物质,且存在较高的背景信号干扰。异常的肿瘤微环境(tumor microenvironment,TME)具有低 pH、乏氧、血管塌陷、血流量低等区别于正常组织的特征,基于此开发的响应性光声探针能够极大程度地辅助光声技术应用于肿瘤成像。
1 光声成像在肿瘤诊疗中的应用
常见的临床成像技术如计算机断层扫描(computed tomography,CT)、正电子发射断层扫描(positron emission tomography,PET)、磁共振成像(magnetic resonance imaging,MRI)等在疾病的诊断中发挥着重要的作用,但它们仍存在分辨率差或设备成本昂贵等问题。相比之下,光学成像作为一种无创无辐射的方法,可提供高时空分辨率和高灵敏度图像,如非侵入性光学相干断层扫描(optical coherence tomography,OCT)、荧光成像等。但光学成像方法需要对被成像对象进行预处理(如使用荧光染料),以提高成像质量,且光学成像方法受到散射和吸收的限制,成像深度较浅[1]。
相比之下,声学成像方法不需要对成像对象进行特殊处理,可以直接对样本进行成像。同时,声学成像方法利用声波的穿透性,可以实现较大的成像深度,能够观察到更深部位的信息。更重要的是,利用高频声波可以实现更高的分辨率,从而观察到更细微的结构。因此,声学成像逐渐在科学研究和医学诊断等领域中得到广泛应用[2]。然而,传统的声学成像往往具有成像对比度不够高的缺陷,使其在一些软组织的观察中不能有效地反映组织状况。声波成像中的噪声,包括器械噪声、环境噪声和声波本身的噪声,降低了信号的质量,使得成像对比度下降。
光声成像是一种结合了光学和声学原理的生物医学成像技术。它利用激光的光学能量激发组织产生膨胀收缩并向外发射声波,然后通过检测这些声波来生成图像。光声成像结合了光学和声学的优势,具有高分辨率的同时提高了传统声学成像的对比度,可以提供更丰富的组织信息。其空间分辨率可以实现在毫米到亚毫米的尺度上进行成像,广泛应用于多种疾病的研究,包括癌症的早期检测、病灶定位和评估治疗效果;研究神经系统的结构和功能,如脑成像、神经活动监测;监测药物的输送和释放过程、药物的动态分布[3-4]。
肿瘤微环境的高度异质性使得光声成像在癌症的诊断和治疗监测中能够发挥重要作用。肿瘤细胞产生的血管内皮生长因子(vascular endothelial growth factor,VEGF)促进血管生成,使肿瘤血管密度明显增加,这些激增的血管缺乏正常血管的分级分支形式,使得血液灌注不均匀、血流紊乱。同时肿瘤血管壁内皮细胞异常,使得肿瘤血管壁相对脆弱,通透性强。这些特点显著区别于正常组织的脉管系统,因此通过光声成像可探测肿瘤血管情况,为检测肿瘤进展及代谢情况提供了依据。常见的光声成像进行癌症检测的研究包括乳腺癌筛查、皮肤癌成像、前列腺癌检测等。早期的光声成像利用内源性色素,如血红蛋白显示实体瘤血管氧合水平,及黑色素追踪皮肤癌细胞[3]。然而,想要提供更有代表性更加细致的肿瘤微环境追踪,在无光声探针的情况下难以实现,导致大量标志性事件被忽略。因此,开发靶向和可激活光声探针具有重要意义和需求[5-8]。
2 肿瘤微环境响应光声成像
可激活的光声成像探针设计策略是通过与预期目标分子相互作用,产生可观察的变化信号[9]。响应性激活后光声探针信号强度增加(或减少),或最大吸光度波长发生移动。这种可激活探针相比于不可激活探针的明显优势在于可检测肿瘤微环境中含量非常低的物质(例如,酶和 miRNA),同时提供了检测不具有明显寿命的物质的方法(例如,活性氧),可显著提升检测特异性,降低背景信号干扰。接下来,我们对肿瘤微环境中能够使探针发生响应性激活的物质进行描述,包括酶、活性氧(reactive oxygen species,ROS)[10]、谷胱甘肽(glutathione,GSH)[11-12]、硫化氢(hydrogen sulfide,H2S)、乏氧等。
2.1 酶响应
在癌症进展过程中,许多酶活性发生变化或表达异常,这与癌症的发展和转移有关。以下是一些与癌症相关的酶(表1)及其作用,①蛋白酶:在癌症中蛋白酶活性增加,导致细胞外基质(extracellular matrix,ECM)结构异常,从而促进癌细胞的侵袭和迁移;②颗粒酶 B:颗粒酶 B 是一种主要存在于细胞毒性 T 淋巴细胞(cytotoxic T lymphocyte,CTL)和自然杀伤 T 细胞(natural killer T cell,NKT)中的酶,当免疫系统中的 CTL 和 NTK 识别到癌细胞时,它们会释放颗粒酶和其他细胞毒素,以破坏和杀死癌细胞。也有一些研究表明,颗粒酶在某些癌细胞中的高表达与肿瘤的恶化和预后不良相关;③还原性辅酶 NAD(P)H:作为供氢体,NAD(P)H 在癌细胞的代谢途径和抗氧化应激中发挥着重要的作用。在本节中,我们将重点介绍在癌症进展中活性或表达发生变化的几种酶,以及通过光声成像对其进行可视化的可激活探针的设计。
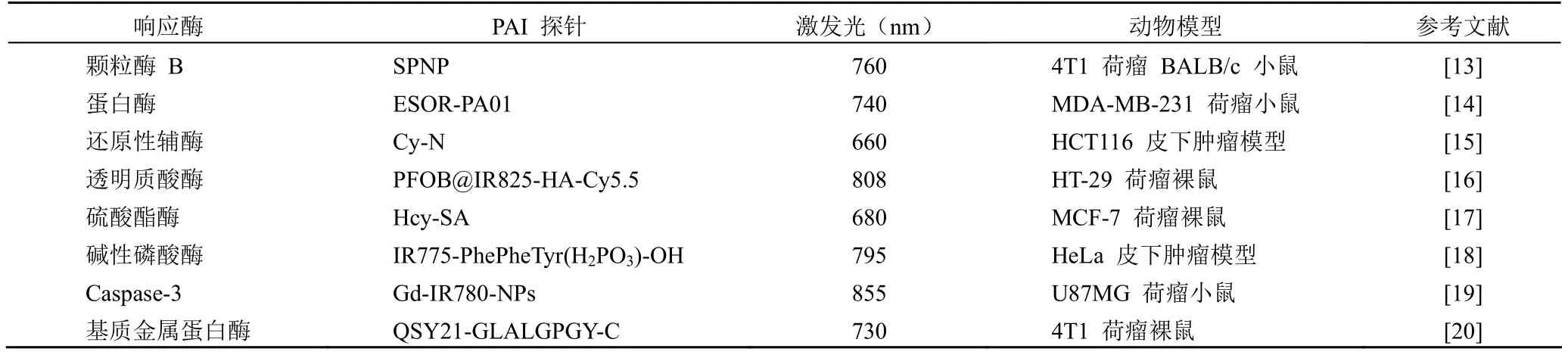
表1 酶刺激响应性 PAI 探针
颗粒酶 B 是一种丝氨酸蛋白酶,颗粒酶 B 在 CTL中的浓度显著升高,是免疫激活的一个重要标志。Zhang等[13]设计了一种由两亲性半导体聚合物(SP)与染料(IR800)标记的颗粒酶 B 可切割肽偶联体所自组装形成的纳米颗粒,并命名为 SPNP(图1)。在颗粒酶 B 的作用下,染料标记的肽被裂解并从 SP 核释放,导致其 780 nm荧光和 760 nm 处光声信号降低,而来自 SP 主链的 700 nm的荧光和光声强度不变。PA700/PA760相对于其无活性状态增强了 1.4 倍。小鼠体内实验表明,静脉注射后 SPNP 能被动靶向肿瘤,小鼠肿瘤中 T 细胞活化时,颗粒酶 B 浓度升高,导致荧光和光声信号发生改变,从而实现活化 T 淋巴细胞的监测。
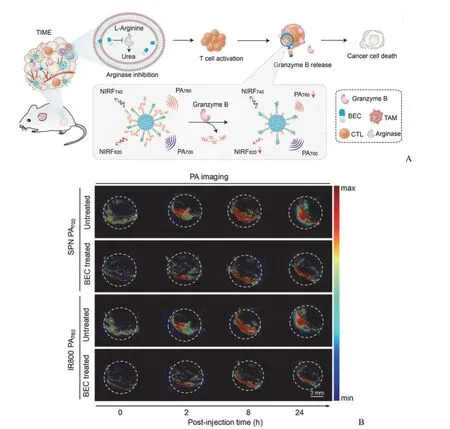
图1 SPNP 的活体实时近红外荧光和光声成像机制(A)和静脉注射后不同时间点的 4T1 荷瘤 BALB/c 小鼠光声图像(B)[13]
作为氢供体,NAD(P)H 酶能够反映肿瘤的能量代谢并可作为潜在的治疗靶点。因此,有必要设计有效的检测工具来可视化 NAD(P)H。Tian 等[15]介绍了一种基于 NAD(P)H的双模态成像探针(光声和荧光成像),并探讨了其在能量代谢过程中的应用,以及在肿瘤治疗中增强光热疗法的新策略。作者提出基于聚次甲基 π-电子系统运动的响应机制用于检测 NAD(P)H。菁染料作为荧光团用于合成探针并命名为 Cy-N。探针本身在近红外区无荧光,与 NAD(P)H 反应后,由于大共轭结构的移位,在近红外区有较强的荧光。荷瘤小鼠体内实验表明,Cy-N 具有良好的肿瘤富集和荧光/光声成像能力,小鼠经葡萄糖处理后,PAI 信号随时间的延长而增强(肿瘤细胞会比正常细胞摄取更多的葡萄糖,这也是肿瘤细胞中 NAD(P)H 表达水平高于正常细胞的原因之一)。而小鼠经丙酮酸处理后,肿瘤中 PAI 信号较其他组明显降低(丙酮酸在能量代谢过程中进一步分解为乳酸,消耗NAD(P)H,导致 NAD(P)H 降低)。
基质金属蛋白酶(MMPs)作为一种胶原酶,主要负责降解和重建胶原和凝胶蛋白等细胞外基质成分。肿瘤细胞高表达 MMPs 时与其侵袭和转移密切相关。Qin 等[21]设计了一种蛋白酶可激活的纳米酶,可用于光声和 MRI 引导的癌症治疗。利用明胶将超顺磁氧化铁纳米粒组装成纳米簇,并修饰 Cu1.77Se 形成纳米酶 Fe3O4@Cu1.77Se。当该纳米粒到达肿瘤部位时,过表达的 MMPs 分解胶原使其转化为小片段,从而提高 T2 加权成像(横向弛豫)差别和光声成像信号(图2)。
2.2 活性氧响应
在癌症发展过程中产生的一类高度活跃的氧化性分子通常称为活性氧,包括单线态氧(1O2)、超氧阴离子(O2-)、过氧化氢(H2O2)、羟基自由基(·OH)、一氧化氮(NO)等[22-24]。过多的活性氧可以引起 DNA 损伤、细胞膜的过氧化、线粒体功能异常等,进而促进癌症的发生和转移。基于活性氧的光声探针设计,可以响应内源性活性氧或光敏剂产生的活性氧,导致光声信号增强或减弱,从而实现对癌症治疗的监测。以下介绍两种较为常见的活性氧响应光声探针。
一氧化氮是一种有重要生理作用的活性氧,具有多种生物学功能包括血管舒张、细胞凋亡、免疫调节等[23]。在正常情况下,一氧化氮的产生和清除可保持平衡,而在肿瘤发展过程中一氧化氮含量升高。Lucero 等[24]提出,利用近红外二区(NIR-II)荧光和光声信号(900~1700 nm)可以避免内源性生物分子(如血红蛋白)对信号的明显干扰,因此NIR-II 光声成像更适用于低丰度目标(如一氧化氮)的检测。基于此,还开发了一种苯胺修饰菁类染料的近红外二区探针 APNO-1080,识别一氧化氮后可形成 N-亚硝化产物,最大吸收从 874 nm 红移至 1080 nm,从而实现高效的肿瘤活体光声成像。
另一种活性氧是肿瘤内普遍大量存在的 H2O2,其已被视为一种可行的生物标志物用于癌症的诊断和治疗[25]。Liu 等[26]将 ABTS 负载到过氧化物酶样金属有机框架MIL-100 中,随后涂覆聚乙烯吡咯烷酮(PVP),得到可活化的 ABTS@MIL-100/PVP 纳米粒(AMP NRs)。MIL-100可以在 H2O2存在下催化 ABTS,使其氧化成绿色的氧化ABTS(oxABTS),从而产生近红外荧光和光声信号。为了评估 AMP NRs 对肿瘤特异性光声成像的能力,对 4T1荷瘤小鼠瘤内和皮下非肿瘤组织注射 AMP NRs。小鼠肿瘤中 PAI 信号随着时间的推移明显增强,非肿瘤皮下组织中 PAI 信号变化忽略不计,说明 PAI 信号依赖于肿瘤微环境中的 H2O2(图3)。Chen 等[27]设计了一种通过Fe3O4介导的 Fenton 反应和 3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)的氧化进行肿瘤特异性光声成像的双响应纳米颗粒(FTRNPs),FTRNPs 溶液在H2O2处理前后其 690~990 nm 范围内光声图谱存在明显差异,且 PA 振幅的增加与 H2O2浓度有关。这种响应性光声成像能力可以显著减少非特异性信号,进而指导治疗和减少治疗副作用。
2.3 GSH 和 H2S 响应
2.3.1 GSH GSH 是一种含量丰富的三肽硫醇,参与人体许多重要的细胞生理过程,包括抗氧化和免疫调节。在许多癌症类型中,GSH 水平被证实显著升高,并在癌症发展中起着复杂的作用。因此,开发研究 GSH 的探针,有助于我们更好地理解其功能和作用机制,并为癌症治疗提供新的思路和方法。
Zhang 等[28]设计了 SiO2纳米粒子负载 GSH 响应的DNA 序列,该序列结合了近红外荧光团(F)和猝灭剂(Q),当有目标物 miRNA 存在的情况下,由 DNA 燃料驱动,荧光恢复,从而实现小鼠体内 miRNA 高灵敏的光声成像检测。Linker/F/Q DNA 双链结构中 F/Q 距离接近从而导致荧光猝灭,加入 miRNA-21 后,可促发 F-DNA 释放并恢复荧光从而实现 miRNA-21 的检测。类似的基于 GSH 响应的 PAI 成像,Wang 等[29]设计并合成了一种氧化钼多氧金属酸盐-铜纳米复合材料(Ox-POM@Cu)。其中 Mo6+被GSH 还原为 Mo5+,形成 POM,POM 在 NIR-II 表现出很强的吸收,从而实现肿瘤组织的 NIR-II 光声成像。体外实验表明随着 GSH 浓度的增加,1065 nm 处的 PAI 信号强度随着 GSH 浓度的增加而不断增强。荷瘤小鼠在注射纳米粒 1 h 后,其肿瘤组织中可观察到最强的 PAI 信号,而在肌肉中无明显的 PAI 信号,表明所设计的纳米探针对正常组织和肿瘤有不同的反应,即它可以在肿瘤微环境中提供选择性的 PAI 激活信号(图4)。
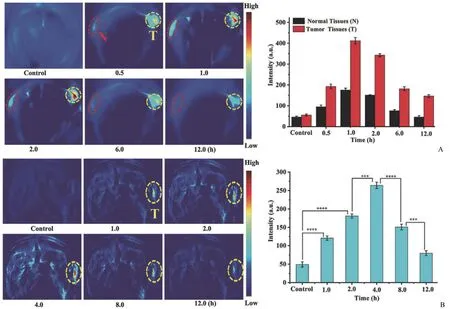
图4 荷瘤小鼠肿瘤原位(A)及尾静脉(B)注射 GSH 响应 Ox-POM@Cu 后不同时间点的肿瘤部位光声成像[29]
2.3.2 H2S H2S 是一种生理内源性气体,在血管舒张、抗炎症和促血管生成等细胞过程中发挥作用。同时,与正常组织相比 H2S 在多种肿瘤细胞中的水平通常升高。
Wang 等[30]将 MoO3纳米颗粒作为 NIR-II 纳米探针用于结肠癌组织的 PA 成像。实验结果表明,MoO3纳米颗粒能够快速穿透生物组织,H2S 能够快速激活纳米颗粒,生成多金属氧酸盐(POM),在结肠癌组织中产生 PA 信号。Wang 等[31]报道了一种聚集增强响应性分子探针,能够准确进行富含硫化氢 HCT116 肿瘤细胞与正常细胞的成像甄别。其中亲水性 N-乙基吡啶鎓充当吸电子基团,而疏水性氯化 BODIPY 充当硫化氢响应单元,自组装聚集且聚集增强了对硫化氢的响应能力,接触 H2S 后该探针可产生光声信号。Tao 等[32]报道了一种内源性 H2S 触发的 Au@Cu2O用于结肠癌诊断治疗,H2S 可与 Au@Cu2O 原位反应生成Au@Cu9S8,其在近红外区有很强的吸收,可用于光声成像和光热治疗。实验证明,经静脉注射后,Au@Cu2O 在极低剂量(2.5 mg/kg)下表现出良好的光声成像和光热治疗结肠癌的效果,在注射后 60 min,肿瘤部位光声信号强度是肌肉部位的 3 倍(图5)。
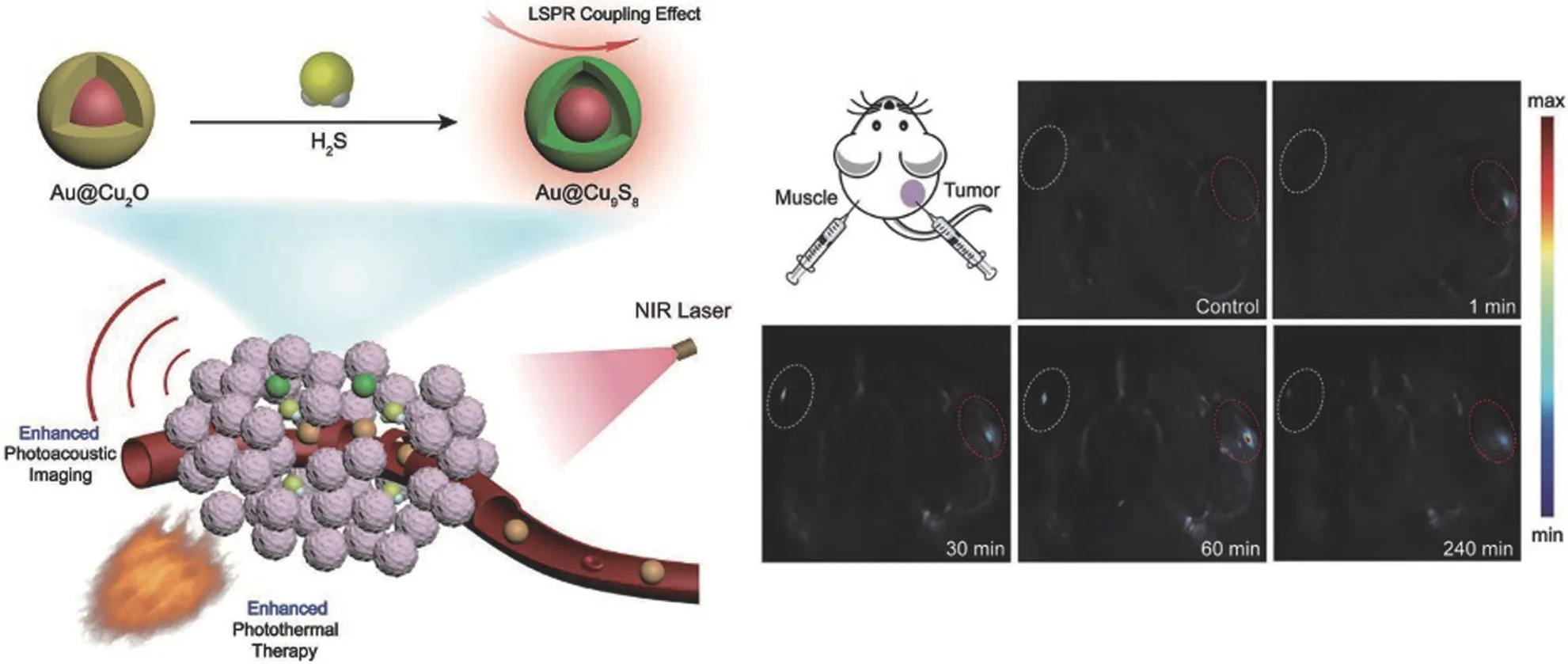
图5 内源性 H2S 触发 Au@Cu2O 增强光声成像和光热治疗结肠癌[32]
2.4 乏氧
肿瘤内血管塌陷,血流量降低,导致氧气供应受限,同时肿瘤组织细胞活跃增殖、代谢旺盛,共同作用导致了肿瘤组织的乏氧。乏氧作为肿瘤微环境的一大特征,检测乏氧可以指导治疗计划,并作为患者预后的预测指标,因此肿瘤的乏氧特征也被广泛应用于探针的开发。
Knox 等[33]受乏氧激活前药 AQ4N 的启发,设计了乏氧探针 1(HyP-1),乏氧能够快速直接地将 N-氧化物转化为相应的苯胺,使探针吸收波长从 670 nm 红移到 760 nm,进而可以作为一种光声成像探针用于乏氧检测并通过乏氧肿瘤模型的应用证明了这一点。此外,除了肿瘤内乏氧外,HyP-1 还可以有效检测外周动脉疾病后肢缺血模型体内的缺氧。
2.5 其他
除以上几种触发光声探针发生信号变化的物质外,肿瘤微环境中的一些其他特征,也能够影响光声探针的信号,包括核酸、蛋白[34]、金属离子、ONOO-[35]、酸响应[36]等。Lv等[37]报道过一种酸响应探针 AuNNPs-Ag2S Ve,酸响应前荧光信号关闭、光声信号开启,酸响应后荧光信号开启、光声信号关闭。其原因可能为 AuNNPs 组装引发的 LSPR 效应导致探针的吸收红移,增强了 PA 成像能力;酸性溶液促进 P4VP 的吡啶基团质子化,并导致 AuNNP 之间的等离子体耦合丧失,释放 Ag2S 量子点并使 NIR-II 荧光信号“打开”,同时 NIR-II 光声信号“关闭”。在人乳腺癌MCF-7模型肿瘤小鼠中,光声信号在探针注射后 6 h 出现,20 h 达到顶峰,增强 6 倍。Zhou 等[38]则报道了一种响应过表达成纤维细胞活化蛋白 α(fibroblast activation protein α,FAPα)的探针(FMP),FMP 中通过自消除链将 FAPα 特异性识别的二肽底物与 MB 偶联,荧光和光声信号猝灭,当探针主动靶向肿瘤部位后,二肽底物响应肿瘤细胞中高表达的 FAPα 释放亚甲基蓝,从而激活荧光和光声信号。小鼠乳腺癌 4T1 模型肿瘤小鼠实验表明,光声信号在给药2 h 后达到峰值,是使用 FAPα抑制剂处理小鼠的信号的1.7 倍,说明该探针光声信号依赖于肿瘤部位的 FAPα。
3 总结
光声成像在癌症早期诊断、治疗监测和成像引导手术的临床环境中显示出巨大的潜力。本综述回顾了基于肿瘤微环境特征激活的光声成像探针。通过本综述中列举的例子可以看到,肿瘤微环境中生物标志物的参与使得光声探针靶向识别能力增强。可激活探针的开发,不仅能够实现对肿瘤中低丰度物质的检测,还可进一步提高检测的精确度。然而,探针的短期和长期生物安全性需要更加系统全面的研究,在实际探针的研发中应尽可能考虑安全性好且可生物降解的材料。此外,目前的研究大部分仍停留于小动物模型层面,对人体肿瘤的研究仍非常有限。当前小规模的基础研究想要应用到临床,未来仍需要更大规模的临床试验和更加规范的执行标准。同时,光声成像设备的研发和临床推广也是非常重要的,近年来包括光声内镜(PAE)系统、光声断层扫描技术(PACT)、光声显微成像技术(PAM)等光声技术的发展,有助于将光声成像带到生物医学成像技术的前沿,而响应性光声成像探针的开发对于光声技术的临床应用将展现出巨大的推动作用。

