智能微纳机器人在疾病诊疗中的应用进展
许冬雨,宋思哲,柴人杰,
(1.东南大学数字医学工程全国重点实验室,东南大学附属中大医院耳鼻咽喉头颈外科,东南大学生命科学与技术学院,东南大学生命健康高等研究院,江苏省生物医学高新技术研究重点实验室,江苏 南京 210096;2.南通大学神经再生协同创新中心,江苏 南通226001;3.四川省医学科学院·四川省人民医院耳鼻喉头颈外科,四川 成都 610072;4.中国科学院干细胞与再生医学研究院,北京100101;5.首都医科大学北京市神经再生修复研究重点实验室,北京 100069;6.东南大学深圳研究院,深圳 518063)
在自然界中,分子马达、病毒、细菌、精子等微纳米尺度的组件能够在生物体内实现自由游动及有序操作。受自然界中微纳米尺度下可有序操控组件的启发,Feynman[1]探讨了构建分子大小的亚微米尺度机器并在狭小空间中实现有效操控的可能性。常规疾病诊疗策略难以检测到疾病发生的标志物分子,降低了抵达目标区域的药物有效数量,而能够实现无创操控、疾病早期诊断及药物靶向递送的智能微纳机器人引起了研究人员的广泛关注[2]。为了构建适用于生物体的智能微纳机器人,需从构建材料、结构及尺寸方面全面考虑。首先,材料方面应具有良好的生物相容性、生物可降解性或低毒性可安全排出等特性,以保证智能微纳机器人的在体安全性。其次,结构设计方面要考虑到智能微纳机器人工作的生理环境及驱动机制,使用自上而下或自下而上的策略制造适应性强、低雷诺系数液体环境中可驱动的结构和组成。最后,尺寸方面应考虑到智能微纳机器人需要通过的生物屏障,如要穿过血脑屏障、血眼屏障等构建纳米级机器人,而胃肠道中则可以使用微米甚至毫米级机器人。
目前,基于微纳米加工技术、生物物理、生物材料等多学科领域的交叉发展融合,逐步研发出多种微纳米尺度机器人,实现了在生物体内的微米尺度可控操作[3-5]。通过微纳加工、小型化等技术[6],已制备得到了多组分、多形态的智能微纳机器人,包括中空微管[7-8]、螺旋微纤维[9]、Janus 微球[10]、微针[11]、微爪[12]、仿生细菌纤毛状[13]、生物膜包裹[14]等。得益于所设计的智能微纳机器人体积小、可无线操控、灵敏度高、可负载药物等优势,它们可以在生物体系统中借助信号反馈系统实现对所处生理环境的判断,并结合体外操控实现智能调控和可控释放药物及微纳米尺度操作等,已在生物医学领域,包括疾病标志物检测、细胞/药物靶向递送、微米尺度操作、生物成像、生物传感等方面,展现出巨大的应用潜力。
近年来,对应用于生物医学领域中的智能微纳机器人的无毒性、生物安全性要求不断提高,多种生物材料、无毒化学燃料、外加场源及生物能源等被用来设计并驱动体内的智能微纳机器人。此外,结合多形貌智能微纳机器人的制备可实现不同医学应用场景的个性化合理设计,提高智能微纳机器人在复杂环境中的自适应性,从而推动智能微纳机器人在疾病诊疗中的实际应用。本文总结了智能微纳机器人的无线驱动策略及其在疾病诊疗方面的最新研究进展,并就智能微纳机器人在疾病诊疗中面临的挑战和发展方向展开讨论。
1 智能微纳机器人的驱动机制
微纳米尺度的智能机器人在体内血液、胃肠液等低雷诺系数的体液环境中工作时,需要突破自身的黏性阻力和布朗运动,从而实现有效位移抵达目标区域[15]。因此,多种外源冲击力用于智能微纳机器人供能,使其完成自主前进甚至突破生物屏障等。智能微纳机器人主要的驱动机制分为燃料驱动、外加场源驱动及生物能源驱动等。
1.1 燃料驱动
燃料驱动是指智能微纳机器人自身所负载的生化燃料与所处环境发生反应,并在微纳机器人自身或附近产生不对称化学梯度(离子梯度、电场梯度、浓度梯度等)或不稳定气泡来实现能量转换,从而驱动自身前进[15-19]。微纳机器人与周围介质之间的化学反应导致其表面产生电解质浓度梯度,在微纳机器人两极产生电渗透流,实现自电泳驱动微纳机器人运动。然而,自电泳驱动微纳机器人的运动速率与溶液电阻率之间线性相关,因此高浓度电解质溶液中的运动速率不理想。为了解决该缺陷,提升应用场景,Zhan 等[16]设计了一种表面接枝磺化聚苯乙烯涂层的P 型硅核/N 型硅壳纳米线机器人,其中高离子导电性的聚电解质涂层可作为支撑微纳机器人表面导电层的多孔支架,在很大程度上阻止离子猝灭,从而将自电泳微纳机器人的离子耐受性提高了100 倍以上(见图1A)。
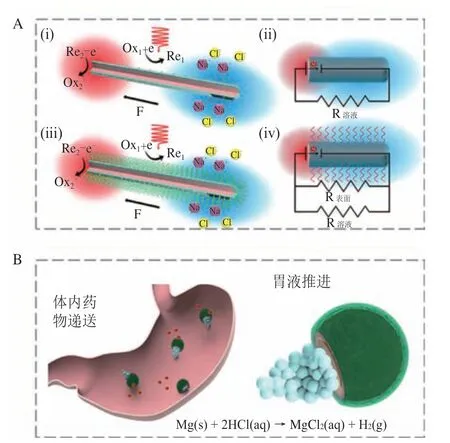
图1 基于化学燃料驱动的智能微纳机器人Figure 1 Chemical fuel-driven intelligent micro/nanorobots
受限于自电泳微纳机器人的驱动力小、难以在高浓度电解质环境中工作等问题,研究人员提出了气泡驱动的智能微纳机器人。借助不对称气泡破裂产生的微气流和分离产生的冲力,气泡驱动微纳机器人可以实现自主运动。以过氧化氢(H2O2)燃料为例,铂(Pt)等金属可将其催化分解为氧气和水分子,大量氧气产生的气泡能够为微纳机器人提供动力。然而,常用燃料H2O2对生物体存在潜在毒性,且难以适应不同组织环境。为了适应生物体环境,提高燃料安全性,de Ávila 等[17]设计了Janus 载药镁基微纳机器人,以胃酸作为燃料产生氢气气泡实现微纳机器人在胃部的自驱动,用于胃部感染治疗(见图1B)。此外,Cai 等[19]开发了装载泡腾片燃料的火箭式微纳机器人,其在水环境中能够产生大量的二氧化碳气泡,从而推动微纳机器人自主运动,促进微针尖端刺入肠道黏膜中进行体内药物释放。此外,Mathesh 等[20]设计了一种二维(2D)氧化石墨烯纳米机器人,通过负载过氧化氢纳米酶能够在超低燃料浓度(0.003% H2O2)下自主运动,为降低智能微纳机器人的环境介质依赖性提供了解决策略。
1.2 外加场源驱动
为了应对生化燃料驱动微纳机器人面临的燃料安全性差、使用寿命有限、靶向性弱等挑战,多种外加场源被用来实现智能微纳机器人的无线驱动。结合磁场、光场、声场等具有一定组织穿透能力的可控外加场源,智能微纳机器人有望实现在体的可控、靶向、无燃料安全前进。
外加低强度磁场凭借其灵活性、对生物组织无损伤、可远程控制等优势,成为智能微纳机器人的常用外加场源驱动方式。磁控微纳机器人在外加螺旋、振荡或平面梯度磁场的调制下,受到磁力矩和磁梯度力影响,从而在低雷诺系数液体环境中实现自主运动[21-23]。近年来,为实现单细胞操作、靶向递送、生物传感等目标,多功能磁控微纳机器人被设计成双金属微棒、Janus 微球、螺旋状、管状、爪状以及链状等多种形貌。Wu 等[9]利用掠射角沉积方式在单层硅纳米阵列表面物理气相沉积了金属镍作为磁性部分,从而制备得到了螺旋桨状的磁控微纳机器人(见图2A)。随后通过全氟硅烷的气相沉积,在螺旋桨磁控机器人表面生成了光滑的液体层,并在旋转磁场调控下实现沿螺旋长轴的完整旋转,从而完成了在玻璃体内部的无线驱动。为实现磁控微纳机器人对单细胞的可选择性操作,Yang 等[24]利用磁性光刻胶中单次暴露飞秒脉冲光涡旋来制备尺寸、形状可调控的管状磁控微纳机器人。在永磁铁诱导下管状磁控微纳机器人沿磁场方向进行旋转运动,并在磁力诱导下实现磁控前进。这种管状磁控微纳机器人能够进行药物和细胞的封装,并在磁场下实现精确驱动、捕获、释放等操作,为可进行单细胞操作的磁控微纳机器人的制备提供了更为简单易行的策略。然而,体内强血流环境对微纳机器人在目标位置的滞留提出了挑战,赵杰课题组开发了一种以花粉为核心的红细胞膜涂覆的微爪磁控机器人[14]。凭借微爪增加的摩擦力,该磁控机器人在颈静脉中显示出长期滞留效果,从而实现靶向部位的长期高效给药。此外,Li 等[25]也设计了结合功能性凝胶的多功能磁控微纳机器人。装配有环境响应性聚合物的链状磁控微纳机器人能够在外加磁场驱动下实现可控群体运动,并在生理微环境变化下呈现可视化结构色变化从而指示体内局部微环境异常现象。

图2 基于外加场源驱动的智能微纳机器人Figure 2 Applied field-driven intelligent micro/nanorobots
自然界中的光感生物在光照下展现出不同的运动模式,如趋光性绿藻能够游向光源以获得更多的光合作用,避光性微生物为避免辐射损伤等表现出远离光源的特性,这展示了外源光场在生物驱动中的特性并对光场驱动智能微纳机器人的开发具有启示作用。此外,光场调控在控制超分子聚合物和金属材料的结构与性质方面具有较明显的优势,包括较深的组织穿透能力、较高的时空精度以及无废物产生[26]。因此,直接光学操控、光电转换以及光热转换成为光控智能微纳机器人的驱动机制。当半导体硅纳米线被可见光到红外光范围内光照射时,其在电场中的旋转速度可以立即增加、减少甚至逆转方向,实现光照下对运动模式的有效调控(见图2B)[27]。光电镊子不同于磁场操控等非接触式微纳操控技术,它可以产生非均匀电场,在较低光强下产生主要驱动力,从而实现对微纳器件的平行独立操控。冯林课题组使用光电镊对微螺旋藻的大规模平行操纵进行了研究,在投射光模式下可以利用多个光点实现对微螺旋藻的不同并行操控,并进一步地利用微螺旋藻构建了T 形、微线圈等不同形貌的组合微结构[28]。Dai 等[29]设计了一种Janus 二氧化钛/硅纳米树光控微纳机器人,其中包括一个光电阴极和一个光电阳极。纳米树光控微纳机器人在光照下发生光电化学反应,不对称的两端生成阴离子和阳离子,形成离子浓度梯度,从而推动微纳机器人自电泳前进。进一步对纳米树光控微纳机器人的两端进行化学修饰调控其zeta 电位,成功编程了具有正负趋光性的光控微纳机器人。然而,这种外加光场驱动机制难以在生物体内直接驱动光控微纳机器人,因此具有较大组织穿透能力的近红外光被用来刺激不对称光控微纳机器人,使其周围产生温度梯度从而借助光热机制驱动光控微纳机器人的前进[30]。
然而,光照穿透组织的深度较浅,对深层组织的照射效果较差,限制了外加光场驱动光控微纳机器人的使用。相较之下,超声波作为一种常用的外加声场刺激,具有较深的组织穿透能力、良好的生物安全性、较低的使用成本等优势,多种声控微纳机器人在超声波控制下展现出良好的驱动特性[31]。de Ávila 等[32]构建的生物膜包裹的金纳米线机器人在超声波驱动下能够在血液中呈现快速有效地长时间运动(见图2C)。此外,Zhang 等[33]研究了声波振荡模式下产生的底部气泡对微米尺度样品的可控传输、捕获、三维旋转和圆周旋转运动,有望实现微米尺度生物样品的采集和分析。Ren 等[34]利用模板辅助电化学沉积制备的金-铑双金属微棒在声表面波驱动下可实现自主定向移动,显示了声表面波对微纳机器人定向移动的驱动作用。此外,压电生物材料因其固有的压电特性,能够直接将机械刺激转化为电刺激,因此压电生物材料在超声波刺激下所产生的电学特性引起了声控微纳机器人领域的广泛研究[35-36]。Kim 等[37]设计了一种N,N'-二仲丁基-N,N'-二亚硝基-1,4-苯二胺修饰的聚多巴胺涂层压电钛酸钡纳米颗粒,在目标位置的高强度聚焦超声波作用下,该压电微纳机器人释放一氧化氮并介导血脑屏障的短暂开放,从而实现靶向脑的有效治疗。
1.3 生物能源驱动
除了化学燃料和外加场源作为外加驱动能源外,自然界中本身具有自我推进能力的细菌、细胞、微藻等也被用来开发智能微纳机器人。利用这些生物自身的运动能力,智能微纳机器人能够实现自主运动,并且基于细菌的趋向性,如趋磁性、趋化性、趋光性、趋热性等[38],可以实现生物能源驱动的微纳机器人定向运动[39]。在Janus 聚苯乙烯/铁纳米粒子上,大肠埃希菌呈现出金属侧的优先黏附性,从而构建了大肠埃希菌驱动的Janus微纳机器人[40]。鞭毛状大肠埃希菌能够通过螺旋旋转鞭毛来推动微纳机器人在低雷诺系数环境中前进,并结合磁性Janus 颗粒的磁定向能力实现其在外加磁场下的定向混合运动。此外,基于合成生物学和基因工程技术,可以对细菌等常用细胞进行遗传回路、模型生物体和设计参数的编辑,实现对微生物细胞的精确工程化,从而获得多功能生物能源驱动的微纳机器人[41]。因此,Inda-Webb 等[42]对益生菌进行基因工程编辑,使其具有分子特异性发光特性,并将基因工程益生菌生物传感器与小型化光电探测设备结合构建了以微生物传感为核心的小型化检测胶囊。
具有自主前进或收缩特性的细胞,如精子、肌肉细胞等也被用来构建具有自主运动功能的机器人。Sun 等[43]仿生毛毛虫蠕动前进方式制备了具有不对称爪子的软体机器人,该软体机器人以心肌细胞作为生物能源驱动软体机器人前进。在不同浓度药物处理下,软体机器人呈现出不同的前进速度和距离,从而评估药物对心肌细胞活性的影响。然而,为实现微纳米尺度和生物体内环境下的有效驱动,由生物能源驱动的智能微纳机器人仍需解决活体生物能源的损耗、生物与材料界面难以有效集成、难以微型化等问题。此外,受制于单一驱动机制的局限性,目前开发的多种智能微纳机器人常采用多种机制混合驱动,如生物膜包裹、光热驱动与外加磁场驱动等共同推进智能微纳机器人自主前进。
2 基于智能微纳机器人的疾病诊疗应用
凭借生化燃料、外加场源以及生物能源的多种驱动机制,智能微纳机器人的动态自主运动能够克服传统静态系统的不足。由于具有自主运动、无线可控性、体积小、效率高等优势,智能微纳机器人在疾病诊疗中展现出巨大优势,主要用于疾病诊断、细胞/药物靶向递送以及微米尺度下的精细操作等。
2.1 疾病诊断
智能微纳机器人凭借其尺寸小,无线操控能力强、灵活性高等优势,可以在狭小空间中进行精细操控,在细胞水平进行非侵入性检测,并结合其生物传感、成像等特性,有望实现对在体内的疾病标志物分子进行检测传感和体内病变组织的成像,从而对疾病进行早期诊断并动态监测疾病进程。Wang等[44]构建了多种荧光染料包被的磁控纳米机器人,并通过外加磁场的控制,形成了大小可控的纳米机器人集群,可以在局部富集荧光染料浓度,提高信噪比,相较于传统细胞染色,可实现少量染料引入、低细胞毒性、高精度可控的细胞成像。此外,用于体内细胞/组织机械性质检测的智能微纳机器人也被开发,Mohagheghian 等[45]将一种微十字磁控微纳机器人植入细胞群中,并通过响应振荡磁场进行刚性旋转来充当刚性探针,量化组织牵引力和刚度,用于研究细胞、组织和胚胎的机械调节等。该研究结果显示,干细胞样肿瘤细胞群的剪切模量随三维底物的弹性而改变,但其三维牵引力不受基底影响;进一步利用微十字磁控微纳机器人检测了斑马鱼及小鼠胚胎发育过程中的牵引力振荡,这有助于深入了解动物胚胎发育过程中力学变化在原肠胚形成和器官发生中的作用。
近年来,为实现生物组织的实时观察及生理特性监测,研发了多种智能微型机器人用于组织成像[46-47]和疾病标志物检测[42,48]等。Sitti 团队设计了一种具有生物黏合剂贴片的柔性磁控机器人,在外加磁场控制下,该磁控机器人能够实现在软组织表面行走、攀爬,在狭窄缝隙中爬行,在液体环境中游动等多种运动模式[47]。通过使用外部磁场可以控制微型软体机器人与组织的相互作用,借助医学成像系统可视化软体磁控机器人的形状,从而精确地反映组织特性,成功实现了对动物胃肠道组织的黏附性、pH 值和黏弹性等组织生理特性的原位实时监测。为进一步实现对胃肠道疾病标志物分子的原位检测,多种基因工程编辑的微生物传感器已被设计,例如Inda-Webb 等[42]构建的基因工程益生菌生物传感器和小型化光电探测器及芯片集成的小型化检测胶囊。对细菌进行基因编辑,使其能够对炎症相关分子(一氧化氮、硫化氢)进行发光反应,并在光电探测器中转化为无线信号,成功在动物模型中实现了对胃肠道炎症因子的监测,有助于炎症性胃肠病的早期诊断,同时能够准确跟踪疾病进程。这些小型化设备成功实现了对生物胃肠道组织生理特性、形貌以及疾病标志物分子的监测,但也需要设计相关的功能化微纳机器人并拓展其在多种生物体组织中的成像、传感及检测等应用。
2.2 靶向递送
传统被动给药方式下,到达目标区域的有效药物量不足1%,新型靶向纳米制剂能够通过被动靶向、主动靶向及物理靶向方式提高药物在目标组织或器官中的积累,但尚未达到特异性积累的目标。然而智能微纳机器人能够实现体内巡航,并特异性靶向至目标区域或通过信号反馈系统判断所处生化环境特性后,主动释放药物,从而提高药物治疗效率,降低对正常组织的毒副作用[49]。Cai 等[50]设计了一种吸盘状气泡驱动微纳机器人,其底部球面负载镁粉,多孔水凝胶借助高体积比实现高效的药物负载。在胃液中,吸盘状气泡驱动微纳机器人产生氢气实现自发运动,借助独特的吸盘结构,微纳机器人能够有效附着在胃溃疡区域并释放药物,对胃溃疡具有良好的治疗效果。此外,一些趋向性细菌具有天然靶向肿瘤的能力,实体瘤的缺氧环境、肿瘤微环境中产生的分子信号等均为微生物靶向肿瘤提供了先天条件。为了增强细菌对肿瘤的靶向杀伤性,聂广军与赵潇团队使用功能化四氧化三铁纳米粒子修饰基因工程大肠埃希菌构建了具有“主动导航”“信息解码”“信号反馈”“信号处理”和“信号输出”5个功能模块的磁控生物微纳机器人[51]。在结肠特异性给药后,该磁控生物微纳机器人主动靶向肿瘤,并在交互磁场下使局部温度升高,从而实现荧光成像和细菌裂解后免疫治疗药物的释放,进一步达到对肿瘤的精准免疫治疗而避免了免疫药物带来的血液毒性。
此外,干细胞疗法在再生医学中得到了广泛的关注,通过将活细胞注射、移植入患者体内,可以替代、修复或增强受损组织的生物学功能[52]。为实现微创、精准靶向递送细胞、提高细胞存活率等目标,使用智能微纳机器人进行细胞递送可达到准确、可控及无创等目的[53-54]。张立团队使用宿主来源的干细胞(98.1%)和磁性纳米粒子(1.9%)构建了磁控柔性干细胞微米机器人[54]。在内窥镜帮助下的磁控柔性干细胞微米机器人可以快速通过器官和组织中的多种生物屏障,外加磁场能够进一步驱动微米机器人抵达目标区域,实现干细胞的精准快速递送,同时宿主来源的干细胞降低甚至消除了免疫反应。这种靶向递送细胞的微纳机器人在干细胞疗法的实施上成为一种有效智能工具。
生物体中的多种生物屏障虽抵挡了外源物质对生物体的有害侵袭,也阻碍了药物的有效递送,因此智能微纳机器人也被用于突破多种生物屏障来提供有效药物治疗[55]。Zhang 等[56-57]设计了具有磁性基底、可分离连接部分和载药尖端3 个部分的微针状磁控机器人。被肠溶性胶囊包裹的微针状磁控机器人在进入小肠时被释放,随后在外加磁场的调控下,微针尖端靠近小肠组织且由于强磁场的控制而刺入肠组织并持续释放药物,最后磁性基底在分离后安全排出体外。这种微针状磁控机器人在口服胰岛素调节血糖方面展示出有效治疗效果。此外,血脑屏障能够组织常规药物分子进入大脑,是治疗脑肿瘤、神经退行性疾病的一大阻碍。Kim 等[37]构建的声控压电纳米机器人在高强度聚焦超声波作用下释放一氧化氮,能够突破血脑屏障聚集在脑实质中,并在超声波作用下输出电流,实现深部脑刺激,刺激多巴胺能神经元样细胞释放多巴胺,从而减轻神经退行性疾病的症状。
2.3 微创手术
能够通过机械臂及手术器械模拟主刀医师技术动作的达芬奇手术机器人在腹腔软组织微创手术中展现了出色的手术效果和优势,相应地,微纳机器人也能够实现在微纳米尺度下的精准操控甚至单细胞操控。Wu 等[9]制备的螺旋桨状磁控微纳机器人具有和玻璃体基质孔隙相匹配的亚微米尺寸,可以借助光滑表面在外加磁场控制下实现自主运动,克服生物聚合物的黏附,成功抵达视网膜,为眼科微创手术治疗提供了有力工具。通过在聚碳酸酯膜孔中依次沉积金、银和镍, Pumera 团队开发出了能够针对单个细胞进行显微手术操作的金/银/镍磁控微纳机器人[58]。该磁控微纳机器人具有良好的推进效率和较高的磁场阶跃频率,在横向旋转磁场控制下能够进入肿瘤细胞的细胞质,并能在保留质膜完整的情况下切除部分细胞质以用于进一步的深入研究。
3 结语与展望
自1959 年微型“外科医生”设想被提出[1],微纳米加工技术、生物流体、材料工程等多学科的发展和融合使得智能微纳机器人逐渐成为现实。凭借尺寸小、灵活度高、无线操控等优势,多种形貌、驱动方式的智能微纳机器人被设计用于生物体内复杂环境下的驱动及狭窄空间内的递送和操作等。本文综述了智能微纳机器人不同驱动方式下的自主运动,并对智能微纳机器人在疾病诊断、靶向递送及微创手术等疾病诊疗领域的最新进展进行了回顾。
尽管多种智能微纳机器人在疾病诊疗中取得了令人惊喜的进展,但距其实现临床应用仍面临很多挑战。1)生物材料方面,为实现智能微纳机器人的在体应用,制备材料和驱动燃料应该选取生物相容性好、无毒性副产物、避开免疫系统清除的生物材料。此外,智能微纳机器人的可控降解性或回收机制仍需要各领域研究人员持续关注。2)驱动机制方面,目前化学燃料、外加场源和生物能源等驱动方式实现了智能微纳机器人在低雷诺系数环境中的自主运动,但化学燃料及生物能源驱动的智能微纳机器人寿命有限且单一的驱动策略难以精准操控智能微纳机器人。因此,具有多种驱动策略、可控精度高、使用寿命长的智能微纳机器人有待研发。3)功能方面,智能微纳机器人需要实现在体内血液、玻璃体及胃肠道黏液的自主运动及穿透生物屏障抵达目标区域的能力。此外,智能微纳机器人在生物体内的可控性和自适应性对其在体内的递送能力、成像性和实时监测性能提出了要求。总之,基于以上3 个方面问题的解决,有助于智能微纳机器人的个性化制备和性能完善,有望在未来疾病诊疗中发挥巨大潜力。

