人脐带间充质干细胞来源外泌体对大鼠卵巢早衰模型治疗效果的研究
杜小倩,张艳丽,丁 勇,曹 琦,李华锋,赵振峰,马春玲,4#
(1滨州医学院,山东 烟台 264003;2临沂市妇幼保健院;3山东翰康生物科技有限公司;4山东医学高等专科学校,山东 临沂 276000)
卵巢早衰(Premature ovarian failure,POF)是指女性在40岁之前出现卵巢功能障碍的综合征,主要表现为促性腺激素升高和雌激素水平降低,导致女性出现围绝经期症状,身体多器官脏器功能受到影响,目前临床尚无根本性恢复卵巢功能的治疗方法。外泌体是由活细胞分泌的直径约30~150 nm的细胞外囊泡,为细胞信号分子,可以选择性携带和转运蛋白质、脂质、microRNA、mRNA等进入细胞,从而影响细胞功能。脐带间充质干细胞来源外泌体(huMSCs-exo)因无伦理学争议、发挥作用迅速、低免疫原性、无成瘤性、易保存和运输,安全性更高,而受到研究学者的广泛关注[1]。本研究旨在探讨huMSCs-exo对大鼠POF模型的治疗效果,从而为提供POF的治疗提供参考。
1 材料与方法
1.1动物 8周龄清洁级雌性SD大鼠15只(北京维通利华实验动物技术有限公司),体质量(220±10)g,全价营养饲料,室温22~25℃,相对湿度35%~55%,模拟正常昼夜生理节律,予12 h光照,自由饮水和进食。本研究均符合临沂市妇幼保健院实验动物伦理委员会有关动物研究指导原则。
1.2主要试剂和设备 顺铂注射液(齐鲁制药有限公司,国药准字:H20040813);大鼠E2、FSH、LH雌激素ELISA试剂盒(武汉菲恩生物科技有限公司);滤光片型光吸收酶标仪(美国Molecular 公司, CMax Plus);Leica EG1150包埋机、Leica RM2235切片机、Leica HI1210摊片机、Leica HI1220烘片机、Leica CV5030全自动玻璃盖片机和Leica ST5010病理染色机(德国Leica Biosystems Nussloch GmbH公司);BX43显微镜(日本Olympus公司)。
1.3方法
1.3.1HuMSCs-exo的分离和鉴定 HuMSCs-exo来源于足月妊娠剖宫产胎儿的脐带。在超净工作台内取出新鲜脐带,PBS反复清洗,去掉脐带动脉和表面羊膜,剪成直径约1.5 mm大小的组织块,5%CO2、37℃培养箱内培养。待间充质干细胞爬出组织,去除组织块,用0.25%胰酶消化,传代培养。将培养上清液离心除去细胞碎片、死细胞等杂质后得到外泌体沉淀,弃去上清液,加入PBS得到外泌体,分装后于-80℃冰箱保存。HuMSC-exo的鉴定:透射电镜下观察外泌体的形态,纳米颗粒跟踪分析仪分析粒径大小,Western Blot检测标记蛋白。
1.3.2动物模型构建 将15只SD大鼠随机分为A、B、C三组,各5只鼠。其中B、C两组每周一次将顺铂(4 mg/kg)通过腹腔注射到大鼠体内进行造模,持续2周,A组同时间注射等体积生理盐水。
1.3.3外泌体治疗方法 造模完成后,于次日开始C组注射huMSCs-exo悬液1 mL(0.75 mg/mL)治疗,其他两组注入等体积生理盐水,1次/d,直至第18天将其处死。
1.4指标评定 大鼠的行为观察:造模后,每日对比观察各组大鼠的精神状态、活动情况、被毛光泽、对外界的反应和进食量等。体重测量:造模前1 d、自造模之日开始每周测量大鼠体重。促卵泡生成素(FSH)、促黄体生成素(LH)、雌二醇(E2):各组大鼠造模前1 d、第14、18天行眼眶取血,分离血清,ELISA法检测。

2 结果
2.1HuMSC-exo的鉴定 电镜下外泌体呈扁圆形、球形或杯状的形态(见封三图1),其平均粒径为81.9 nm,粒径主峰73.0 nm,原液浓度4.02×1010粒子/mL(见封三图2);通过Western Blot检测分析,特异性标志蛋白分子CD9、CD81、HSP70为阳性(见封三图3)。
2.2大鼠行为学改变 A组:大鼠无明显异常表现,精神状态良好,进食量正常,活动敏捷,皮毛光滑。B、C组:随着给药时间的推移,绝大部分进食逐渐减少,形体逐渐消瘦,反应迟钝,对外界反应淡漠,皮毛暗淡,毛发蓬松。至给药结束时,3组大鼠均未出现死亡。
2.3体重变化 随喂养时间的延长时间,A组大鼠体重呈增高趋势,B、C组呈递降趋势。见表1。
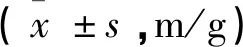
表1 三组大鼠不同时点体重变化
2.4E2、FSH、LH水平 随时间的延长,各组激素水平变化见表2。
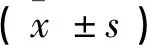
表2 三组大鼠不同时点血清FSH、LH、E2水平的比较
3 讨论
近年来,POF的发病率呈上升趋势,是女性不孕的主要原因之一。临床多采用激素替代疗法,在一定程度上改善患者生活质量,但不能恢复卵巢功能[2]。间充质干细胞(Mesenchymal stem cells,MSCs)是具有自我更新潜力和分化成各种特化细胞类型能力的成体多能祖细胞,于1966年首次从骨髓中发现,随后在成人其他组织如脂肪、牙髓、胎盘、羊水、脐带血中均有发现[3]。目前,MSCs已在组织再生领域的研究中显示出了明显的疗效,然而因其致瘤风险和伦理道德争议[4-5],其临床应用受到一定制约。有研究发现,MSCs释放的外泌体在减少细胞损伤、增强修复作用方面具有与MSCs同样的作用。各种细胞来源的外泌体可通过多种途径与不同的靶细胞相互作用,包括直接结合、吞噬、直接融合和内吞,然后产生特异的治疗效果。Jeongyeon Heo等研究发现,外泌体在内皮细胞、血管平滑肌细胞和巨噬细胞等多种细胞类型之间进行物质交换对动脉粥样硬化的改善作用[6]。另外,在癌症、神经退行性疾病、代谢性疾病以及免疫性炎症等疾病中外泌体也具有一定的治疗作用[7-9]。在利用间充质干细胞外泌体治疗POF模型的研究中发现,骨髓间充质干细胞来源的外泌体携带的miR-644-5p通过靶向调节p53抑制了POF小鼠的卵巢颗粒细胞凋亡[10]。这些证据有力说明了外泌体有望成为治愈POF的一个新型疗法。
本研究中利用huMSCs来源的外泌体对顺铂诱导的POF大鼠模型进行治疗,结果显示,huMSCs-exo治疗后三种激素的水平都有改变,与正常对照组的水平接近,证明huMSCs-exo具有改善卵巢功能的作用。这充分证明了huMSCs-exo在POF治疗中的潜力,然而目前仍处于探索阶段,还需对其发挥作用的机制和剂量的标准化方案方面进行探讨和验证。

