乳酸/白蛋白比值联合NLR 构建的列线图对急性呼吸窘迫综合征患者早期预后的预测价值
罗延年,席振创,王锐,李美玲,关银,曹雯*,黄晓峰,毛文杰
1兰州大学第二医院重症医学科,甘肃兰州 730030;2甘肃省肿瘤医院麻醉科,甘肃兰州 730050
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种以肺泡毛细血管内皮细胞和肺泡上皮细胞损伤为病理生理特征、以进行性呼吸困难和顽固性低氧血症为临床表现的异质性综合征[1]。经过50多年的临床实践与探索,人们对ARDS的流行病学特征、发病机制的认识不断深入,治疗策略也更加完善[2],但并未降低ARDS的总体患病率和病死率。一项大规模流行病学调查显示,ARDS患者的死亡风险与疾病严重程度呈正相关[3],即使经治疗病情得到迅速缓解的患者,其病死率仍高达31%[4]。目前尚缺乏对ARDS 早期预测和风险评估的特异性生物标志物。长期临床观察发现,大多数ARDS患者存在低蛋白血症及乳酸水平异常,且同时存在中性粒细胞水平升高和淋巴细胞水平降低。研究发现,乳酸/白蛋白比值(lactate-to-albumin ratio,L/A)较乳酸能更好地预测脓毒症患者的住院病死率[5]。Liang 等[6]研究发现,中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)可预测脓毒症患者的28 d病死率。L/A联合NLR是否能预测ARDS患者的临床结局,国内外研究甚少。本研究探讨基于L/A 联合NLR 构建的列线图模型对ARDS 患者预后的预测价值及临床时效性,旨在为高危ARDS 患者的早期识别和干预提供参考。
1 资料与方法
1.1 研究对象 本研究为回顾性病例对照研究。选取2018 年3 月-2022 年6 月兰州大学第二医院重症医学科收治的115 例ARDS 患者。纳入标准:符合2012 年ARDS 柏林诊断标准[7]且年龄≥18 岁,ICU 住院时间≥24 h。排除标准:(1)合并肿瘤、血液系统疾病、风湿免疫性疾病;(2)临床资料不完整。根据28 d临床结局分为生存组(n=62)与死亡组(n=53)。本研究获兰州大学第二医院医学伦理委员会批准(2022A-580)。
1.2 方法
1.2.1 资料采集 收集患者的临床资料,包括性别、年龄、急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分、Murray 肺损伤(Murray)评分、ARDS 来源[肺源性ARDS(pulmonary ARDS,ARDSp)和肺外源性ARDS(extra pulmonary,ARDSexp)]、序贯器官衰竭估计评分(SOFA 评分)、脏器衰竭数目、ICU住院时间、机械通气时间(人工气道建立至拔除或死亡时间)、28 d 死亡情况,同时记录确诊24 h 内血常规、血清白蛋白、血气分析结果等,并计算L/A及NLR。
1.2.2 列线图模型构建与评价 采用logistic 回归分析ARDS患者28 d预后的独立危险因素并构建列线图模型;使用R 4.2.1 语言rms 程序包中的“lrm”函数建立logistic回归模型,利用“plot”函数进一步绘制列线图;采用ROC曲线、校准曲线和决策曲线评价列线图的准确度及临床预测效能。
1.3 统计学处理 采用SPSS 26.0 软件进行统计分析。符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用Mann-WhitneyU检验;计数资料以率(%)表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床资料比较 115 例中男75 例,女40例,年龄(62.9±13.0)岁;合并基础疾病主要为慢性呼吸系统疾病(29.6%,34/115)、内分泌疾病(18.3%,21/115)、内科心脏疾病(15.7%,18/115)、多发伤(13.0%,15/115)、肾脏疾病(2.6%,3/115);ARDS肺内原因主要为重症肺炎(55.7%,64/115),其次为感染性休克(24.3%,28/115);ARDS肺外原因主要为严重复合伤和外科术后(52.2%,60/115),其次为脓毒症(27.8%,32/115)。28 d死亡53例,生存62例。
两组性别、ICU 住院时间、机械通气时间、基础白蛋白水平差异无统计学意义(P>0.05)。死亡组年龄,APACHE Ⅱ、SOFA、Murray 评分,脏器衰竭数目,ARDSp占比,NEU、NLR、L/A,以及血乳酸水平均明显高于生存组,氧合指数(PaO2/FiO2)、ARDSexp 占比、LYM、PLT 均低于生存组,差异有统计学意义(P<0.05,表1)。

表1 两组ARDS患者临床资料比较Tab.1 Comparison of the clinical data of the two groups of ARDS patients
2.2 ARDS患者28 d预后的危险因素分析 将表1中P<0.05 的因素作为自变量[年龄(赋值:<65 岁为0,≥65 岁 为1)、APACHE Ⅱ评 分(赋 值:实 测 值)、SOFA 评分(赋值:<2 分为0,≥2 分为1)、PaO2/FiO2(赋值:<150 mmHg 为0,≥150 mmHg 为1)、Murray评分(赋值:实测值)、脏器衰竭数目(赋值:<2个为0,≥2 个为1)、ARDS 来源(赋值:肺源性为0,肺外源性为1)、PLT(赋值:实测值)、NLR(赋值:实测值)、L/A(赋值:实测值)],以患者28 d临床结局(死亡=1,生存=0)为因变量,纳入多因素logistic回归分析,结果显示,年龄、SOFA 评分、ARDS 来源、NLR、L/A 为影响ARDS 患者28 d 预后的独立危险因素(P<0.05,表2)。
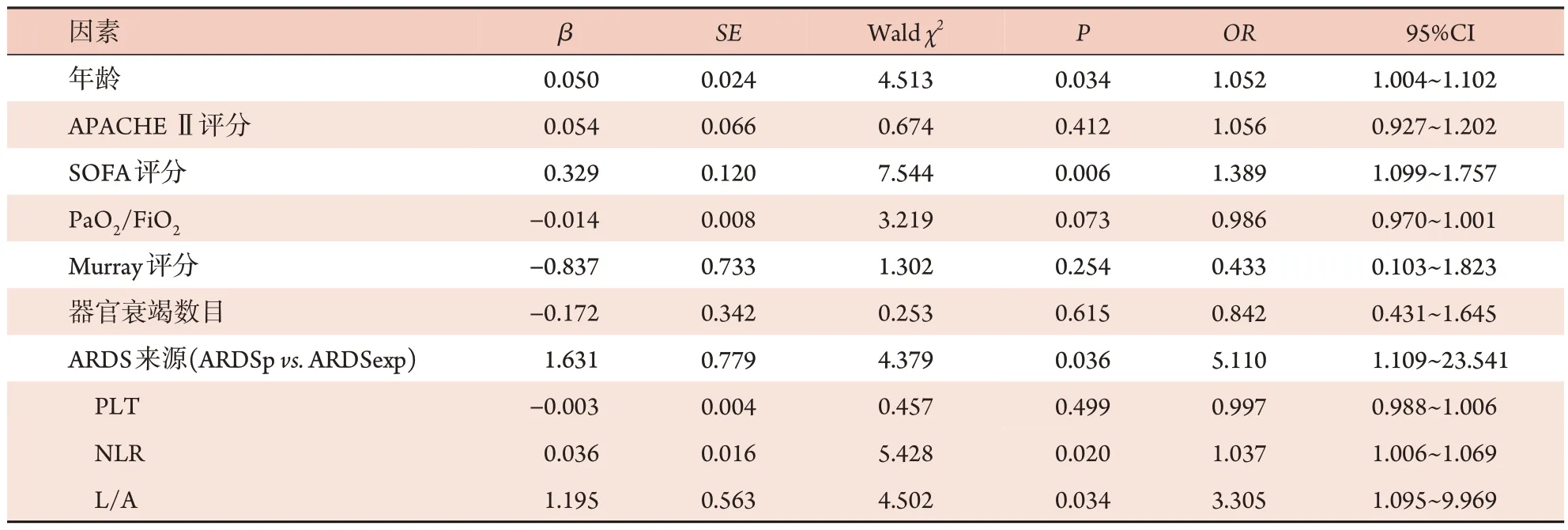
表2 ARDS患者28 d死亡的多因素logistic回归分析Tab.2 Multivariate logistic regression analysis of 28-day mortality in patients with ARDS
ROC 曲线分析显示,年龄、SOFA 评分、ARDS来源、NLR、L/A预测ARDS患者28 d预后的ROC曲线下面积(AUC)分别为0.651、0.777、0.579、0.727、0.753,而年龄、SOFA 评分、ARDS 来源联合预测的AUC 为0.830,明显高于年龄(Z=3.536,P=0.000)及ARDS来源(Z=5.392,P=0.000)。但与SOFA评分比较差异无统计学意义(Z=1.854,P=0.064)(图1、表3)。
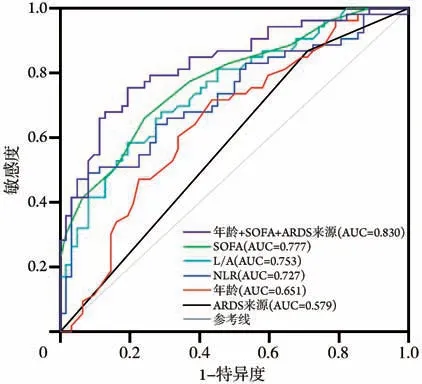
图1 不同评价指标预测ARDS 患者28 d 死亡的ROC 曲线分析Fig.1 ROC analysis of different evaluation indexes predicting 28-day mortality of patients with ARDS
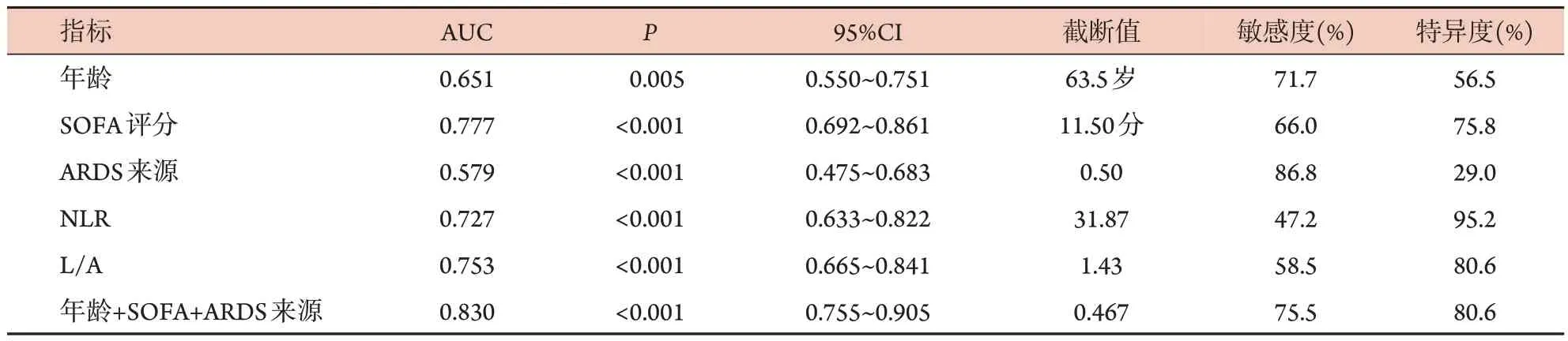
表3 不同评价指标对ARDS患者28 d死亡的预测价值分析Tab.3 The predictive value of different evaluation indexes for 28-day mortality of ARDS patients
2.3 预测ARDS 患者28 d 死亡风险的列线图模型构建 纳入多因素logistic 回归分析中5 个独立危险因素绘制列线图模型,如图2 所示,列线图中每一个变量对应的线段均有相应评分,通过计算每位患者各个变量的总评分,即可得到预测该患者28 d 死亡的概率。

图2 预测ARDS患者28 d死亡风险的列线图模型Fig.2 Nomogram model for predicting 28-day mortality risk in patients with ARDS
将logistic 回归筛选的5 个危险因素构建的列线图模型定义为模型1,模型方程=-9.99+0.042×NLR+1.000×L/A+0.327×SOFA 评 分+0.044× 年 龄+1.358×ARDS来源;将年龄、SOFA评分、ARDS来源三个指标联合构建的模型定义为模型2。比较两个模型发现,模型1 的AUC 明显大于模型2(0.889vs.0.830,图3A)。
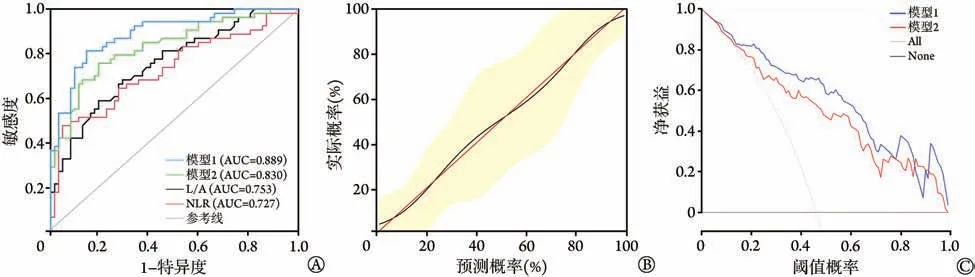
图3 列线图模型准确性验证及预测效能评价Fig.3 Verification and efficiency evaluation of the nomogram
校准曲线分析结果显示,列线图预测ARDS 患者28 d 死亡的概率与实际概率十分接近(图3B),提示模型1预测ARDS患者28 d死亡的准确率较高。
决策曲线分析显示,模型1较模型2在整个阈值概率范围内具有更高的净效益值(图3C)。
3 讨 论
ARDS因其复杂的病理生理特点和极高的病死率而备受关注。越来越多的研究证实,ARDS是多种炎性因子介导的过度炎症反应和宿主免疫失控引起的全身炎症反应综合征在肺内的表现[8]。当遭到强烈的应激源打击后,机体会激活两大免疫细胞参与炎症反应调控:(1)固有免疫细胞,如巨噬细胞、中性粒细胞在肺内募集与活化,作为效应器分泌和释放多种炎性介质,不断扩大级联反应以清除入侵的病原体。(2)中性粒细胞的适度活化在宿主防御中起着至关重要的作用,但过度活化会进一步加重肺部炎症损伤,如释放中性粒细胞多肽和中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)等[9-11]。若固有免疫系统不足以抗衡致病抗原时,会引发特异性免疫应答,并激活B 淋巴和T 淋巴细胞产生效应细胞,以参与免疫调节。既往研究发现,脓毒症患者存在中性粒细胞延迟凋亡现象,同时存在特异性免疫细胞凋亡加剧现象[12]。 一项来自法国OutcomeRea数据库的多中心前瞻性队列研究也证实,脓毒症患者淋巴细胞凋亡标志物表达增高,且持续低淋巴细胞血症可增高28 d 病死率[13]。淋巴细胞凋亡虽可减轻机体失控的炎症反应,但同时也易导致免疫抑制,增加二次感染的风险[14]。本研究发现,与生存组比较,死亡组基线NEU 水平明显升高,LYM 水平明显降低,差异均有统计学意义(P<0.05),提示以全身炎症反应综合征为病理基础的ARDS 患者存在中性粒细胞过度激活、延迟凋亡及淋巴细胞减少,这可能是加剧患者死亡的危险因素之一。
近期有学者根据ARDS 生物标志物异质性将患者分为高炎症亚型与低炎症亚型进行前瞻性队列研究,发现高炎症亚型患者的病死率是低炎症亚型的2倍,且对呼吸末正压(positive end-expiratory pressure,PEEP)的反应不同,发生脏器衰竭更多,预后更差[15]。因此,早期炎症反应程度及相关生物标志物水平可预测ARDS 患者的临床结局,但上述研究指标均来自实验室并非临床常规检测项目,寻找影响ARDS 预后的常规生物标志物或联合模型十分必要。NLR 是由外周血细胞计数衍生而来的新型炎症标志物,可间接反映机体生理应激和免疫炎症反应的强度,被证实能预测恶性实体肿瘤、脓毒症、炎症性肠病、心血管疾病等多种疾病的预后[16-19]。本研究发现,死亡组NLR 明显高于生存组(28.77vs.12.08,P<0.05),提示NLR可预测ARDS的早期预后。Zhang等[20]研究也证实,ARDS 患者的基线NLR 与短期预后呈正相关,与本研究结果一致。
血乳酸和白蛋白也可用于疾病严重程度及预后的评估。但基线白蛋白水平对ARDS 患者的预后评估存在分歧,大部分学者认为低白蛋白血症可反映ARDS的严重程度,但与病死率无关[21]。本研究也发现,两组ARDS 患者基线白蛋白水平差异无统计学意义,与上述研究结果一致。L/A 在疾病临床结局预测中的价值明显优于单独使用乳酸和白蛋白的结论已得到广泛认可[22]。本研究多因素回归分析显示,L/A和NLR均为ARDS预后的独立危险因素(P<0.05),且AUC 分别为0.753、0.727,明显优于年龄和ARDS来源,但略逊于SOFA 评分。本研究发现,作为ARDS 严重程度分型的PaO2/FiO2在单因素分析(P=0.004)和多因素分析(P=0.085)中结果不一致,这与既往对ARDS 的认知相矛盾。笔者通过自变量间共线性分析和哑变量处理后得出相同的结论,但P值均接近0.05,认为可能与本研究样本量相对较小或未知混杂因素的存在有关。
由于ARDS 病因学及临床表型的异质性特点,目前尚无单一可靠的生物标志物能准确预测其临床结局[23],通过常规多指标联合构建风险预测模型,对ARDS 进行早期识别和干预意义重大。本研究通过L/A、NLR与传统临床预测指标相结合构建ARDS 28 d预后列线图模型(模型1),同时将传统预测指标年龄、ARDS 来源及SOFA 评分联合构建模型(模型2)。比较发现,基于L/A、NLR 的新模型AUC 为0.889,而传统预测模型的AUC为0.830,提示前者具有更高的预测价值(图3A)。校准曲线显示,模型预测曲线与实测曲线基本吻合,表明新模型对ARDS死亡风险具有较高的判别能力,准确度较高(图3B);同时,决策曲线也显示该模型具有较高的临床应用前景(图3C)。
综上所述,相较于传统危险因素,基于L/A 联合NLR 构建的列线图模型能更好地预测ARDS 患者的早期预后,且具有较高的预测效能及临床获益。该模型可帮助临床医师早期识别ARDS 死亡高风险患者,尽早进行医疗干预,以降低ARDS 的病死率,减轻经济负担。但因本研究样本量较小且仅对基线变量进行建模研究,并未监测不同时间点各项指标的动态演变对预后的影响,未能明确变量指标与疾病发生发展的因果关系,有待后续多中心研究进一步证实。

