不同居群北柴胡ISSR遗传多样性分析
闫晓睿,薛帼珍,杨晓霞,王宇,杜晨晖,张朔生,刘计权
山西中医药大学中药与食品工程学院,山西 晋中 030619
中药柴胡最早出现于《神农本草经》,被列为“上品”,到目前为止已经使用了两千多年[1]。柴胡为伞形科植物柴胡Bupleurum chinenseDC.或狭叶柴胡Bupleurum scorzonerifoliumWilld.的干燥根,按性状不同,分别习称“北柴胡”和“南柴胡”[2]。柴胡具有解表和里、疏肝解郁、升提中气之功效,主治感冒发热、寒热往来、黄疸肝炎及月经不调等[3]。其中,北柴胡主要产自山西、河北、河南、辽宁等省份,而南柴胡主要产于湖北、四川、安徽等省份。根据相关资料显示,全世界柴胡属植物大约有200种,我国现已明确的柴胡属植物共有42个种、17个变种和7个变型[4-6]。除海南省外,柴胡在我国其他省份都有分布[7]。柴胡种源丰富,在一定程度上给鉴别工作带来了不小难度。
自古以来,山西省都是道地药材柴胡的重要产地之一,省内南北地理较大的跨度导致柴胡在不同的地理位置、气候、水土等条件影响下的内在质量和外观性状良莠不齐。因此,对不同来源柴胡的遗传多样性及其亲缘关系进行分析具有重要意义。现阶段对柴胡真伪鉴别的方法有随机扩增多态性
DNA(random amplified polymorphic DNA,RAPD)、简单重复序列(simple sequence repeat,SSR)、内源转录间隔区(internal transcribed spacer,ITS)片段及ISSR分子标记等[8]。本研究采取液氮研磨提取法,提取了10 个不同居群的北柴胡DNA,对其ISSR-PCR反应体系进行优化,并研究了10个居群的北柴胡样品的种内亲缘关系,以期为胡柴的良种选育、规范化栽培和临床应用提供一定参考。
1 材料与方法
1.1 仪器与试药
AB135-S型电子分析天平购自梅特勒-托利多仪器(上海)有限公司;HH-4数显恒温水浴锅购自金坛市杰瑞尔电器有限公司;H2016D高速离心机购自上海知信实验仪器有限公司;MX-S涡旋振荡器购自大龙兴创实验仪器(北京)有限公司;Easy-Cycler 96PCR 扩增仪购自德国耶拿分析仪器股份公司;DYY-6C型稳压稳流电泳仪购自北京市六一生物科技有限公司;NanoDrop 2000超微量分光光度计购自美国 Thermo公司;ZF-258全自动凝胶成像分析系统购自上海嘉鹏科技有限公司;TWD-9403C紫外仪购自北京六一生物科技有限公司。
DP3112 植物组织DNA 提取试剂盒购自无锡百泰克生物技术有限公司;PremixTaqDNA 酶购自宝日医生物技术有限公司;引物由美国Thermo公司合成;DL2000 DNA Marker、琼脂糖、5×TBE缓冲液、无酶无菌水、TE 缓冲液均购自北京索莱宝科技有限公司。
1.2 实验材料
实验用北柴胡供试品来源于甘肃、山西、河南、内蒙古等10个产地(表1)。于2021年4月15日—5 月1 日进行取样,分别取各居群新鲜、健康的柴胡植株叶片叶尖。将采集样品带回实验室-25 ℃保存备用。所有实验材料经山西中医药大学刘计权教授鉴别,均属于伞形科植物柴胡Bupleurum chinenseDC.。
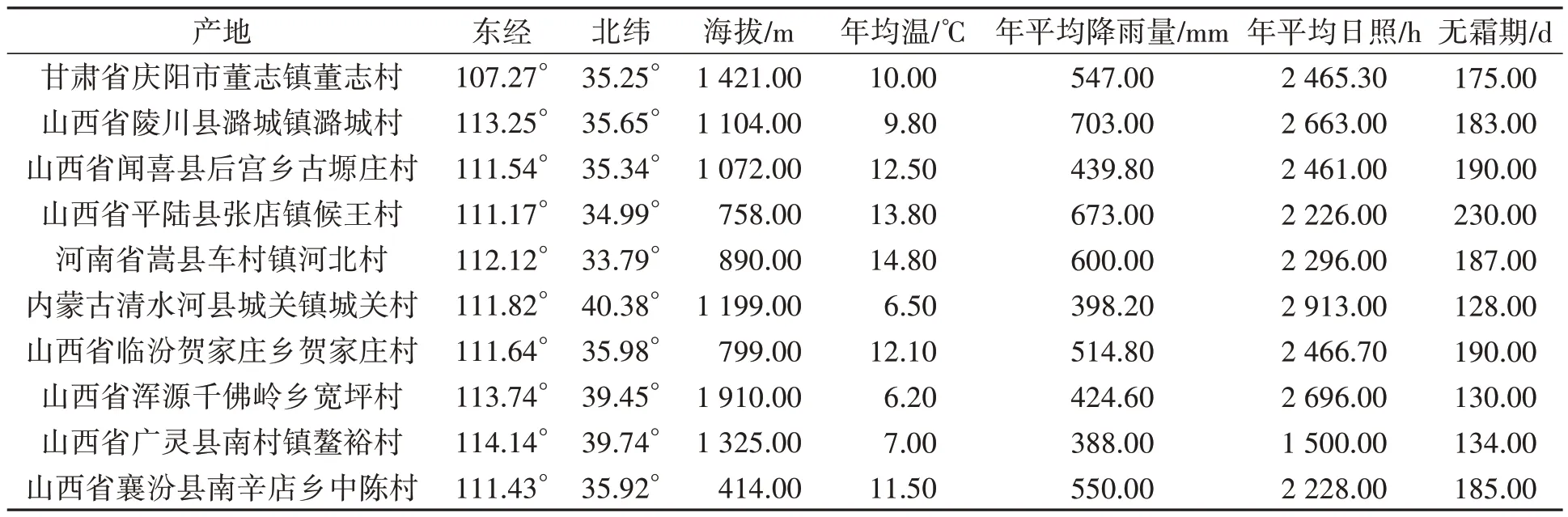
表1 不同产地北柴胡环境因子原始数据Table 1 Raw data of environmental factors of B. chinense from different producing areas
1.3 北柴胡DNA的提取
取新鲜北柴胡叶片叶尖适量,加入液氮充分研磨至细粉状。参照植物组织DNA 提取试剂盒说明书提取样品DNA,采用精密紫外分光光度计测定OD260/OD280及DNA 浓度,剩余的DNA 样品于-20 ℃低温保存备用。
1.4 反应体系的优化
1.4.1 PremixTaq-DNA 酶的最佳加入量 结合文献[9-10]及预实验结果综合分析,反应程序为:94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火45 s,72 ℃延伸2 min,共45 个循环;最后72 ℃延伸7 min。本实验使用引物808,PCR 扩增采取25 μL反应体系,包括模板DNA 20 ng、10 μmol·L-1引物2 μL,PremixTaqDNA酶设置了10.0、12.5、15.0 μL 3 个体积,无酶无菌水补足。PCR 产物用1%琼脂糖凝胶电泳进行分析,5 V·cm-1电压条件下电泳45 min,以DL2000 DNA marker 为对照,用凝胶成像系统拍照并记录结果。
1.4.2 模板DNA 的最佳加入量 在确定Premix
Taq-DNA 酶量的基础上,设置20、40、60 ng 3 个模板DNA 用量梯度,观察模板DNA 用量对ISSRPCR扩增的影响,选择最佳加入量。
1.4.3 最适引物及最佳加入量 参照UBC 发布的ISSR引物,并结合相关文献[11-13],选取扩增条带较多且条带清晰的引物,每种引物分别设置1、2、4 μL 3个梯度。将扩增产物放置于紫外照射箱观察,依据生成条带的明显程度,筛选出最适合的引物种类与浓度。
1.5 不同居群北柴胡遗传多样性分析
对10 个北柴胡的DNA 样品进行ISSR-PCR扩增,并统计扩增条带。按相同迁移位置上有扩增条带的不论强弱记为“1”,无带记为“0”,得到全部样品的图谱二态数据矩阵,用NTSYSpc-2.1 软件进行计算,获得样品的遗传相似系数矩阵。用UPGMA方法依据遗传相似系数进行聚类分析,并构建聚类系统树状图。
2 结果与分析
2.1 北柴胡DNA的提取
经超微量分光光度计测量,液氮提取不同居群北柴胡DNA 所得结果较为良好,OD260/OD280比值均高于1.8,证明10 个样地所提取的双链DNA纯度较高,可用于后续实验。具体测定结果见表2。居群浓度/(ng·μL-1)纯度/(A260/A280)

表2 柴胡样品的DNA浓度和质量Table 2 DNA concentration and quality of B. chinense samples
2.2 反应体系的优化
2.2.1 PremixTaq-DNA 酶的最佳加入量 由图1

图1 Premix Taq-DNA酶含量对ISSR-PCR扩增的影响Fig. 1 Effect of premix Taq-DNA enzyme content on ISSR-PCR amplification
可知体系中加入10 μL 和15 μLTaq-DNA 酶时,呈现的条带亮度较弱,当加入12.5 μLTaq-DNA酶时,出现了特征明显的发光亮带。因此,在本次实验条件下,25 μl反应体系中Taq-DNA酶最适用量为12.5 μL。
2.2.2 模板DNA 的最佳加入量 由图2 所示,当模板DNA 为20 ng 时,扩增条带较弱;40 ng 时扩增条带最弱且不清晰,而DNA 用量为60 ng 时扩增结果最佳,因此本实验选择60 ng为反应体系中模板DNA的用量。
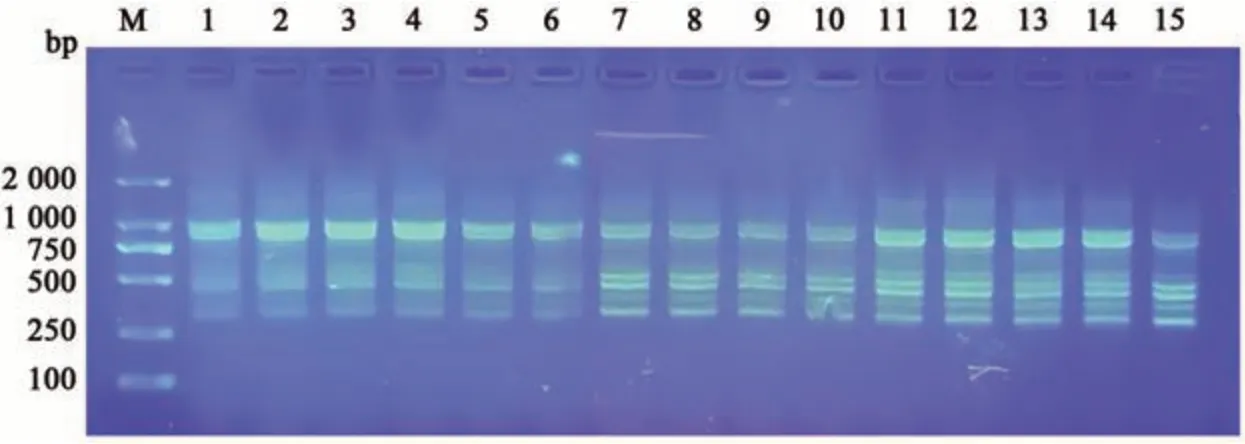
图2 模板DNA用量对ISSR-PCR扩增的影响Fig. 2 Influence of template DNA dosage on ISSR-PCR amplification
2.2.3 最适引物及最佳加入量 依据上述实验结果确定了引物种类与用量,选取4 条扩增条带较多且条带清晰的引物(表3)。由图3 可以看出当选择840 引物2 μL 时,条带清晰且稳定。因此,本实验选择840 作为最适引物,引物量以2 μL为最佳。
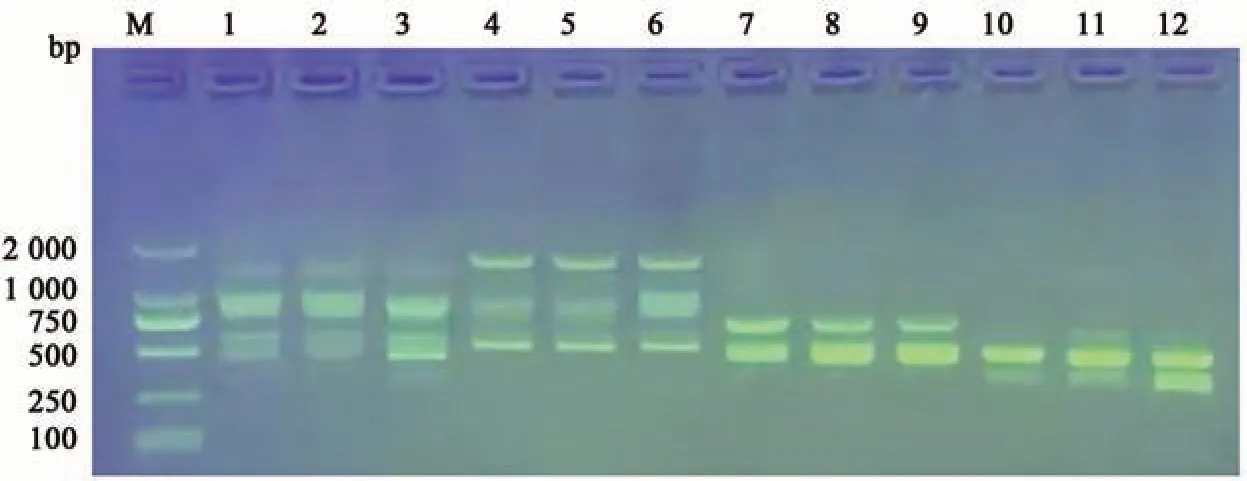
图3 不同引物及用量对ISSR-PCR扩增的影响Fig. 3 Influence of different primers and dosage on ISSR-PCR amplification
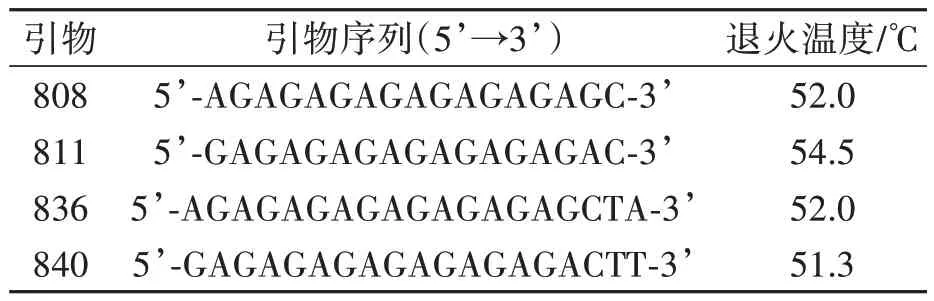
表3 北柴胡ISSR分析的引物序列及其最佳退火温度Table 3 Primers sequence and optimum annealing temperature for ISSR analysis of B. chinense
2.3 不同居群北柴胡遗传多样性分析
2.3.1 ISSR-PCR扩增检测 由2.2进行的ISSR-PCR反应体系优化实验,确定ISSR-PCR 分析最适宜的25 μL PCR 反应体系:模板DNA 60 ng,PremixTaqDNA 酶12.5 μL,840引物(10 mmol·L-1)2 μL,无酶无菌水补足。10个北柴胡样品使用840引物均可以扩增出清晰的条带,大部分扩增片段分子量在250~1 500 bp,具体结果如图4所示。
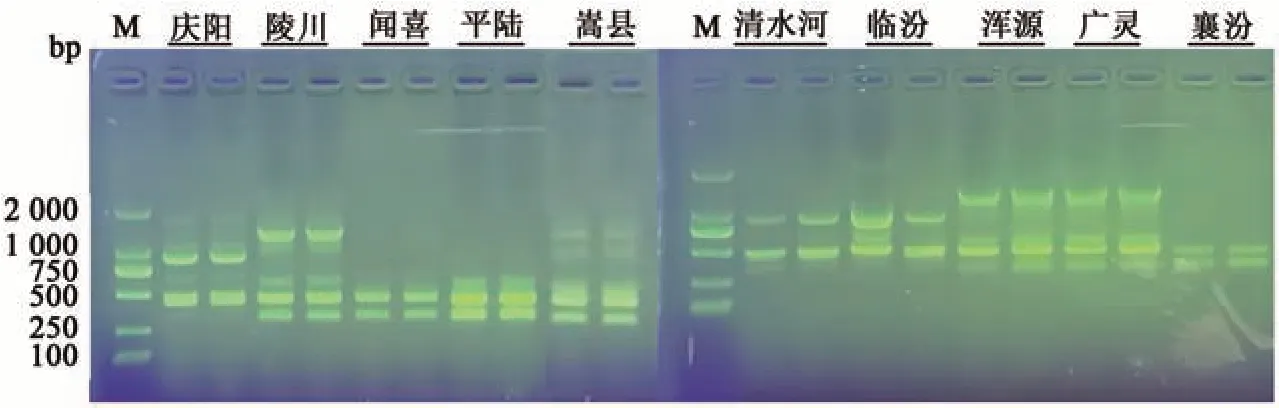
图4 10份北柴胡样品的ISSR-PCR扩增结果Fig. 4 ISSR-PCR amplification results of 10 B. chinense samples
2.3.2 北柴胡样品遗传相似性分析 由表4 可知,10 个北柴胡样品的遗传相似系数为0.142 8~1.000 0。其中,襄汾、浑源、广灵与庆阳柴胡之间的遗传相似系数最小为0.142 8,闻喜与平陆柴胡、清水河与临汾柴胡、陵川与嵩县柴胡、广灵与浑源柴胡之间的遗传相似系数最大为1.000 0,这表明10 个北柴胡样品种间存在着一定程度的遗传差异。从遗传相似系数可看出,庆阳柴胡与其他9 个产地柴胡的遗传相似系数均较小,表明其亲缘关系较远;而这9 个产地柴胡两两间存在着不同程度的遗传相似性,表明9 个北柴胡样品种间存在着一定程度的遗传差异。
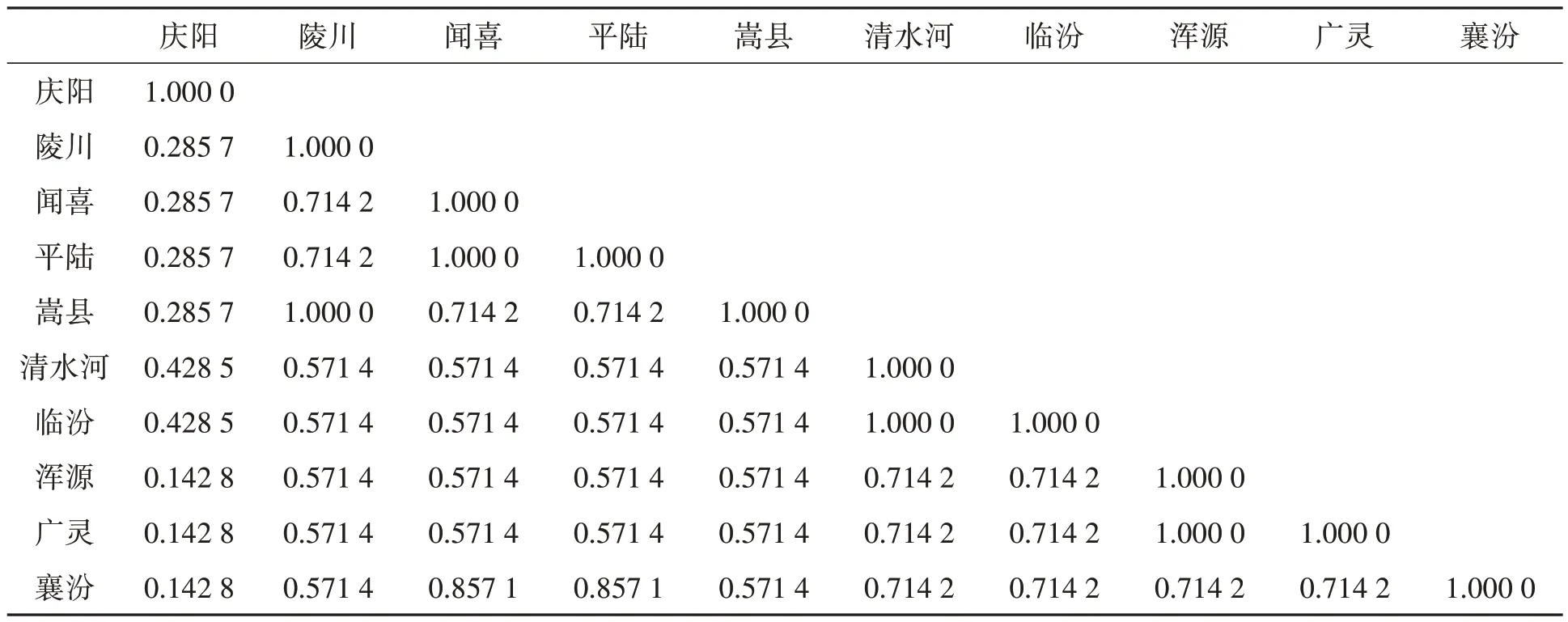
表4 10份北柴胡样品的遗传相似系数Table 4 Genetic similarity coefficients of 10 B. chinense samples
2.3.3 聚类分析 由图5 所示,相似系数为0.63时,可把10个北柴胡样品聚成3大类。第1类只有甘肃庆阳柴胡;第2 类包括5 个柴胡样品,分别为陵川、嵩县、闻喜、平陆、襄汾柴胡,均属于山西省南部居群及河南省居群,其中陵川与嵩县亲缘关系较近,闻喜与平陆亲缘关系较近;第3 类包括4 个柴胡样品,即为清水河、临汾、浑源、广灵柴胡,属于山西省北部居群及内蒙古居群。其中,浑源与广灵亲缘关系较近,临汾与清水河亲缘关系较近。
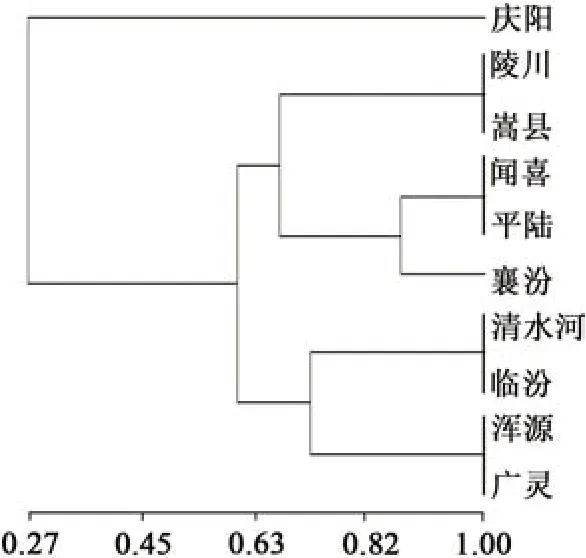
图5 北柴胡居群的遗传多样性聚类图Fig. 5 Clustering map of genetic diversity of B. chinense population
3 讨论
物种或居群的遗传多样性大小是长期进化的产物,也是其生存和发展的前提[11],居群间存在遗传多样性或遗传变异,一部分原因是由于环境因素的改变和土壤条件的恶化。遗传相似性系数或遗传距离是衡量居群间遗传分化程度的重要指标[12]。因此,对遗传多样性的研究一方面解释了物种的进化,另一方面也为寻找优良的种质资源提供理论依据。目前,用于中药材的分子标记技术很多,例如SCoT、ISSR、SSR、SNP等,其中ISSR技术有着多态性高、重复性好、操作简单、成本低廉等优点,且能够在样品基因组序列未知的情况下对样品间的遗传信息进行多样化分析,同时不受物种的限制,在香附、黄精、伊贝母、柴胡等重点中药材上已有相关应用[13-14]。此外,引物浓度也会影响实验结果,浓度过高可能导致非特异性产物扩增,产生错误引导或产生引物二聚体,过低可能降低PCR扩增效率[15]。因此,有必要围绕引物适宜的浓度进一步设置梯度浓度以探究实验的最优条件。
从聚类图中可以看出,第2类中5个北柴胡样品不仅仅局限于山西省南部居群,还有河南省嵩县北柴胡样品与其聚为一类,这可能是因为两地相邻,生境、光温水等条件较为一致,导致北柴胡间的遗传相似系数较近;第3 类中内蒙古清水河居群北柴胡未按照其地理位置独为一类,而是与山西北部居群聚为一类。这可能是山西北部地区由于受内蒙古冬季冷气团的袭击,气候较为寒冷,两地环境条件较为相似,自然选择压力一致导致的。因此,可以推断亲缘关系与地理位置的远近有着密切的联系。
李勇慧等[8]通过对我国北柴胡6个居群的11个样品进行遗传多样性分析,发现6 个居群北柴胡存在比较丰富的遗传变异,且与地理分布有一定相关性。马艳芝等[9]采用ISSR 标记和ITS 序列分析方法将11 份柴胡样品分成2 大类,其中大部分来源相同或相近的柴胡样品聚在一起。以上文献有关结论与本研究聚类分析结论基本一致。
随着北柴胡的经济价值与药用价值不断被开发,北柴胡的需求量逐日递增,越来越多的地方正在进行北柴胡的栽培,但产地之间的亲缘关系并不清楚。当前越来越多的中药材已经开始在分子层面上进行分析,足见分子技术对中药材研究的重要性。本研究从ISSR 分子标记技术获得的结果来看,不同柴胡种群间存在较为丰富的遗传多样性,原则上能够按照地理位置的远近加以分类,这对于柴胡遗传差异性的深入研究、种质评价和良种选育均有重要意义。未来,课题组将会在实验结果的基础之上深入研究北柴胡遗传多样性与化学成分、外观性状之间的关联。

