基于铁死亡作用机制探讨中医药干预脑缺血再灌注损伤*
姚慧芳,蔚懿,王璐,关运祥,钱仁义
1.河南中医药大学第一临床医学院,河南 郑州 450000; 2.河南中医药大学第一附属医院,河南 郑州 450000
脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是脑组织在缺血后恢复血流灌注时,神经元及细胞的坏死、凋亡反而加重,造成严重神经功能障碍,具有较高的致残率、致死率[1]。CIRI病理机制复杂,炎症反应、氧化应激、氨基酸兴奋毒性、神经细胞凋亡、钙超载、铁死亡等参与其发生发展过程。铁死亡是细胞内活性氧累积所诱导的一种新型细胞调节性死亡方式,以铁代谢紊乱、脂质活性氧堆积为基本特征[2]。铁死亡参与CIRI病理过程,抑制铁死亡有神经保护及抗氧化作用,可改善神经缺损。中医药具有多机制、多靶点、多层次的独特优势,治疗CIRI疗效显著。本文基于铁死亡作用机制,梳理中医药防治CIRI的研究现状,探讨中医药防治CIRI的新思路、新靶点,以期为CIRI的临床治疗提供参考。
1 现代医学对CIRI的认识
CIRI是卒中患者在恢复缺血区血液再灌注时造成的二次损伤,具有极高的致残率、病死率,严重影响卒中患者的生存质量及生存周期。CIRI生理病理机制复杂,非一种反应、一条通路可解释,是氧化应激、炎症反应、线粒体障碍、能量障碍、钙超载、氨基酸兴奋毒性、神经细胞凋亡、铁死亡等多种反应综合作用的结果。铁死亡是细胞内铁代谢紊乱及活性氧的产生与降解失衡所诱导的细胞死亡。一方面,铁代谢紊乱使细胞内活性氧升高,触发氧化应激反应及细胞死亡;另一方面,通过催化羟自由基形成来触发脂质过氧化反应及随即而来的铁死亡。铁死亡参与CIRI生理病理过程,抑制铁死亡有神经保护及抗氧化作用。
1.1 铁死亡及其作用机制概述铁死亡作为一种铁依赖性的,脂质活性氧堆积所引起的新型细胞调节性死亡方式,在生理及病理条件下均可见到,但两种状态所起作用不同,生理条件下多为一种适应,抑或是一种抑癌保护机制[3]。研究发现,胱氨酸/谷氨酸反向转运蛋白系统(cystine/glutamate antiporter system X-,system Xc-)/p53-GSH-GPXs、FSP1-CoQ10、GCH1-BH4-DHFR 3条调节轴在铁死亡发生发展中起着关键作用,其中system Xc-/转硫通路是system Xc-/p53-GSH-GPXs调节轴核心环节,甲羟戊酸(MVA)途径生成CoQ10是FSP1-CoQ10调节轴核心环节,3条调节轴均由NADPH介导[4],见图1。

图1 铁死亡作用机制
system Xc--GSH-GPX4是铁死亡作用机制核心环节,已成为共识。其中system Xc-是细胞抗氧化系统的重要组分,主要由SLA7A11、SLC3A2亚基组成,可促进细胞内外谷氨酸、胱氨酸运输与转化,进而形成GSH。谷胱甘肽过氧化物酶(GSH-Px)是机体内广泛存在的一种重要的过氧化物分解酶[5]。GPX4是一种硒蛋白,是GPX4酶系的阴性调控因子,可降解小分子过氧化物及某些脂质过氧化物,抑制脂质过氧化反应,减少活性氧累积,从而抑制铁死亡。GSH是GPXs的辅助因子,GSH表达下调会导致GPXs活性降低,减少铁死亡的发生。RSL3、DPI7、DP10、DPI2、DPI3是铁死亡诱导剂、GPX4的抑制剂,可降低GPX4活性,降低细胞降解脂质活性氧能力,从而导致铁死亡。
NAD(P)H/FSP1/CoQ10是一条平行于system Xc--GSH-GPX4的另一抗氧化系统[6]。FSP1是一种GSH非依赖性的去铁蛋白抑制剂,同时也是一种还原酶,可将CoQ还原为抗氧化剂CoQH2,直接减少脂质活性氧等自由基的生成。CoQ10是生物体内广泛存在的一类脂溶性抗氧化剂,可有效减轻氧自由基对细胞的损伤。
GCH1-BH4-DHFR是一条非依赖GPX4活性的铁死亡抑制机制[5],也是抗氧化系统的重要组成部分。GCH1是鸟苷三磷酸环水解酶,也是BH4合成的限速酶。BH4作为一种有效的自由基抗氧化剂,被DHFR氧化还原重复利用[5],从而抑制脂质氧化反应,增强细胞抗氧化能力,抑制铁死亡。除此之外,尚可通过铁代谢通路、线粒体通路等途径调节体内铁死亡。
1.2 铁死亡作用机制与CIRI
1.2.1 抑制system Xc-/p53-GSH-GPXs通路介导的铁死亡P53是一种抑癌基因,可下调SLA7A11的表达,抑制细胞对胱氨酸的摄取,减少GSH生成,降低GPX4活性,导致细胞抗氧化能力降低,对铁死亡敏感性增加[6]。RSL3、DPI7、DP10、DPI2、DPI3是铁死亡诱导剂、GPX4的抑制剂,可降低GPX4活性,降低细胞降解脂质活性氧能力,从而导致铁死亡。研究发现,抑制system Xc-/p53会减少GSH表达,降低GPXs活性,抑制铁死亡[7]。除此之外,RSL3、Erastin、铁螯合剂等铁抑制剂也可降低GPXs活性,减少铁死亡的发生。敲除GPX4的小鼠,体内脂质过氧化反应活跃,活性氧、MDA含量均明显增高,对铁死亡的敏感性也增加[8-9]。
1.2.2 抑制FSP1/CoQ10通路介导的铁死亡当system Xc-/p53-GSH-GPXs通路功能失调时,该通路可发挥补充保护机制,抑制铁死亡。Daghlas等[10]研究发现,FSP1抑制铁死亡的机制可能与促进转运ESCRT-Ⅲ(内体分选复合物)膜修复系统所需的CoQ10这一独立机制有关。在氧化应激状态下,FSP1被重新募集到质膜上,可促进CoQ10的生成以抑制脂质过氧化,减少自由基生成,从而抑制铁死亡发生[11]。
1.2.3 抑制GCH1-BH4-DHFR通路介导的铁死亡GCH1-BH4-DHFR作为非依赖GPX4活性的铁死亡抑制机制,可减轻氧化应激反应,从而减轻CIRI。Kraft等[12]发现,表BH4可促进CoQ10的合成发挥抗氧化作用,其机制可能与调节苯丙氨酸、酪氨酸间转化相关。研究发现,抑制GPX4活性、阻断DHFR表达在基因或药理学上均可抑制铁死亡[12]。
2 中医药基于铁死亡作用机制减轻CIRI
中医药具有多机制、多环节、多靶点的独特优势,在CIRI治疗方面有较好的疗效[13-14],中医药防治铁死亡可以减轻CIRI是该领域当前的研究热点之一。铁死亡3条重要的作用机制均是抗氧化系统的重要组成部分。中医药治疗CIRI通过抑制铁死亡减轻氧化应激、抑制铁代谢通路、减轻炎症反应等途径减轻CIRI。当前基于铁死亡理论及其作用机制研究多集中在中药活性成分,中药复方及其制剂、针灸方面的研究略显不足。故探讨中医药疗法与CIRI后铁死亡环节的内在有机联系,对中医药精准干预CIRI后铁死亡,减少神经功能的损伤大有裨益。
2.1 中药单药及活性成分对铁死亡机制的调节当前,基于铁死亡机制的中药研究以单味药的活性成分研究居多。铁死亡作用机制均与抗氧化系统密切相关,故抑制铁死亡、减轻氧化应激从而减轻 CIRI 是中医药干预铁死亡的研究热点。高薇等[15]研究证实,柴胡皂苷A、顺铂联用可抑制Nrf2/HO-1通路,上调Transferrin表达,维持细胞内Fe2+水平,降低GPX4、SLC7A11、SLC40A1表达水平及GSH水平,从而促进脂质氧化反应,诱导铁死亡。王洁等[16]发现,党参干预CIRI铁死亡主要作用靶点可能为AKT1、MAPK3、TNF、MAPK1、SRC等,其中萜类、黄酮类、甾醇类、生物碱类等4类化合物是党参作用于铁死亡的主要活性成分,两者均可通过减轻氧化应激及炎症反应来减轻神经细胞损伤。研究显示,冰片可上调SOD、NO表达,降低MDA水平,抑制氧自由基生成及脂质氧化反应,增强细胞抗氧化能力[17]。Zhou等[18]研究发现,丹参有效成分丹参酮ⅡA在脑缺血发生时可降低PI3K、AKT及Nrf2表达,提高SLC7A11、GPX4水平抑制铁死亡,减轻氧化应激。有研究表明,白藜芦醇可降低胞内Fe2+水平,上调GPX4、xCT的表达,提高GSH水平,从而提高抗氧化应激能力,抑制铁死亡产生,减轻病理损害,改善神经功能障碍,产生神经保护作用[19]。中药单药及活性成分参与铁死亡的作用机制[16-18,20-36]见表1。
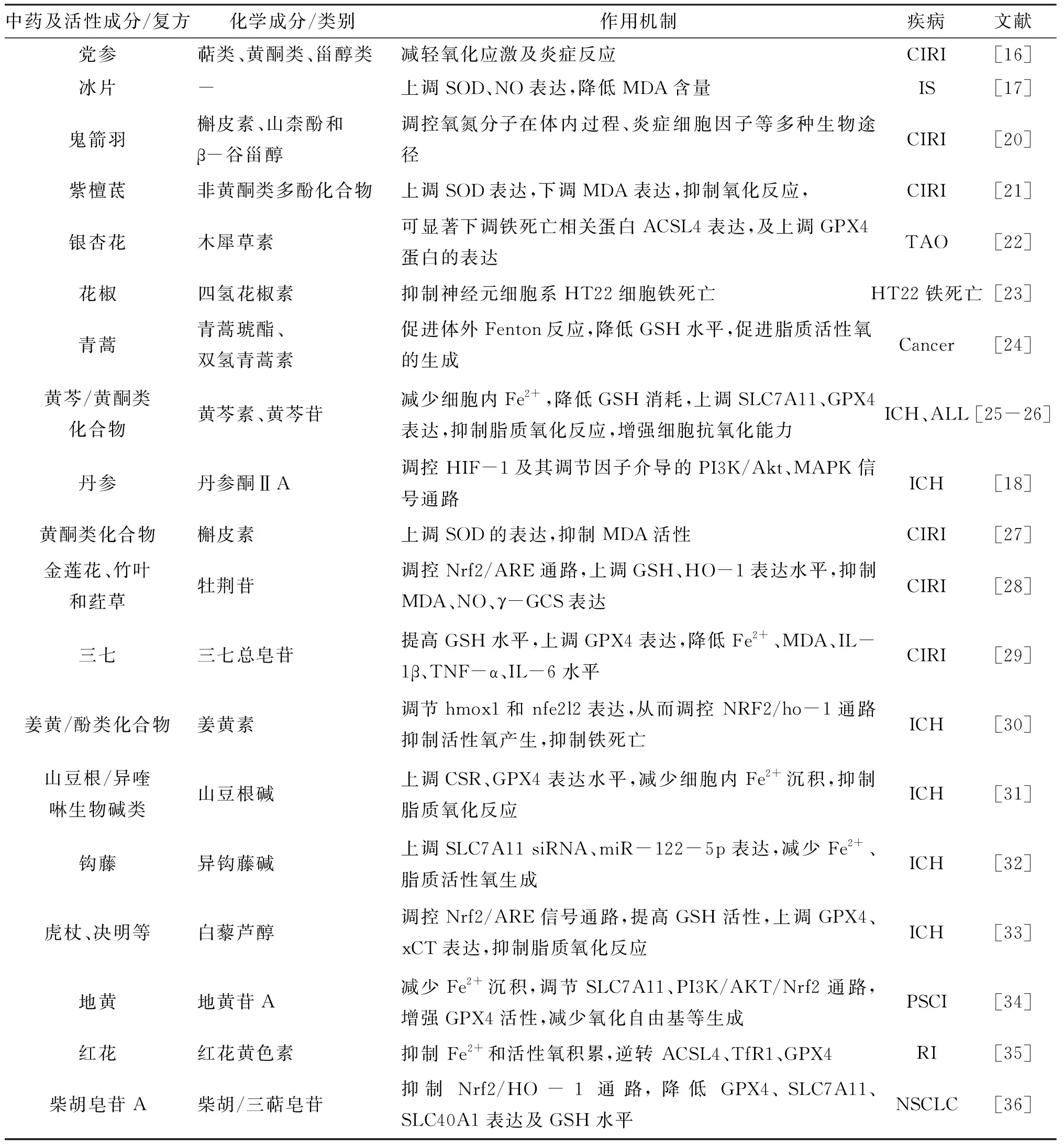
表1 中药单药及活性成分参与铁死亡作用机制
2.2 中药复方及其制剂对铁死亡机制的调节中药复方是在精准辨证的基础上针对患者情况确立的方剂,一般多由两味或两味以上药物组成,是中药汤剂的主要组成部分。相对于中药单药,中药复方多靶点、多机制的优势更加明显,更适应临床需要。赵冯岩等[37]基于网络药理学探讨补阳还五汤干预脑缺血铁死亡机制,研究结果显示可能与调控MAPK、PI3K-Akt、Ras等信号通路及HSP90AA1、EGFR、GRB2等3个关键靶点相关。其中HSP90AA1靶点以及PI3K-Akt信号通路可能为抑制铁死亡关键机制;且补阳还五汤调控铁死亡的关键靶点的成分多来源于黄芪、红花、桃仁、赤芍等4味药。研究表明,脑泰方可抑制铁死亡,作用机制为调控HSF1/HSPB1信号通路,上调HSF1、HSPB1、FTH1表达,下调TFR1蛋白表达,降低细胞内Fe2+、MDA、活性氧水平,从而抑制铁超载触发的Fenton反应及脂质氧化反应,减轻神经功能损伤[38]。周玉嘉[39]发现,冠心宁可通过调控PPAR信号通路抑制MDA、活性氧的表达,增加SOD水平,改善氧化应激,减轻细胞损伤。中药复方及制剂参与铁死亡作用机制[37-47]见表2。

表2 中药复方及制剂参与铁死亡作用机制
2.3 针灸对铁死亡机制的调节针灸作为中医传统疗法,具有多机制、安全性高、不良反应少、价廉等优势,在干预神经功能缺损方面疗效显著。李明月等[48]研究发现,“百会”透“曲鬓”针刺法可减轻线粒体形态改变,上调神经元特异性核蛋白(NeuN)的表达水平,下调MDA表达,抑制铁死亡促进神经功能修复。Li等[49]研究发现,针刺通过调节p62/Keap1/Nrf2抗氧化途径,上调GPX4、FTH1表达,减少MDA、Fe2+表达,抑制Fenton及随后的脂质氧化反应,抑制铁死亡。有学者在整理归纳近些年针刺干预CIRI机理研究中发现,其抑制铁死亡的机制可能与调控Nrf2/HO-1通路,减少MDA、活性氧等氧自由基拮抗氧化反应相关[50]。彭传玉等[51]研究发现,艾灸可上调大鼠SLC7A11、GSH、GPX4表达水平,下调p53、活性氧表达水平,抑制铁死亡发生,提示艾灸可能为抑制铁死亡的有效途径之一,见表3。

表3 针灸干预铁死亡作用机制
3 讨论
铁死亡参与CIRI病理过程,抑制铁死亡可减轻氧化应激,起到神经保护作用。system Xc-/p53-GSH-GPXs、FSP1-CoQ10、GCH1-BH4-DHFR 3条调节轴是铁死亡作用机制的核心环节,且均为抗氧化系统的组成部分。中医药具有多机制、多环节、多靶点的特点,其抑制铁死亡、减轻氧化应激的作用是当前研究热点。
P53作为抑癌基因,可下调SLA7A11、GSH表达,降低GPX4活性,导致细胞抗氧化能力降低,对铁死亡敏感性增加,因此,诱导铁死亡能够提高杀伤癌细胞的功效。本文初步归纳总结了中医药调节铁死亡机制相关文献,发现当前中医药干预铁死亡及其作用机制研究以单药成分研究居多,中药复方及其制剂相对较少,且多集中在抑制铁死亡减轻氧化应激方面。因此,基于铁死亡作用机制,探究铁死亡的“双重作用”,充分发挥中医药多层次、多机制、多靶点的优势,具有广阔的临床前景。

