阿那曲唑与他莫昔芬在乳腺癌治疗中的应用的效果对比
游 强
(大冶市人民医院,湖北 黄石 435100)
乳腺癌是好发于女性的恶性肿瘤,易发生转移以及局部复发,预后较差,对患者的健康和生命均构成不同程度的威胁[1]。有研究显示,所有恶性肿瘤中,乳腺癌的发病率在7%~10%,是仅次于宫颈癌的第二大恶性肿瘤,以40~60岁的女性发为好发人群,随着生活压力的增加和习惯的改变,发病患者逐渐年轻化[2]。乳腺癌发病后需进行及时的治疗以控制疾病发展和转移,改善患者预后。临床对于乳腺癌的治疗在手术、放化疗治疗的同时,对于雌激素受体(ER)阳性患者可进行内分泌治疗。通过内分泌治疗调节内分泌功能,减少或者抑制雌激素分泌,起到对乳腺癌的治疗作用。他莫昔芬属于雌二醇竞争性拮抗剂,使用后能与乳腺细胞中的雌激素受体结合,对于雌激素受体阳性患者的疗效更加显著,能控制疾病发展,促进肿瘤细胞凋亡,但是有导致子宫内膜癌发生的可能[3]。阿那曲唑为芳香化酶抑制剂,为强效非甾体类药物,能够有效降低体内雌激素水平,降低乳腺癌复发以及患者死亡的风险。本次,将对阿那曲唑与他莫昔芬在乳腺癌治疗中的应用的效果进行对比和探究,具体如下。
1 资料与方法
1.1 一般资料
选择我院2020年—2022年收治的80例乳腺癌患者作为本次研究对象,采用计算机法将患者以(0.001~0.080)进行随机编号,设0.040及以下(0.001~0.040)为对照组,设0.041及以上(0.041~0.080)为观察组,各40例。对照组年龄37~62岁,平均年龄(53.54±3.71)岁,髓样癌7例,浸润型导管癌27例,其他6例;观察组年龄37~65岁,平均年龄(54.13±3.75)岁,髓样癌6例,浸润型导管癌28例,其他6例;经过患者一般资料对比无统计学差异(P>0.05)。研究通过本院医学伦理委员会审批通过。
1.1.1 纳入标准
(1)符合《乳腺癌诊疗指南(2022年版)》[4]中对乳腺癌的诊断标准;(2)经过病理学检查确诊;(3)符合内分泌治疗指征;(4)具有沟通能力;(5)患者及家属对研究知情同意。
1.1.2 排除标准
(1)合并严重的糖尿病、高血压;(2)合并其他恶性肿瘤;(3)肝、肾等脏器器质性病变;(4)1个月内使用过雌激素;(5)对研究药物不耐受;(6)依从性差无法参与有研究。
1.2 方法
对照组他莫昔芬治疗:枸橼酸他莫昔芬片(生产厂家:扬子江药业集团有限公司;国药准字H32021472;规格:10mg)口服,10mg,2次/日(早晚各一次),治疗6个月为1个周期。
观察组阿那曲唑治疗:阿那曲唑片(生产厂家:浙江海正药业股份有限公司;国药准字号H20133110;规格:1mg)口服,1mg,1次/日,治疗6个月为1个周期。
1.3 观察指标
血清肿瘤标志物、雌二醇水平、临床疗效以及不良反应的发生率。
1.4 评判标准
1.4.1 血清肿瘤标志物
患者入院时和治疗后抽取静脉血,测量患者血清标志物水平,包括CA153、CA125以及CEA并进行两组对比。CEA正常值为0~5.0ng/mL,CA125正常值为0~35U/mL,CA153正常值为0~25U/mL。
1.4.2 雌二醇水平
测定患者入院时、治疗1个月后、治疗3个月后以及治疗6个月后的血清雌二醇(E2)水平进行两组对比。E2正常值为50~200pg/mL。
1.4.3 临床疗效
以实体肿瘤疗效的评价为判定标准,于治疗结束后进行评价,完全缓解为影像学检查下肿瘤全部消失;部分缓解为影像学检查下肿瘤部分消失在50%及以上;病情稳定为影像学检查下肿瘤缩小不足50%,但是在25%以上;疾病进展为影像学检查下肿瘤体积增加25%及以上且有新病灶出现;疾病控制率=(完全缓解+部分缓解+病情稳定)/总例数×100%。
1.4.4 不良反应
记录患者经过治疗后便秘、恶心、血小板减少、白细胞降低、粒细胞减少以及肝肾功能不全等并发症的发生率。
1.5 统计学分析

2 结果
2.1 血清肿瘤标志物水平对比
治疗前,两组血清糖类抗原-153(CA153)、125(CA125)、癌胚抗原(CEA)对比无统计学差异(P>0.05),治疗后,两组CA153、CA125、CEA均低于治疗前,观察组低于对照组(P<0.05),见表1。

表1 血清肿瘤标志物水平对比
2.2 E2水平对比
治疗前,两组E2水平对比(P>0.05),治疗1、3、6个月后,观察组E2水平低于治疗前,对照组E2水平高于治疗前,观察组低于对照组(P<0.05),见表2。
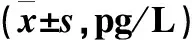
表2 E2水平对比
2.3 临床疗效对比
观察组患者的疾病控制率高于对照组(P<0.05),见表3。
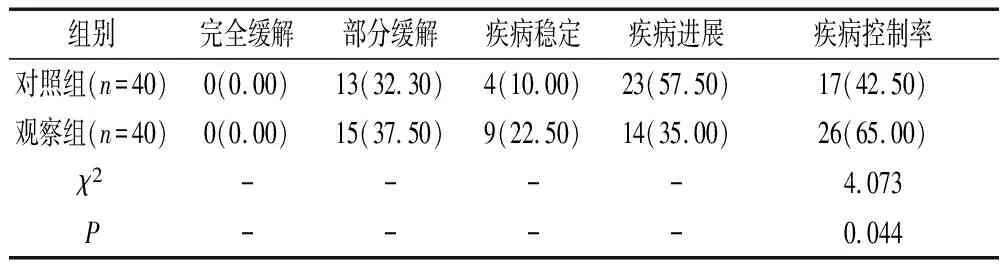
表3 临床疗效对比[n(%)]
2.4 不良反应对比
治疗期间,观察组便秘、恶心等不良反应的发生率低于对照组(P<0.05),见表4。

表4 不良反应对比[n(%)]
3 讨论
乳腺癌的发病率占恶性肿瘤的7%~10%,临床认为乳腺癌的发病与遗传以及情绪因素相关[5]。随着生活压力的增加和习惯的改变,乳腺癌的发病率逐渐增加且呈年轻化。由于该病易发生转移以及复发,所以需要进行及时的治疗,以控制疾病的发展。临床对于乳腺癌的治疗方式包括手术、放疗、化疗以及内分泌治疗等,ER与雌激素发生特异性结合,对系列基因产生刺激,能够促进细胞生长导致肿瘤转移[5]。所以,乳腺癌ER阳性表达患者需要进行内分泌治疗以控制雌激素水平升高,提升治疗效果。
他莫昔芬属于非甾体类抗雌激素药物的一种,是乳腺癌内分泌治疗的常用药,通过与ER竞争性结合,阻断雌激素与E2结合并产生相互作用,从而抑制癌细胞的生长和转移。相关研究显示,乳腺癌患者通过内分泌治疗在预防癌症转移的同时能够降低疾病复发的风险。但是刘凯[6]在研究中发现,乳腺癌患者使用他莫昔芬治疗后会增加雌二醇水平,增加子宫内膜患病风险,影响治疗效果。
阿那曲唑具有抑制芳香化酶的作用,属于强效非甾体类药物,能够抑制雌激转化,有效降低机体雌激素水平,抑制癌细胞的生长和转移,用于辅助内分泌治疗,具有显著的效果[7]。有研究称,阿那曲唑进入机体后,选择性更高,不会影响甲状腺正常功能,同时不会对糖皮质激素以及肾上腺皮质类固醇激素起到刺激和抑制的作用,治疗效果理想,具有较高的安全性[8]。本次研究结果显示,乳腺癌患者在接受阿那曲唑治疗后,对于疾病的控制率高于接受他莫昔芬治疗的患者。这说明,阿那曲唑在 ER 阳性表达的乳腺癌患者治疗中有显著优势。
CEA作为广谱性肿瘤标志物的一种,在多种肿瘤中均有表达,能够直观的反应肿瘤的淋巴转移和浸润程度,在肿瘤的发生和发展中起到重要作用。CA125为卵巢癌的特异性指标,能够对乳腺癌是否发生卵巢转移进行诊断和预测。CA153为乳腺癌的特异性指标,是诊断乳腺癌最重要的标志物,能够对乳腺癌的预后进行反应。本次研究结果显示,经过治疗后,两组血清CEA、CA153、CA153的水平均有降低,观察组低于对照组(P﹤0.05)。这说明,阿那曲唑使用后能降低肿瘤标志物水平,对肿瘤标志物的表达起到抑制作用,且效果好于他莫昔芬。
有研究显示,导致乳腺癌发生的独立危险因素为雌激素,对于肿瘤细胞的增殖、分化起到调控作用。E2具有促进乳腺癌生长的作用,通过对小丘脑进行负反馈调节,抑制促性腺激素释放激素,使性激素的表达受到影响。本研究显示,使用阿那曲唑治疗后1、3以及6个月后,患者的血清 E2水平有所降低,而均他莫昔芬治疗后的E2水平有所升高,这说明,阿那曲唑为具有强效选择性非甾体类药物,对于芳香化酶起到抑制作用,阻断雌激素合成,降低雄烯二酮、睾丸酮向E1、E2转化,从而降低体内雌激素水平,进一步抑制肿瘤增殖。
总之,使用阿那曲唑在乳腺癌治疗中的应用能够降低患者肿瘤标志物和E2水平提升治疗的有效率,不良反应的发生率较低,具有较高的安全性。

