多西环素联合甲硝唑干预对LPS诱导的大鼠子宫内膜炎Th1/Th2的影响
姚 祺,林东梅,林臻影,杨燕燕,庄跃宏
(1.福州市第二医院,福建 福州 350007;2.福建中医药大学动物实验中心,福建 福州 350007;3.福建医科大学基础医学院,福建 福州 350007)
子宫内膜炎作为一种慢性炎症,长期反复感染可能导致子宫内膜细胞的免疫平衡失调,从而影响胚胎着床[1-2]。临床研究表明,子宫内膜炎患者存在Th1/Th2免疫偏向,即免疫应答偏向于炎症反应,而抑制胚胎植入所需的免疫耐受性反应[3-5]。目前,临床上治疗子宫内膜炎的主要方法是经验性抗生素治疗。多西环素联合甲硝唑联合用药已成为一线治疗方案,环丙沙星也被广泛采用[6-7]。许多临床研究显示,口服抗生素可以改善妊娠结局,但其具体机制仍不完全清楚[8]。Th细胞能够分泌不同炎症因子,介导细胞免疫应答,子宫内膜炎进展中,炎症导致大量细胞因子,如肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α),细胞介素-2(Interleukin-2,IL-2)、白细胞介素-4(Interleukin-4,IL-4)、白细胞介素-6(Interleukin-6,IL-6)等产生[9-10]。而在药物长期治疗中,由于耐药性等因素导致患者病情反复发作,为促进子宫内膜炎疾病治疗的效果,因此,本研究于2022年6月至2022年12月选取50只无特定病原体(Specific Pathogen Free,SPF)级实验大鼠成功孕育的SD雌性大鼠,饲养在福建中医药大学动物实验中心,探讨应用多西环素联合甲硝唑用药观察联合用药对慢性子宫内膜炎(Chronicendometritis,CE)大鼠的Th1/Th2作用机制及效果,为慢性子宫内膜炎治疗提供建议。
1 资料与方法
1.1 试验动物造模及分组
研究时间:2022年6月至2022年12月。选取50只SPF级实验大鼠成功孕育的SD雌性大鼠,饲养在动物实验中心,根据随机数字表法分为包括空白组、大鼠子宫内膜炎(CE)模型组、多西环素干预组、甲硝唑干预组及联合用药组,每组含10只大鼠,实验动物均在相同时间段出生,体重控制在(220±20)g,以符合实验相关标准。实验室温度被保持在18℃~26℃,相对湿度维持在45%~70%,光照强度在200~350照度,每天有12h的光照和12h的暗周期,且维持通风环境。实验过程中动物自由饮水摄食,喂养饲料相同,饲鼠所用饲料和垫料均由实验动物中心提供。SPF级实验大鼠在适应性喂养一周后,空白组大鼠不接受任何干预处理,其余4组大鼠经适量麻醉药剂麻醉松弛,将麻醉后大鼠倒提,向子宫内推注脂多糖(LSP),2.5~5 mL·kg-1的LSP,灌注12~24h后,建立大鼠CE模型,后连续灌胃给药14d,同时模型组灌服生理盐水90 mg·(kg·d)-1,多西环素干预组加以30 mg·(kg·d)-1灌胃多西环素片,甲硝唑干预组加以20 mg·(kg·d)-1灌胃甲硝唑,联合用药组灌胃多西环素30 mg·(kg·d)-1+甲硝唑20 mg·(kg·d)-1。本研究内容经本院伦理学委员会审阅同意开展本次研究。
1.2 取材、切片方法
不同干预组末次给药2h后,取出大鼠称取体重,后处死大鼠,麻醉后取腹主动脉血并分离血清,置于-80℃冰箱备用;解剖分离并称取子宫部位及附件等脏器重量,置于-80℃冰箱备用;部分组织固定,制作苏木精-伊红法(HE)染色切片。
1.3 RNA的提取、逆转录及实时荧光 PCR法
提取大鼠子宫组织RNA,于-80℃冰箱取出子宫组织,在电子天平上称取约200mg,加入 800μL RNAiso Plus Total RNA 提取试剂,提取组织中总 RNA,One drop 仪器测定总 RNA 浓度,取 2.50 μg总RNA作为模板反转为 cDNA。同时按10μL实时荧光定量 PCR反应体系,反应条件为95 ℃,变性5min;95 ℃,10 s,60 ℃,30 s,72 ℃,30 s,共40个循环;溶解曲线条件为95 ℃,15 s,65 ℃,15 s,95 ℃,continues。同时根据溶解曲线判断PCR产物纯度,分析mRNA相对表达量。引物序列如表1。
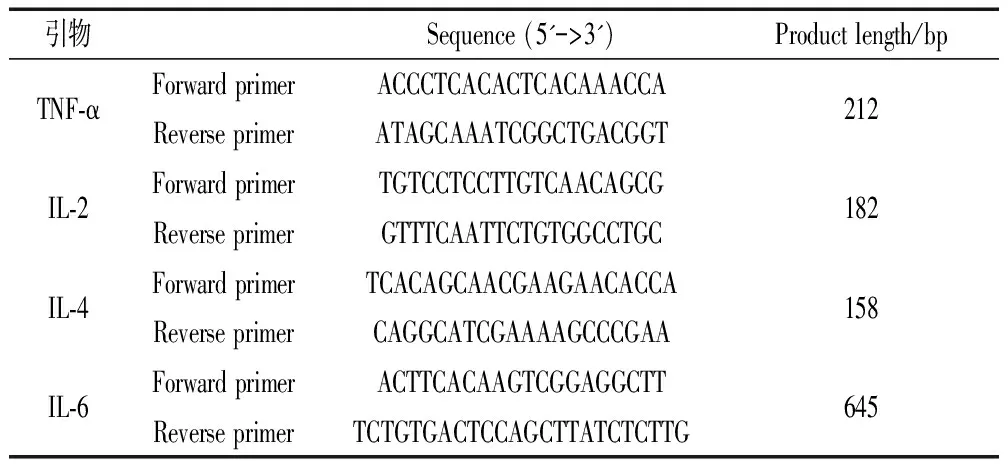
表1 不同炎症因子qRT-PCR引物序列
1.4 观察指标
(1) 观察不同分组大鼠子宫组织形态、子宫指数及病理改变。(2)取腹主动脉血通过酶联免疫吸附试验(ELISA)检测肿瘤坏死因子-α(TNF-α),白细胞介素2/4/6水平,同时通过全自动流式细胞仪检测Th1细胞亚群分泌TNF-α和IL-2,Th2细胞亚群分泌IL-4和IL-6,并计算Th1/Th2。(3) 实时定量RT-PCR检测子宫组织TNF-α、IL-2、IL-4、IL-6表达水平。
1.5 统计学方法

2 结果
2.1 不同子宫内膜炎模型组子宫组织病理学变化情况
不同组大鼠子宫组织病理学变化如图1所示,模型组较空白组大鼠子宫宫腔出现粘连不全现象,子宫内膜水肿、血管充血,有炎症浸润表现,多西环素、甲硝唑单一干预下宫腔粘连、水肿、充血有所改善,内膜损伤较轻,联合组干预下宫腔无粘连,水肿、充血改善显著,无明显内膜损伤情况。
2.2 不同子宫内膜炎模型组Th1/Th2比较
不同大鼠子宫内膜炎模型组Th1、Th2、Th1/Th2水平具有统计学差异,P<0.05,多西环素组、甲硝唑组及联合用药组Th1/Th2水平较模型组下降(P<0.05),且联合用药组较多西环素、甲硝唑单一用药改善更显著(P<0.05),差异具有统计学意义。结果见表2。
表2 不同大鼠子宫内膜炎干预模型的炎症因子比较
2.3 不同子宫内膜炎模型组TNF-α、IL-2、IL-4、IL-6 mRNA表达情况
与空白组比较,子宫内膜炎模型组TNF-α、IL-4、IL-6mRNA水平降低(P<0.05),IL-2mRNA水平升高(P<0.05);与模型组相比,联合用药组TNF-α、IL-4、IL-6mRNA水平显著降低(P<0.05),IL-2mRNA水平显著升高(P<0.05),差异具有统计学意义。结果见图2。
3 讨论
近年慢性子宫内膜炎的发病率逐渐上升,给育龄妇女的身体健康和生育健康带来了严重挑战。子宫内膜炎的发病机制涉及多个因素,其中免疫失衡是一个重要的方面[11]。在子宫内膜炎的炎症环境中,Th1细胞和Th2细胞的免疫应答出现偏向失衡,调节Th1/Th2细胞的免疫平衡,也成为治疗子宫内膜炎的重要策略之一[12-14]。为了深入研究子宫内膜炎治疗,本研究选择了LPS诱导的大鼠子宫内膜炎模型,探索多西环素与甲硝唑联合用药干预下大鼠子宫组织炎症因子表达及治疗效果。
本研究中,炎症因子的水平也在不同组间呈现差异。既往的研究表明,该联合干预方案能够显著改善子宫内膜炎模型大鼠的症状和炎症反应[15]。实验结果表明,经联合用药处理后,大鼠子宫内膜的水肿、血管充血和炎症浸润现象均呈明显减轻。同时本研究结果在姚琪[6]等人研究中也有证明,多西环素联合甲硝唑用药下明显缓解子宫内膜损伤、坏死、细胞浸润等,改善子宫内膜组织受损。研究表明TNF-α、IL-2/4/6等作为重要的炎症细胞因子,能够触发炎症细胞级联反应从而激活或扩大炎症反应[16-18]。Th细胞作为调控免疫应答的关键细胞,正常条件下Th1/Th2处于平衡状态,研究模型组大鼠Th1/Th2明显失衡,CD4+T细胞过度活化,导致炎症反应的持续性和加重,进而可能加速大鼠CE的进展,多西环素、甲硝唑及联合用药组Th1/Th2失衡得到一定控制,同时联合组Th1/Th2失衡改善更明显,也提示联合用药有抑制CD4+T细胞增殖能力,引导Th2分化。而在不同造模组大鼠子宫组织中促炎细胞因子mRNA的检测中,联合组用药对TNF-α、IL-2/4/6表达水平有显著影响,减轻了子宫组织炎性反应。同时提示多西环素及甲硝唑联用可能通过调节免疫失衡和抑制炎症反应,影响免疫应答,发挥对子宫内膜炎的保护作用,可能是治疗子宫内膜炎的作用机制之一。然而,本研究存在一定的局限性,研究尚需要临床治疗验证,同时对于多西环素联合甲硝唑治疗子宫内膜炎的确切机制还需进一步深入研究,包括分子水平和细胞水平的机制分析等。
综上所述,本研究表明多西环素联合甲硝唑干预能够改善子宫内膜炎模型大鼠的症状和炎症反应,可能通过调节炎症因子的水平来影响免疫应答。同时研究需进一步探究作用机制,以期为子宫内膜炎的治疗提供更加科学和有效的策略和方法。

