离子液体中Mn(III)Salen催化烯烃环氧化反应选择性合成烯烃环氧化物
时园 SHI Yuan
(常州大学,常州 213164)
0 引言
工业活动中排放的挥发性有机物(VOC)主要来自于生产制造环节使用的易挥发性有机溶剂。在绿色发展背景下,使用低毒、环保溶剂代替有机溶剂成为从源头上降低挥发性有机物排放的有效策略。离子液体具有无毒、无挥发、导电性好、溶解性强、可循环利用等特点,可以作为有机溶剂的一种理想替代品。在离子液体中加入Mn(III)Salen催化剂选择性合成烯烃环氧化物,能够促进烯烃环氧化反应的进行,对加快反应速率、提高产物质量有积极效果。其中,离子液体成分的不同,以及Mn(III)Salen催化剂类型的不同,都会对反应过程和反应结果带来差异化影响,优化离子液体中Mn(III)Salen催化烯烃环氧化反应条件对实现绿色优质生产有积极帮助。
1 不同Mn(III)Salen催化剂对苯乙烯环氧化反应的催化效果
1.1 实验方法
本实验探究了3种不同类型Mn(III)Salen催化剂对苯乙烯环氧化反应的催化效果,催化剂的制备方法如下:选择3个容量为250ml的三颈烧瓶,分别加入10mmol的环己二胺、领苯二胺、乙二胺,其余操作一致。用量筒量取75ml的无水乙醇并加入到三颈烧瓶中,将20mmol水杨醛溶于30ml无水乙醇中作为回流液,加热至100℃后进行密封回流,回流时间为2.5h,然后自然冷却至50℃。将玻璃导管一端插入三颈烧瓶底部,另一端通过橡胶导管与气泵出口相连,由气泵通入氮气,在氮气保护下向三颈烧瓶内加入带醋酸锰的乙醇溶液(10mmol醋酸锰溶于20ml无水乙醇)。按照同样的方法继续回流2.5h,自然冷却至50℃后,用量筒分别量取10mmol的氯化锂溶液和20ml的无水乙醇,将两者充分混合后加入到三颈烧瓶中,在接触空气的情况下用玻璃棒搅拌,使液体混合均匀后放置24h后,进行过滤并将固体物烘干,即可得到3种类型的Mn(III)Salen固体[1]。将乙二胺与水杨醛制备的Mn(III)Salen表示为A,环己二胺与水杨醛制备的Mn(III)Salen表示为B,领苯二胺与水杨醛制备的Mn(III)Salen表示为C。
选取次碘酸苯(PhIO)为氧化剂,以苯乙烯和次碘酸苯的环氧化为探针反应,以1-丁基-3-甲基咪唑六氟磷酸盐(BmimPF6)为离子液体,探究3种Mn(III)Salen催化剂在有机溶剂和混合溶剂下对环氧化反应的催化效果[2]。其中,有机溶剂为CH2Cl2,混合溶剂为BmimPF6与CH2Cl2的混合物。氧化剂PhIO的制作方法为:将9g氢氧化钠粉末溶于75ml纯水中,充分搅拌至无固体残留,得到氢氧化钠溶液,装入烧杯中。使用精密天平称取16.1g的二乙酸碘苯,同样加入到烧杯中,静置30min后反应完成,可以发现絮状物逐渐结成块状。过滤后保留块状固体,将其投入到盛有50ml氯仿的烧杯中进行纯化处理,15min后再次过滤,所得产物即是具有强氧化性的PhIO,可作为氧化剂使用[3]。
1.2 实验结果
3种Mn(III)Salen催化剂在有机溶剂和混合溶剂下对环氧化反应的催化结果见表1。
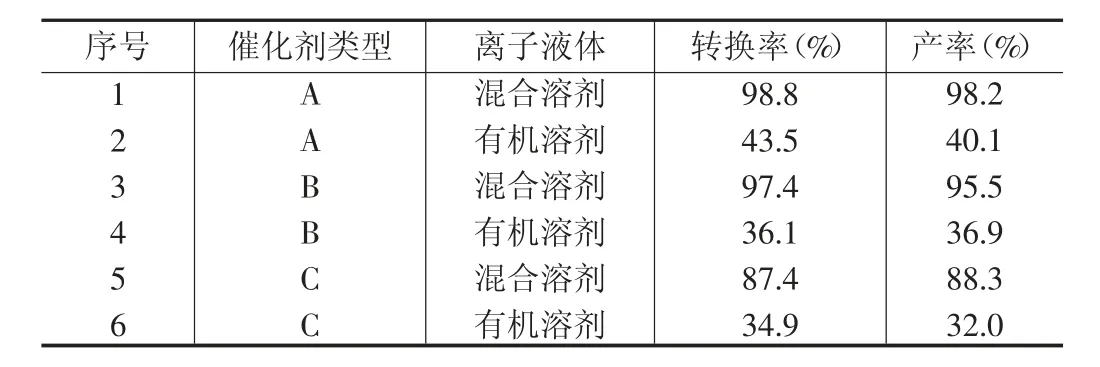
表1 催化效果表
由表1数据可知,选择不同类型的催化剂,对苯乙烯的转化率和环氧化物的产率有较为明显的影响。横向对比来看,使用乙二胺和水杨醛制作的Mn(III)Salen催化剂(A型)时,苯乙烯的转化率最高,达到了98.8%。分析其原因,Mn(III)Salen催化环氧化反应的机理是利用活性中间体“氧和Mn(IV)Salen”络合物来进行的,该中间体的化学结构如图1所示。
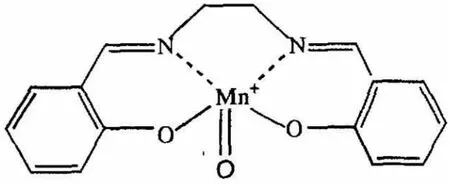
图1 活性中间体的化学结构
由图1可知,该物质为8面体结构,其中Mn原子正好处于Salen平面上方,与周围的3个氧原子组合构成了相对稳定的Mn=O键。当进行烯烃环氧化反应时,烯烃会从Mn=O键的侧面、与Salen平行的方向碰撞Mn=O键。这种情况下位于Salen平面上的不同取代基会影响两者的融合效果,进而决定了催化剂的催化性能[4]。横向对比来看,在本次实验选用的3种Mn(III)Salen催化剂中,A型催化剂的融合效果最好,相应的催化活性最高。
在离子液体方面,当选择由BmimPF6与CH2Cl2组成的混合溶剂时,苯乙烯的转化率以及环氧化物的产率相对较高。以B型催化剂为例,如果只使用CH2Cl2溶剂,苯乙烯的转化率仅为36.1%,产率仅有36.9%。如果选用混合溶剂,苯乙烯的转化率达到了97.4%,产率也上升为95.5%。由此可见,BmimPF6是一种更加有效的环氧化反应介质。
2 离子液体中BmimPF6比例对环氧化反应的影响
2.1 实验方法
通过上文分析可知,由BmimPF6与CH2Cl2组成的离子液体对环氧化反应产生了显著影响。为了进一步探究两种成分的最佳比例,在实验中将离子液体的总体积固定为5.0ml,然后改变BmimPF6与CH2Cl2的比例,探究在不同体积比下的环氧化反应情况。环氧化产率越高,说明该比例下的离子液体性能越好。实验中设计了9种情况,具体比例见表2。

表2 离子液体中BmimPF6与CH2Cl2的比例设计
2.2 实验结果
离子液体中CH2Cl2与BmimPF6在各体积比下的环氧化物产率变化趋势如图2所示。
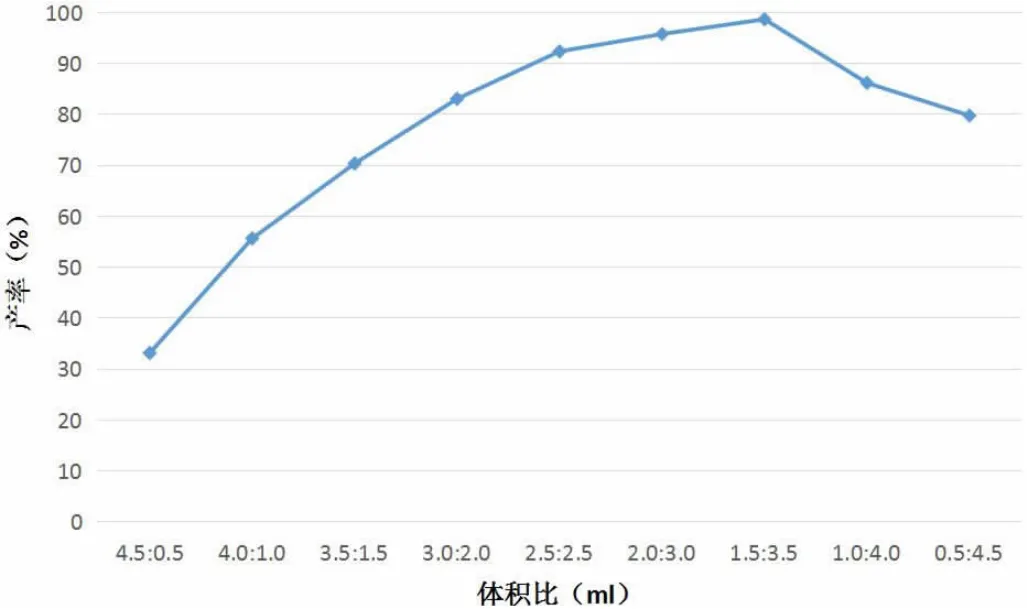
图2 不同体积比下环氧化物产量变化趋势图
根据图2可知,随着CH2Cl2与BmimPF6的体积比由大到小,环氧化物的产率呈现出先升高后降低的变化趋势。其中,在5.0ml离子液体中,CH2Cl2的体积为1.5ml、BmimPF6的体积为3.5ml时,环氧化物的产率最高,达到了98.9%。由此可知,在离子液体中Mn(III)Salen催化烯烃环氧化反应选择性合成烯烃环氧化物中,按照CH2Cl2与BmimPF6体积比为1.5ml:3.5ml的比例制备离子液体,能够使环氧化物的产率最高。
3 反应温度对环氧化物产率的影响
3.1 实验方法
温度是影响催化剂活性的一项重要因素,不同类型的催化剂有最适宜的温度区间,在该区间内催化剂的活性最佳,对环氧化反应的影响更为显著;相反,如果实际反应温度超出温度区间的上限,或者是低于温度区间的下限,都会导致催化剂的活性降低,从而影响环氧化物的产率[5]。为了确定更适合Mn(III)Salen催化剂的温度,设计了如下实验:以苯乙烯为反应底物,使用Mn(III)Salen作为催化剂,使用0.45mmol PhIO作为氧化剂。选取0.5mmol的苯乙烯和2.5ml的离子液体(CH2Cl2与BmimPF6体积比为1.5ml:3.5ml),分别在275K、300K进行环氧化反应,观察不同温度下环氧化反应的转化率与选择性。
3.2 实验结果
两种温度下苯乙烯环氧化反应的情况对比如图3、图4所示。
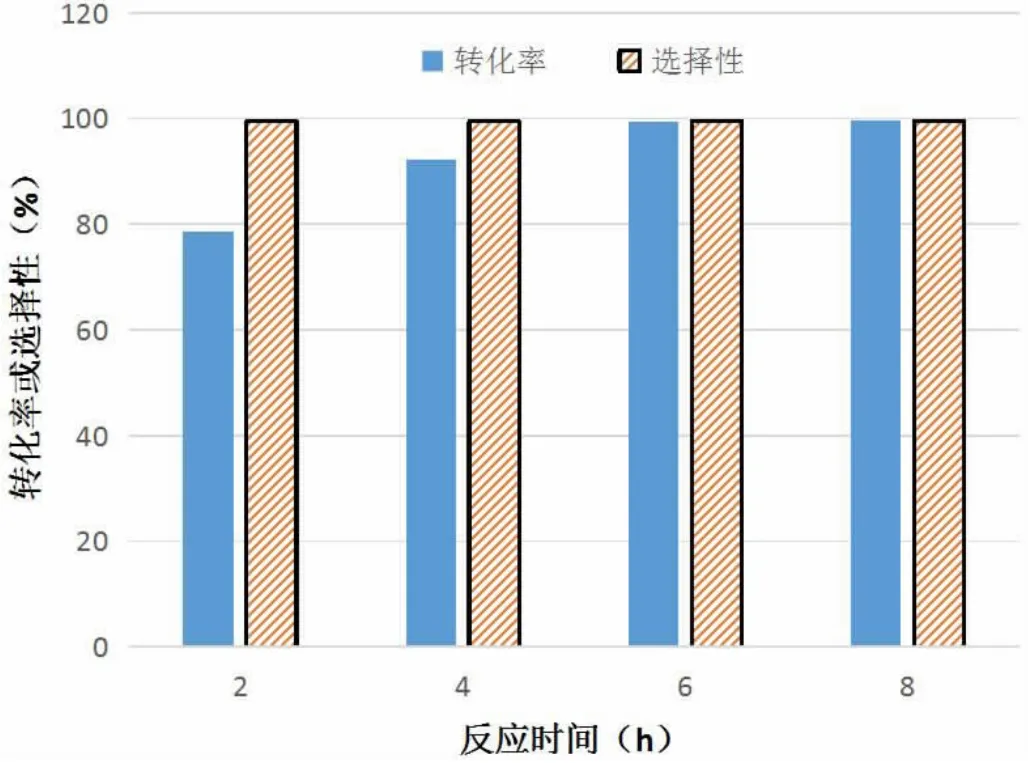
图3 275K时苯乙烯环氧化反应的转化率与选择性

图4 300K时苯乙烯环氧化反应的转化率与选择性
结合图3和图4可以发现,反应温度主要对苯乙烯环氧化反应的转化率有影响,当温度为300K时反应速率较快,大约在2h后转化率达到了95.1%,此时环氧化反应基本结束;相比之下,当温度为275K时,经过2h后转化率仅有28.2%。说明适当提高反应温度,能够提升苯乙烯环氧化反应的转化率。在选择性方面,温度变化带来的影响并不明显。综上,在离子液体中Mn(III)Salen催化烯烃环氧化反应选择性合成烯烃环氧化物中,将反应温度设定为300K更为合适。
4 底物与催化剂、氧化剂比例对环氧化物产率的影响
4.1 底物与催化剂比例的试验
选择0.3mmol的苯乙烯为底物,用0.45mmol的PhIO作为氧化剂,设定反应温度为300K、反应时间为2h,通过改变催化剂的量探究底物与催化剂比例对环氧化物转化率的影响,结果如图5所示。
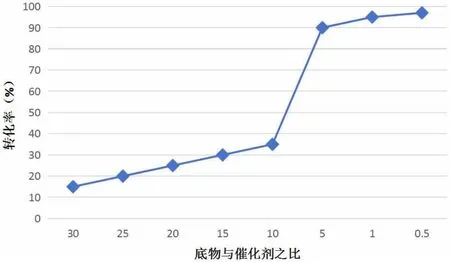
图5 底物与催化剂比例对转化率的影响
由图5可知,环氧化物的转化率随着苯乙烯与催化剂摩尔比的减小呈现出上升趋势,说明在混合物中催化剂的比例越高,环氧化反应速度越快,相应的环氧化物的转化率越高。其中,当苯乙烯与催化剂的摩尔比为5:1时,转化率明显升高,并且底物苯乙烯在2h内基本反应完全。此后再继续增加催化剂的量,对转化率的提升作用不明显。因此,在合成烯烃环氧化物中可以将底物与催化剂的摩尔比设定为5:1,在提高反应速度与转化率的同时还能降低试验成本。
4.2 底物与氧化剂比例的试验
选择0.3mmol的苯乙烯为底物,用0.05mmol的Mn(III)Salen作为催化剂,设定反应温度为300K、反应时间为2h,通过改变氧化剂的量探究底物与氧化剂比例对环氧化物转化率的影响,结果如图6所示。
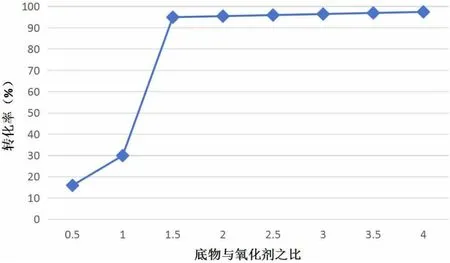
图6 底物与氧化剂比例对转化率的影响
由图6可知,当混合物中氧化剂的量低于苯乙烯的量时,环氧化反应的转化率较低。当两者的比例为1:1时,转化率开始明显增加,在比例达到1.5:1时,大约2h可以完全反应,此时转化率为95%。综上,在合成烯烃环氧化物中可以将底物与氧化剂的摩尔比设定为1.5:1。
5 结语
离子液体是一种“环境友好型”溶剂,可以为有机阳离子和无机阴离子提供良好的反应环境,从而使溶解于离子液体中的催化剂具有更好活性,进而达到提高反应物转化率与产物选择性的效果。通过烯烃环氧化反应选择性合成烯烃氧化物时,用BmimPF6与CH2Cl2组成的混合溶剂作为离子液体,用乙二胺和水杨醛制作的Mn(III)Salen作为催化剂,在300K温度下进行苯乙烯环氧化反应,使苯乙烯环氧化物产率最高、选择性更好。

