蝙蝠葛苏林碱调控Akt/mTOR信号通路对胶质瘤细胞增殖及自噬的影响*
殷海棠,文志鹏,杨继红,李明,李琴,赵青青,肖坚
(1.贵州医科大学 药学院,贵州 贵阳 550025; 贵州医科大学附属医院2.药学部,3.GCP中心,4.临床医学研究中心,贵州 贵阳 550004;5.中南大学湘雅医院 药学部,湖南 长沙 410008)
胶质瘤是一种常见的成人中枢神经系统原发性恶性脑瘤,具有侵袭性强、病死率高、预后差等特点,患者生存期仅有12~15 个月,5 年生存期约为5.5%[1]。胶质瘤治疗方式主要包括手术、放射治疗和化学药物治疗[2]。替莫唑胺(Temozolomide, TMZ)是临床治疗胶质瘤的一线药物,不良反应大,选择性差,疗效不理想[3]。因此,探寻新的抗胶质瘤药物对改善患者预后有一定意义。
自噬是在一系列信号通路调控下细胞利用溶酶体降解自身细胞质蛋白和受损细胞器的生物学过程[4]。自噬过程一般包括自噬小泡成核、内膜扩张、自噬小体形成、自噬小体与溶酶体融合、底物降解5 个阶段。近年来研究表明,自噬对多种肿瘤发生、发展有重要调控作用,抑制自噬可以阻碍包括胶质瘤在内多种肿瘤的发生[5]。因此,以自噬为靶点探索新的胶质瘤治疗分子机制,可能为胶质瘤治疗提供新的方向。蝙蝠葛苏林碱(Daurisoline, DAS)是从中药蝙蝠葛根茎中提取的四氢异喹啉类天然生物碱[6]。DAS 具有丰富的药理作用,被用于癫痫[7]、心血管[8]、肿瘤[9]等疾病的研究与治疗。近年来研究发现,DAS 具有良好的抗肿瘤活性,但其在胶质瘤中的作用尚未明确。本研究旨在探索DAS 抗胶质瘤的作用及其潜在分子生物学机制,为阐明DAS抗胶质瘤的药理作用提供基础与理论依据。
1 材料与方法
1.1 材料
人脑胶质瘤细胞系U251 和U87(中国科学院上海生物化学与细胞生物学研究所)。DAS(上海蓝木化工有限公司),CCK-8 试剂(北京兰杰柯科技有限公司),胎牛血清(美国Thermo Fisher Scientific 公司),二甲基亚砜(dimethyl sulfoxide, DMSO)、4%多聚甲醛、结晶紫染色液、RIPA Lysis Buffer RIPA 裂解液、BCA 蛋白浓度测定试剂盒、Edu 试剂盒、BeyoECL Plus(超敏ECL 化学发光液)(上海碧云天生物技术有限公司),细胞凋亡试剂盒(江苏凯基生物技术股份有限公司),Bax、Bcl-2、p-Akt(Ser473)、p-mTOR(Ser448)、Akt、mTOR、辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗鼠IgG 及HRP 标记的山羊抗兔IgG(武汉三鹰生物技术有限公司),LC3B、SQSTM1/P62 抗体(美国CST 公司)。
酶标仪、5% 二氧化碳培养箱(美国Thermo Fisher Scientific 公司),倒置荧光显微镜(德国ZEISS公司),透射电子显微镜(日本JEOL 公司),流式细胞仪(美国Beckman 公司),电泳仪(美国Bio-Rad 公司),细胞培养超净台(新加坡Esco 公司),化学发光成像系统(上海勤翔科学仪器有限公司)。
1.2 方法
1.2.1 细胞培养 复苏U251 和U87 细胞,置于T25培养瓶中,加入含10% 胎牛血清的高糖培养基(dulbecco's modified eagle medium, DMEM),移入37 ℃、5%二氧化碳培养箱中培养。待细胞汇合度达80%~90%按1∶3 传代或冷冻保存。取培养3 代后细胞进行后续实验。
1.2.2 细胞活力测定 将细胞以1×103个/孔的密度接种于96 孔板中,设置对照组、2.5 μmol/L DAS 组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组、10.0 μmol/L TMZ 组。每组设置3 个复孔,培养72 h 后,用含10 μL CCK-8 的100 μL DMEM 替换原培养基,37 ℃、5%二氧化碳培养箱中培养1 h,使用酶标仪在450 nm 处测光密度(optical density, OD)值。
1.2.3 Edu 实验 将细胞以1×105个/孔的密度接种于6 孔板中,用不同浓度的DAS 处理72 h 后弃掉培养液,PBS 洗涤3 次,4%多聚甲醛固定15 min,0.3% Trition X-100 孵育10 min,磷酸盐缓冲液(phosphate buffer saline, PBS)洗涤3 次,按试剂盒说明书进行操作,加入Hoechst 33342 溶液避光孵育10 min,倒置荧光显微镜拍照,用Image J 软件计算阳性细胞。
1.2.4 克隆实验 将细胞以1×103个/孔的密度接种于6 孔板中,设置3 组:对照组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组。在37 ℃、5%二氧化碳培养箱中持续培养2 周,4%(v/v)多聚甲醛固定细胞20 min,0.1%(w/v)结晶紫染色10 min,PBS 洗涤3 次,对6 孔板进行拍照,用Image J 软件计算各组的克隆形成数。
1.2.5 细胞凋亡 将细胞计数后按2×105个/孔接种于6 孔板中。设置3 组:对照组、5.0 μmol/L DAS组、10.0 μmol/L DAS 组。培养72 h 后,用不含EDTA的胰酶消化细胞,1 000 r/min 离心5 min,弃上清液,将沉淀用500 μL loading buffer 重悬,加入5 μL 膜联蛋白Annevin V-FITC 和5 μL 碘化丙啶(propidium iodide, PI),暗室染色10 min,流式细胞仪检测,通过FlowJo 分析细胞凋亡。
1.2.6 透射电镜观察自噬囊泡的形成 将细胞用3%戊二醛和1%四氧化锇酸固定,丙酮脱水,812 环氧树脂包埋,制片,醋酸铀和柠檬酸铅染色15 min 后,用透射电子显微镜观察细胞自噬囊泡的形成情况。
1.2.7 Western blotting 检测细胞相关蛋白表达 用含蛋白酶抑制剂(苯甲基磺酰氟,PMSF)的RIPA 裂解液裂解细胞,收集上清液。使用BCA 蛋白测定试剂测定蛋白浓度。SDS-PAGE 蛋白上样缓冲液(5×)以1∶4(v/v)的比例加入蛋白上清样品,100 ℃金属浴10 min。将蛋白质加入到SDS-PAGE 凝胶泳道电泳,蛋白印迹转移至PVDF 膜上,用5%脱脂牛奶封闭1 h,分别用一抗GAPDH(1∶5 000)、Bcl-2(1∶2 000)、Bax(1∶5 000)、p62(1∶1 000)、LC3B(1∶1 000)、Akt(1∶5 000)、p-Akt(1∶1 000)、mTOR(1∶5 000)和pmTOR(1∶2 000)在4 ℃条件下过夜孵育条带,洗涤3 次,加入相应二抗(1∶5 000)常温下孵育1 h,滴加ECL 化学发光液,用化学发光成像系统观察印迹条带,采用Image J 软件分析蛋白条带灰度值,计算目的蛋白相对表达量。
1.3 统计学方法
数据分析采用Graph Pad Prism 8.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 DAS抑制胶质瘤细胞活力
对照组、2.5 μmol/L DAS 组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组U251 和U87 细胞活力比较,经方差分析,差异均有统计学意义(P<0.05)。5.0 μmol/L DAS 组、10.0 μmol/L DAS 组U251 和U87 细胞活力均低对照组、2.5 μmol/L DAS 组。因此以5.0 和10.0 μmol/L DAS 作为后续研究浓度,对比DAS、TMZ对U251 和U87 细胞活力影响。见表1。
表1 4组U251和U87细胞活力比较 (%,±s)
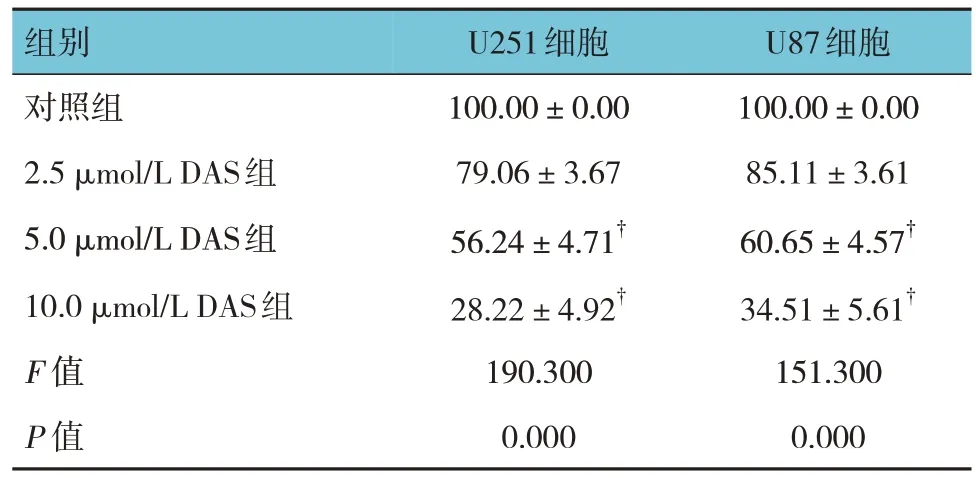
表1 4组U251和U87细胞活力比较 (%,±s)
注 : †与对照组、2.5 μmol/L DAS组比较,P <0.05。
U87细胞100.00±0.00 85.11±3.61 60.65±4.57†34.51±5.61†151.300 0.000组别对照组2.5 μmol/L DAS组5.0 μmol/L DAS组10.0 μmol/L DAS组F 值P 值U251细胞100.00±0.00 79.06±3.67 56.24±4.71†28.22±4.92†190.300 0.000
对照组、10.0 μmol/L TMZ 组、10.0 μmol/L DAS组U251 细胞活力分别为(100.00±0.00)%、(89.19±1.98)%、(28.22±4.92)%,经方差分析,差异有统计学意义(F=336.100,P=0.000);10.0 μmol/L DAS 组细胞活力低于10.0 μmol/L TMZ 组(P<0.05)。对照组、10.0 μmol/L TMZ 组、10.0 μmol/L DAS 组U87 细胞活力分别为(100.00±0.00)% 、(92.37±2.12)% 、(34.51±5.61)%,经方差分析,差异有统计学意义(F=1397.000,P=0.000);10.0 μmol/L DAS 组细胞活力低于10.0 μmol/L TMZ 组(P<0.05)。DAS 在胶质瘤细胞U251 和U87 的IC50 分别为5.11 μmol/L 和6.35 μmol/L。见图1。
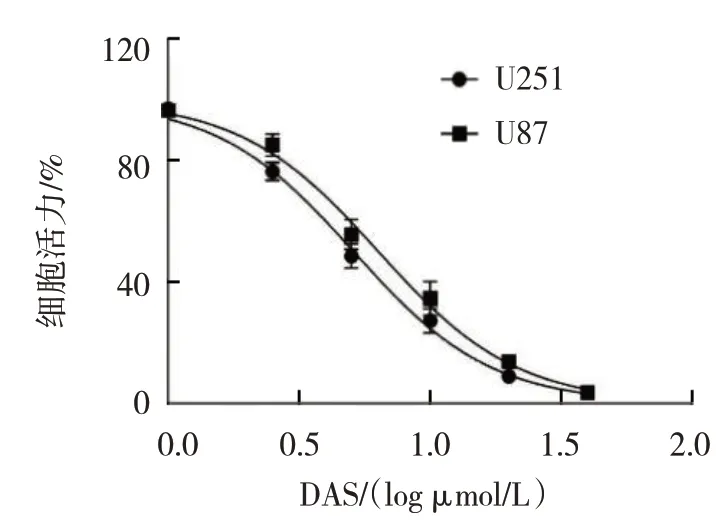
图1 DAS在胶质瘤细胞U251和U87中的IC50
2.2 DAS抑制胶质瘤细胞增殖
对照组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组U251 和U87 细胞Edu 阳性率比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,不同浓度DAS 组细胞Edu 阳性率降低(P<0.05),且组间两两比较差异均有统计学意义(P<0.05),表明呈浓度依赖性。见表2 和图2。

图2 不同浓度DAS对细胞增殖的影响
表2 3组U251和U87细胞增殖情况比较 (±s)
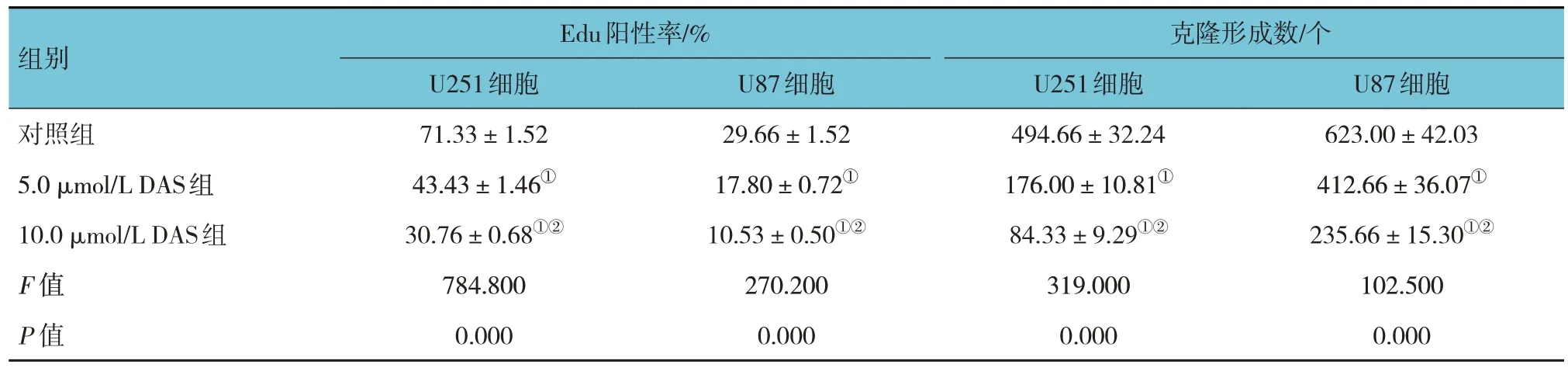
表2 3组U251和U87细胞增殖情况比较 (±s)
注 : ①与对照组比较,P <0.05; ②与5.0 μmol/L DAS组比较,P <0.05。
组别Edu阳性率/%U251细胞71.33±1.52 43.43±1.46①30.76±0.68①②784.800 0.000 U87细胞29.66±1.52 17.80±0.72①10.53±0.50①②270.200 0.000对照组5.0 μmol/L DAS组10.0 μmol/L DAS组F 值P 值克隆形成数/个U251细胞494.66±32.24 176.00±10.81①84.33±9.29①②319.000 0.000 U87细胞623.00±42.03 412.66±36.07①235.66±15.30①②102.500 0.000
对照组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组U251 和U87 细胞克隆形成数比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,不同浓度DAS 组细胞克隆形成数减少(P<0.05),且组间两两比较差异均有统计学意义(P<0.05),表明呈浓度依赖性。见表2 和图2。
2.3 DAS促进胶质瘤细胞凋亡
对照组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组U251 和U87 细胞凋亡率比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,不同浓度DAS 组细胞凋亡率升高(P<0.05),且组间两两比较差异均有统计学意义((P<0.05),表明呈浓度依赖性。见表3 和图3。

图3 不同浓度DAS对细胞凋亡的影响
表3 3组U251和U87细胞凋亡率比较 (%,±s)
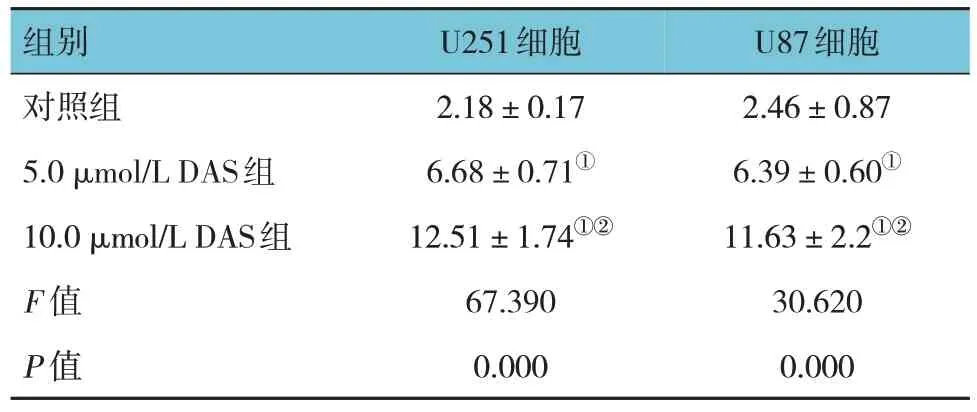
表3 3组U251和U87细胞凋亡率比较 (%,±s)
注 : ①与对照组比较,P <0.05; ②与5.0 μmol/L DAS 组比较,P <0.05。
U87细胞2.46±0.87 6.39±0.60①11.63±2.2①②30.620 0.000组别对照组5.0 μmol/L DAS组10.0 μmol/L DAS组F 值P 值U251细胞2.18±0.17 6.68±0.71①12.51±1.74①②67.390 0.000
对照组、5.0 μmol/L DAS 组和10.0 μmol/L DAS组U251 和U87 细胞Bax、Bcl-2 蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,不同浓度DAS 组Bax 蛋白相对表达量升高(P<0.05),而Bcl-2 蛋白相对表达量降低(P<0.05)。见表4 和图4。

图4 3组U251和U87细胞Bax、Bcl-2蛋白的表达
表4 3组U251和U87细胞Bax、Bcl-2蛋白相对表达量比较 (±s)

表4 3组U251和U87细胞Bax、Bcl-2蛋白相对表达量比较 (±s)
注 : ①与对照组比较,P <0.05; ②与5.0 μmol/LDAS 组比较,P <0.05。
组别U251细胞U87细胞对照组5.0 μmol/L DAS组10.0 μmol/L DAS组F 值P 值Bcl-2蛋白0.38±0.03 0.28±0.04①0.10±0.00①②56.460 0.000 Bax蛋白0.66±0.03 0.77±0.04①0.90±0.02①②27.350 0.001 Bcl-2蛋白0.52±0.04 0.42±0.03①0.32±0.01①②29.190 0.000 Bax蛋白0.52±0.01 0.64±0.02①0.82±0.07①②29.700 0.000
2.4 DAS对胶质瘤细胞自噬的影响
对照组、5.0 μmol/L DAS 组、10.0 μmol/L DAS 组U251 和U87 细胞p62、LC3Ⅱ/Ⅰ蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,不同浓度DAS 组p62、LC3Ⅱ/Ⅰ蛋白相对表达量升高(P<0.05)。见表5 和图5。

图5 3组U251和U87细胞LC3Ⅱ/Ⅰ、p62蛋白的表达
表5 3组U251和U87细胞LC3Ⅱ/Ⅰ、p62蛋白相对表达量比较 (±s)
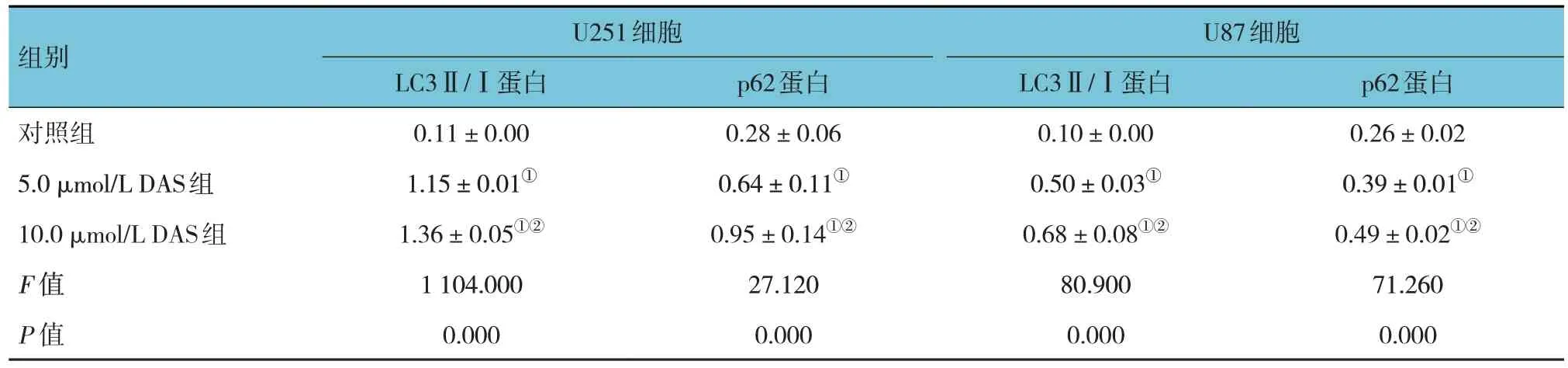
表5 3组U251和U87细胞LC3Ⅱ/Ⅰ、p62蛋白相对表达量比较 (±s)
注 : ①与对照组比较,P <0.05; ②与5.0 μmol/L DAS组比较,P <0.05。
组别U251细胞U87细胞对照组5.0 μmol/L DAS组10.0 μmol/L DAS组F 值P 值p62蛋白0.26±0.02 0.39±0.01①0.49±0.02①②71.260 0.000 LC3Ⅱ/Ⅰ蛋白0.11±0.00 1.15±0.01①1.36±0.05①②1 104.000 0.000 p62蛋白0.28±0.06 0.64±0.11①0.95±0.14①②27.120 0.000 LC3Ⅱ/Ⅰ蛋白0.10±0.00 0.50±0.03①0.68±0.08①②80.900 0.000
对照组、10.0 μmol/L DAS 组自噬囊泡分别为(2±1)和(40±8)个,经t检验,差异有统计学意义(t=4.758,P=0.037),10.0 μmol/L 组自噬囊泡数高于对照组(P<0.05)。见图6。

图6 DAS对U251细胞自噬囊泡影响(醋酸铀和柠檬酸铅双染色)
2.5 DAS调控AKT/mTOR细胞信号通路
对照组、5.0 μmol/L DAS组、10.0 μmol/L DAS组U251和U87 细胞p-Akt/Akt、p-mTOR/mTOR 蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,不同浓度DAS 组p-Akt/Akt、p-mTOR/mTOR蛋白相对表达量升高(P<0.05)。见图7和表6。
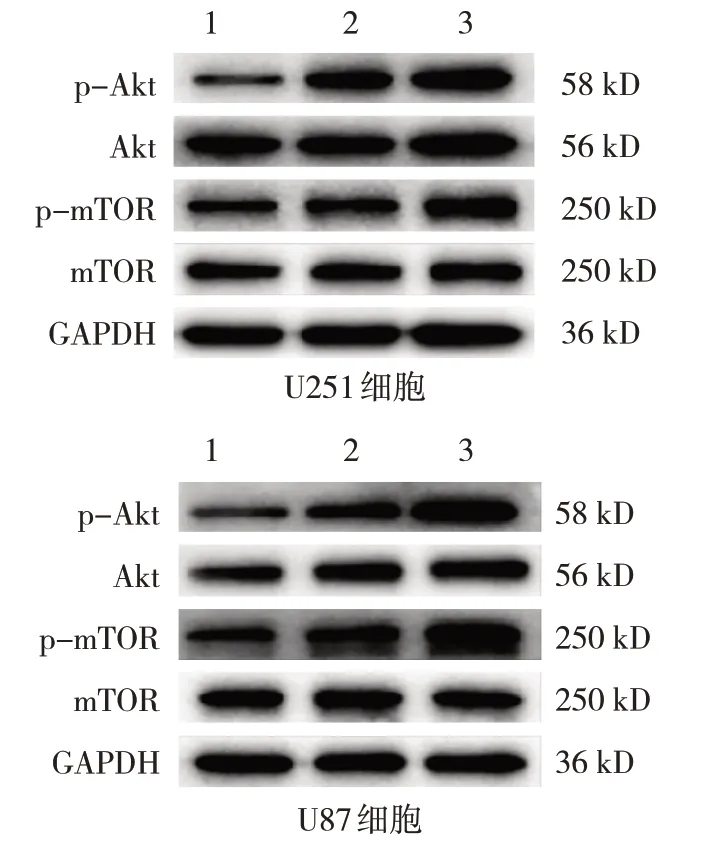
图7 3组U251和U87细胞p-Akt/Akt、p-mTOR/mTOR蛋白的表达
表6 3组U251和U87细胞p-Akt/Akt、p-mTOR/mTOR蛋白相对表达量比较 (±s)
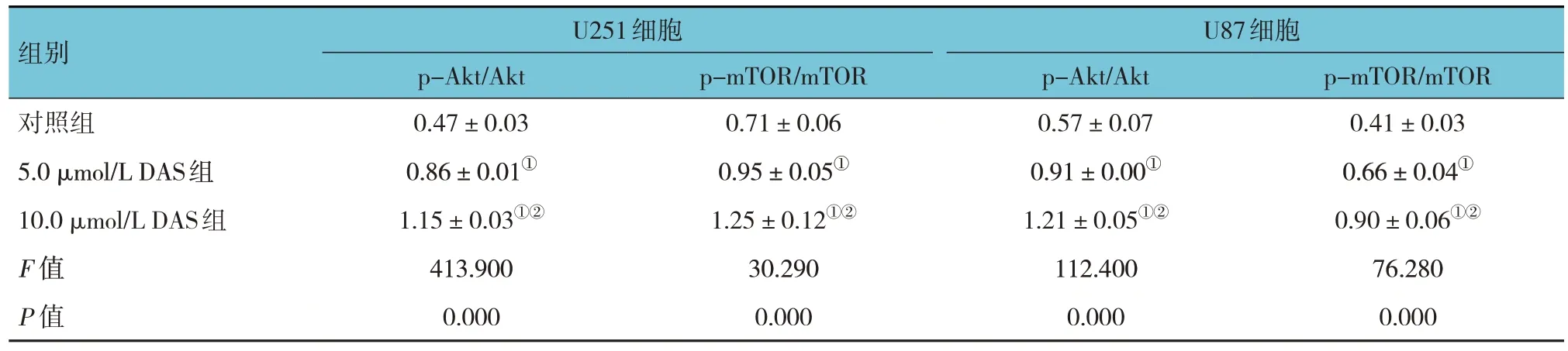
表6 3组U251和U87细胞p-Akt/Akt、p-mTOR/mTOR蛋白相对表达量比较 (±s)
注 : ①与对照组比较,P <0.05; ②与5.0 μmol/LDAS组比较,P <0.05。
组别U251细胞U87细胞对照组5.0 μmol/L DAS组10.0 μmol/L DAS组F 值P 值p-mTOR/mTOR 0.41±0.03 0.66±0.04①0.90±0.06①②76.280 0.000 p-Akt/Akt 0.47±0.03 0.86±0.01①1.15±0.03①②413.900 0.000 p-mTOR/mTOR 0.71±0.06 0.95±0.05①1.25±0.12①②30.290 0.000 p-Akt/Akt 0.57±0.07 0.91±0.00①1.21±0.05①②112.400 0.000
3 讨论
胶质瘤是发生率和病死率均排在首位的中枢神经系统恶性肿瘤,目前的治疗方式虽能提高患者生存率,但总体效果不佳。因此,寻找高效、低毒的新型抗胶质瘤化合物是目前胶质瘤研究领域的热点。本研究发现,DAS 通过激活Akt/mTOR 信号通路抑制自噬,进而抑制胶质瘤细胞增殖并诱导其凋亡。
DAS 是防己科蝙蝠葛属藤本植物蝙蝠葛的干燥根茎,即中药北豆根的成分之一。近年来随着DAS抗肿瘤的研究不断深入,WANG 等[10]发现DAS 可以通过靶向MEK1/2 激酶抑制食管鳞状细胞癌的生长。HUANG 等[11]发现DAS 介导HAKAI 蛋白稳定性,抑制膀胱癌的血管生成和上皮间质转化。ZHANG等[12]研究表明,DAS可以使RhoA/ROCK2介导的Akt和ERK-p38 MAPK 信号通路失活,抑制肝癌血管生成。但DAS 在胶质瘤中的作用和机制不甚明确。本研究发现随着DAS 浓度升高,胶质瘤细胞增殖受抑制,凋亡率升高,同时促凋亡蛋白Bax 表达增加,抗凋亡蛋白Bcl-2表达降低,表明DAS 有潜在的抑制胶质瘤作用。
近年来研究发现,凋亡与自噬相互调控、相互影响,抑制自噬会促进细胞凋亡[13-14]。细胞内正常水平的自噬对清除细胞中聚集蛋白与受损细胞器至关重要,自噬功能缺陷会导致受损蛋白与细胞器在细胞内过度积累,后者会产生细胞毒性导致细胞凋亡[15]。同时,自噬也是清除胞质内受损线粒体的主要途径[16]。抑制自噬导致受损线粒体在胞质内堆积与ROS 水平上升,促发细胞发生氧化应激,诱导细胞凋亡[17]。ZHANG 等[18]研究表明,异甘草素通过p38/MAPK 轴抑制自噬,促进胰腺癌细胞死亡。重楼皂甙Ⅱ通过mTOR 途径抑制自噬,诱导肺癌细胞凋亡[19]。自噬不仅在维持细胞生长发育中扮演重要角色,同时在肿瘤的生长和转移中发挥至关重要的调控作用[20-21]。LC3 是自噬的标志性蛋白,LC3-Ⅰ向LC3-Ⅱ转变或LC3-Ⅱ表达增加都被认为是自噬激活的标志[22]。本研究发现,DAS 干预后胶质瘤细胞LC3-Ⅱ表达升高。自噬降解底物蛋白p62 能与LC3结合选择性地进入自噬体,通过溶酶体介导的自噬途径被降解[23]。本研究检测p62 蛋白表达发现,DAS处理后胶质瘤细胞p62 蛋白表达升高,表明DAS 抑制胶质瘤细胞自噬。同时,透射电镜结果发现DAS组胶质瘤细胞自噬囊泡增加,进一步证实DAS 抑制自噬囊泡晚期的降解过程。综上所述,本研究提示DAS 可能通过抑制自噬,诱导细胞凋亡。
Akt/mTOR 信号通路在心血管疾病[24]、氧化应激[25]、肿瘤等[26]多种疾病中发挥重要的自噬调节作用。当该通路以磷酸化形式激活时,会抑制自噬的发生[27]。有研究表明,三七皂苷R1 通过激活Akt/mTOR 信号通路,调控缺血心肌脂质代谢[28]。蛋白激酶N2 通过抗氧化应激和激活mTOR,降低过氧化氢诱导的PC12 细胞损伤和凋亡[29]。m6A 脱甲基酶ALKBH5 介导的DDIT4-AS1 通过激活mTOR,维持胰腺癌细胞干性,降低化疗敏感性[30]。以上研究均表明Akt/mTOR 信号通路在自噬中扮演重要角色。同样本研究发现DAS 干预后,胶质瘤细胞p-Akt 和pmTOR 蛋白表达显著升高,提示DAS 抑制自噬的分子机制可能与Akt/mTOR 信号通路有关。
综上所述,本研究证实了DAS 对胶质瘤的抗肿瘤作用。DAS 抑制胶质瘤细胞活力和增殖,并促进其凋亡,其机制可能与DAS 上调Akt/mTOR 信号通路,抑制自噬有关。但本研究仅在细胞水平验证DAS 对胶质瘤细胞的作用,在动物模型中是否存在同样的作用和机制,有待进一步深入研究。

