茶树捕光色素蛋白复合体CsLhcb1 基因的鉴定及干旱胁迫响应分析
秦志远,胡志航,杨 妮,王亚如,孔洁玙,李静文,陈 益,王政善,李 彤,庄 静*
(1. 南京农业大学园艺学院/茶叶科学研究所/农业农村部华东地区园艺作物生物学与种质创制重点实验室,江苏 南京 210095; 2. 连云港御龙茶业有限公司,江苏 连云港 222114; 3. 南京农业大学/作物遗传与种质创新利用全国重点实验室,江苏 南京 210095)
0 引言
【研究意义】光合作用是植物最基本的生命活动,光合作用通过一系列复杂的氧化还原过程使植物在同化CO2的同时,把太阳能转变为化学能并储存在所形成的有机物中,正是这种重要的机制保障了植物正常的生长发育。在光合作用的过程中,光能的捕获依托于多种色素分子对光能的吸收,其中Lhcb(light-harvesting chlorophyⅡa/b-binding proteins of photosystemⅡ)是植物光系统II(PSII)中的一类膜蛋白,由Lhcb基因家族编码,含有保守的叶绿素结合(chlorophyllbinding,CB)结构域,可以与叶绿素a/b结合形成捕光色素蛋白复合体(LHC)。LHC 在光合作用中发挥着重要的作用,不仅能够捕获光能,而且能将能量传递到反应中心并发生光化学反应,此外还参与激发能的在光系统之间的分配利用、光系统的保护、维持类囊体结构和对环境变化的反应[1-5]。虽然光对于植物至关重要,但过量的光超过了植物生长发育所能利用的量会对植物造成光氧化损伤并使得光合效率降低,PSII 中叶绿素荧光的非光化学猝灭(NPQ)就是应对过量光的一种机制[6]。【前人研究进展】当茶树受到干旱胁迫时,会激活一系列信号转导途径,如ABA 信号通路、Ca2+信号通路等,通过激活此类信号转导途径,可以提高茶树的抗旱性。同时,茶树还可以通过减少水分降低蒸腾作用,水分的降低可以减少光合产物的消耗,从而延长茶树叶片的生命周期。茶树体内的有机物主要包括:糖类、蛋白质、游离氨基酸、茶多酚、咖啡碱等,都是光合作用的产物和衍生物。因此光合作用对茶叶的产量和品质起着决定性作用,已日益受到人们的重视。随着茶树光合分子机制的揭示,光合规律的掌握和运用,茶叶单产得到不断提高,但茶树光合作用的效率还不高,要实现茶叶生产的持续高产优质低耗,提高茶树光合效率是一个重要的突破点。Lhcb基因家族作为与光合作用密切相关的基因,如杨树(Populus trichocarpa)中得到了系统鉴定,并分为Lhcb1~8等亚家族[7-9]。Jiang[10]等研究发现芹菜中的lhcb1基因在干旱胁迫中的表达情况是降低的。目前,茶树中却尚未见到Lhcb基因家族的相关报道。【本研究切入点】茶树[Camellia sinensis(L.)O. Kuntze]是一种多年生木本植物,起源于我国的西南地区,具有喜湿耐阴的特征。我国茶区分布广泛,部分茶区四季分明,雨量和太阳辐射能周年分布不均,6 月至9 月常发生高温少雨、日照强烈的情况,故许多茶区都会先后出现不同程度的伏旱和秋旱[11]。近年来,随着全球气候变暖,极端高温、干旱现象出现的频率越来越高,干旱胁迫对茶树生长发育带来的负面问题越来越引起人们重视,了解并进一步研究茶树在干旱胁迫前后的变化,对优化茶树栽培管理、提高茶树抗逆性及选育抗旱品种尤为重要[12]。茶作为全球三大无酒精饮料,有着很高的经济价值[13],而干旱胁迫不仅导致茶园总产量降低,还造成茶叶总蛋白、淀粉和双糖含量降低,可溶性糖、可溶性蛋白和纤维素含量升高,使得茶叶品质降低[14],严重损害了茶产业的经济效益[15]。【拟解决的关键问题】以‘龙井43’‘舒茶早’和‘白叶一号’作为试验材料,首先克隆获得茶树CsLhcb1基因,利用聚乙二醇-6000(PEG-6000,Polyethylene glycol-6000)模拟干旱胁迫,再运用实时荧光定量PCR 技术分析茶树CsLhcb1基因在干旱胁迫下的表达情况,为进一步揭示茶树CsLhcb1基因的功能提供参考依据。
1 材料与方法
1.1 试验材料
‘龙井43’‘舒茶早’‘白叶一号’为两年生茶树扦插苗。预培养1 周后,将长势一致的茶苗统一置于南京农业大学作物遗传与种质创新利用全国重点实验室植物生长室内,配制200 mg·mL-1PEG-6000(20% PEG)溶液,选取生长条件一致的茶苗,采用对扦插苗基部浇施的方式模拟干旱胁迫,对照组(CK)浇施等量蒸馏水,除施加的处理不同外,其他条件一致。上午9 时是取样的第一个时间点(0 h),并分别在处理后1、3、6、12、24 h进行取样,将所取材料立即置于液氮中,后转移至-80℃冰箱保存,每个时间节点均设3 个生物学重复。
1.2 主要仪器与试剂
仪器:荧光定量PCR 仪(CFX96TMreal-time PCR system 平台);微量紫外分光光度计(Nanodrop ND 1000,上海谱元仪器有限公司)。
试剂:植物总RNA 提取试剂盒(RNA simple total RNA Kit,北京Tiangen 公司);Prime Script RT 试剂盒(大连TaKaRa 公司);Cham Q Universal SYBR qPCR Master Mix 试剂盒(南京诺唯赞生物科技有限公司)。
1.3 茶树CsLhcb1 基因的克隆
采用多糖多酚植物总RNA 提取试剂盒提取茶树总RNA,用分光光度计检测所提取RNA 质量,保存至-80℃备用。按照Prime Script RT 试剂盒反转录合成cDNA,保存于-20℃备用。根据茶树CsLhcb1序列,如表1 所示,使用Primer premier 5.0 软件设计全长引物,将‘龙井43’的cDNA 作为模板,PCR 扩增体系为20 μL。PCR 反应程序为:95℃预变性5 min;95℃变性30 s,54℃退火30 s,72℃延伸90 s,45 个循环;72℃最终延伸10 min。使用1.2%琼脂糖凝胶对PCR 结果进行检测后将剩余PCR 原液测序。
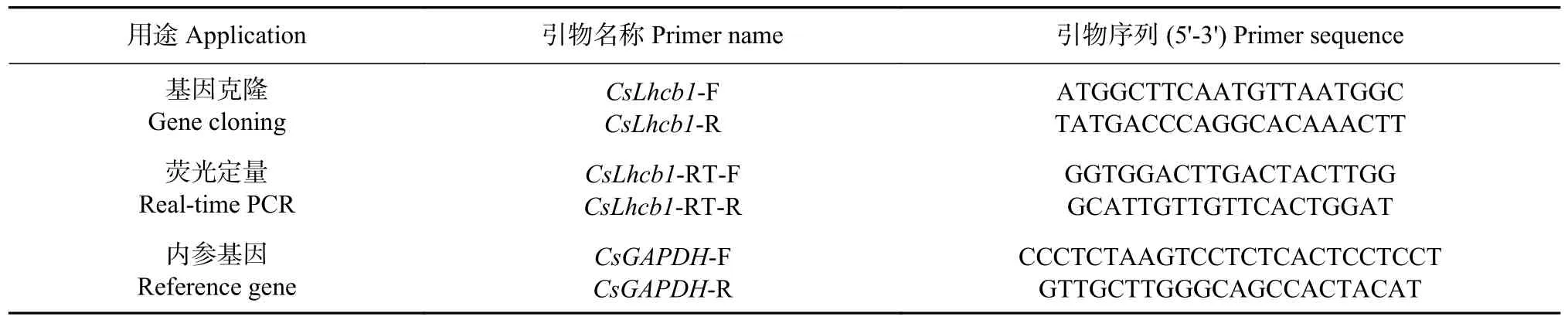
表1 引物序列Table 1 Primer sequence
1.4 茶树CsLhcb1 蛋白的生物信息分析
使用ProtParam 的在线工具分析蛋白质的相对分子质量等理化性质;借助DNAMAN 软件对蛋白质的亲/疏水性分析;依托Swiss-Model 软件预测茶树CsLhcb1 蛋白三级结构;利用STRING 在线网站,预测茶树CsLhcb1 蛋白潜在的互作关系;通过在线网页NCBI 中的BLAST 工具同源比对不同物种Lhcb1 蛋白序列(https://www.ncbi.nlm.nih.gov);构建系统进化树依托MEGA 软件。
1.5 茶树CsLhcb1 基因在干旱胁迫下的表达分析
如表1 所示,利用Primer Premier 5.0 软件设计CsLhcb1基因定量引物,选取茶树CsGAPDH作为内参基因[16]。选用Cham Q Universal SYBR qPCR Master Mix 试剂盒进行实时荧光定量实验,该反应体系共20 μL,分别为:SYBR Green I mix酶10 μL;上下游引物各0.4 μL;模板2 μL;ddH2O 7.2 μL。反应程序为:95℃预变性5 min;95℃变性10 s,60℃退火延伸30 s,40 个循环。采用2-ΔCT法进行定量数据分析[17]。
2 结果与分析
2.1 茶树CsLchb1 基因的克隆与序列分析
利用NCBI 在线分析软件BLAST 筛选出CsLchb1序列(LOC114265239) , 序列ID 为XM_028206006.1,使用Primer premier 5.0 软件设计引物,以‘龙井43’的cDNA 为模板经PCR 扩增,以CsLhcb1-F 和CsLhcb1-R 为引物,克隆得到CsLchb1基因,目的片段为810 bp(图1)。
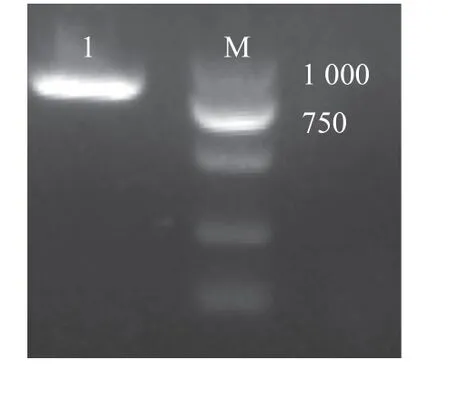
图1 PCR 扩增产物琼脂凝胶电泳图Fig. 1 Agar gel electrophoresis of PCR amplification product
2.2 茶树CsLchb1 基因所编码蛋白的保守结构域预测
通过NCBI 在线分析工具Conserved Domain Database(CDD)分析蛋白结构域,茶树CsLchb1基因所编码的蛋白中存在两个特殊结构域,分别为:捕光色素蛋白复合体结构域(PLN00025),位于氨基酸序列第19 个和第269 个之间;叶绿素a/b结合蛋白结构域(pfam00504),位于氨基酸序列第68 个和第236 个之间。编码蛋白属于叶绿素a/b连接蛋白超家族成员(图2)。

图2 CsLhcb1 蛋白保守结构域预测Fig. 2 Predicted conserved domain of CsLhcb1 protein
2.3 茶树CsLhcb1 的生物信息分析
如图3 所示,利用在线工具ProtParam 预测CsLhcb1 蛋白的分子式为C1328H2024N344O371S10。原子总数为4 077,分子量为29 065.36 Da,氨基酸数为269,属于小分子蛋白;理论等电点为5.66,属于酸性蛋白,不稳定系数为20.26,属于稳定类蛋白;在亲疏水性分析中得出,CsLhcb1 蛋白的平均亲水性指数(Grand average of hydropathicity)为0.043,该蛋白疏水性氨基酸占比较高,属于疏水性蛋白。
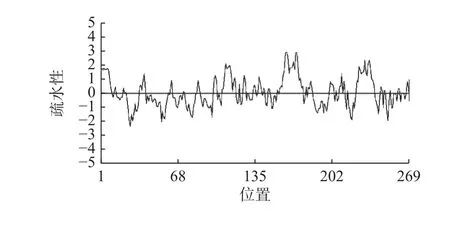
图3 CsLhcb1 蛋白的亲/疏水性预测Fig. 3 Predicted hydrophilicity/hydrophobicity of CsLhcb1 protein
对CsLhcb1编码氨基酸序列进行结构预测,VMD 可视化显示其二级结构主要由无规则卷曲、α 螺旋和β 折叠组成。通过Swiss-Model 软件预测CsLhcb1 蛋白三级结构,结果显示该蛋白主要由螺旋和折叠构成,通过与豌豆PsLhcb1 蛋白对比发现,豌豆PsLhcb1 蛋白和茶树CsLhcb1 蛋白结构较为相似,结构预测与二级结构吻合。图4 列举了茶树CsLhcb1 蛋白与豌豆PsLhcb1 蛋白的10 个差异位点,分别位于67(T)、95(R)、98(A)、104(G)、115(I)、121(Q)、177(F)、180(N)、218(I)、251(E)。
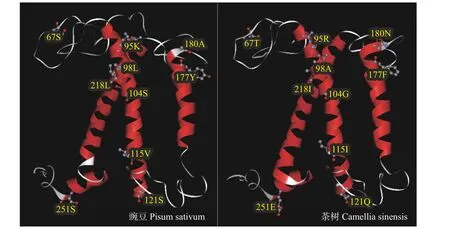
图4 CsLhcb1 蛋白三级结构预测Fig. 4 Predicted tertiary structure of CsLhcb1 protein
2.4 茶树CsLchb1 蛋白互作预测分析
利用STRING 在线网站,以拟南芥蛋白质数据库为参考,预测了LHCB1(茶树CsLhcb1 蛋白)潜在的互作关系(图5)。结果发现,LHCB1 与AT2G20060(核糖体蛋白L4/L1 家族)、AT1G64880(核糖体蛋白S5 家族蛋白)、RPL4(核糖体蛋白L4)、CAO(叶绿体信号识别颗粒组分)、CPFTSY(信号识别颗粒)存在较为直接的互作关系。其中AT2G20060、AT1G64880、RPL4 是核糖体的结构成分,可以与rRNA 结合并参与蛋白质的翻译过程;CAO 可以与染色质结合,参与响应高光强、蛋白质输入叶绿体类囊体膜等过程。
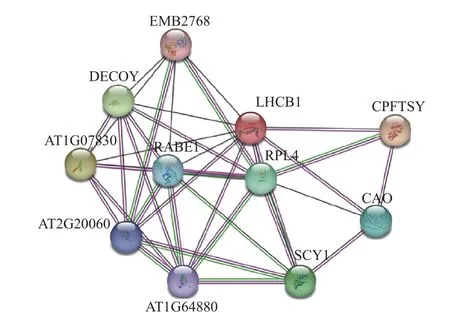
图5 LHCB1(CsLhcb1)蛋白互作预测与分析Fig. 5 Predicted and analyzed LHCB1 (CsLhcb1) protein interaction in tea plants
2.5 茶树CsLhcb1 蛋白系统进化分析
如图6 所示,依托DNAMAN 对不同植物中Lhcb1 蛋白进行同源比对,不同物种间具有高度同源性。构建系统进化树结果表明,茶树Camellia sinensisCsLhcb1 蛋白与蔓花生Arachis duranensis(XP_015953926.1)和蒂罗花Telopea speciosissima(XP_043688472.1)聚为一类,表明该蛋白在进化的过程中具有较近的亲缘关系,与番木瓜Carica papaya(XP_021894790.1)、木豆Cajanus cajan(XP_020237928.1)和澳洲坚果Macadamia integrifolia(XP_042504204.1)的蛋白进化差异最大,亲缘关系最远(图7)。

图6 茶树与其他物种Lhcb1 蛋白的多重序列比对Fig. 6 Multiple sequence alignment on Lhcb1 proteins of tea plant and other species
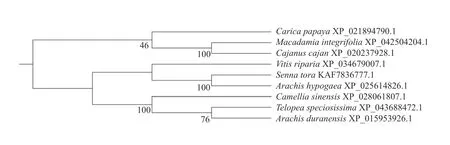
图7 茶树CsLhcb1 蛋白与其他物种Lhcb1 蛋白的系统进化树分析Fig. 7 Phylogenetic tree of CsLhcb1 protein in tea plant and Lhcb1 protein in other species
2.6 茶树CsLchb1 基因在干旱胁迫下的表达分析
干旱胁迫处理下,‘龙井43’中的CsLhcb1基因相对表达量在1 h 时达到最高值,之后逐渐下降;在‘舒茶早’中该基因相对表达量也在1 h 时达到最高值,之后下降,24 h 又上升;而‘白叶一号’中该基因的相对表达量在6 h 时达到最高值,之后下降。可以看出,干旱处理下(20% PEG)CsLhcb1基因在3 个茶树品种中表达量几乎都是降低的,‘舒茶早’与CK 的表达量相差相对较小,除3 h 和6 h 时‘白叶一号’的表达量显著高于其他品种,12 h 时略高于其他品种,其他时段均为‘舒茶早’的表达量高于其他品种。在1h 时‘舒茶早’的表达量分别为‘龙井43’和‘白叶一号’的1.49、1.6 倍;在24 h 时‘舒茶早’的表达量分别为‘龙井43’和‘白叶一号’的9.56、5.73 倍。上述结果说明,干旱胁迫影响了茶树CsLhcb1的表达,且在不同的茶树品种中表达量有差异(图8)。
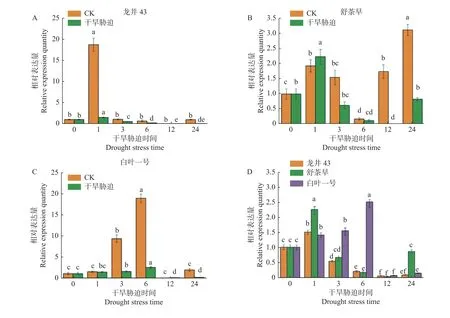
图8 干旱胁迫下茶树CsLhcb1 基因的表达量Fig. 8 Expressions of CsLhcb1 in tea plants under drought stress
3 讨论
在高等植物的叶绿体中存在着两个光系统分别是PSⅠ和PSⅡ,二者在光合作用中相辅相成,都发挥着至关重要的作用。PSⅠ具有4 种捕光色素蛋白,为Lhca1、Lhca2、Lhca3和Lhca4;PSⅡ具有3 种主要捕光色素蛋白,分别由Lhcb1、Lhcb2和Lhcb3编码,以及3 种次要捕光色素蛋白,分别由Lhcb4(cp29) 、Lhcb5(cp24) 和Lhcb6(cp26)编码[18]。在蛋白结构方面,主要捕光色素蛋白多数是三聚体,而次要捕光色素蛋白大多以单体形式存在,更靠近PSⅡ反应中心,捕光色素蛋白复合体构成PSⅡ外周捕光天线[4]。在功能方面,捕光色素蛋白复合体能够传递和捕获光能,分配和平衡PSⅡ和PSⅠ能量,光保护和过剩能量耗散,维持类囊体膜结构[19-24]。其中,Lhcb 作为光合作用中重要的功能蛋白,在类囊体膜上的含量最为丰富,其结合叶绿素约占类囊体色素的50%,形成的复合体能够迅速将光能传到PSⅠ和PSⅡ反应中心,使光能转化为化学能,促进光合作用[25]。本研究首次从茶树品种‘龙井43’中克隆得到CsLhcb1基因,生物信息分析表明:CsLhcb1基因所编码的蛋白中包括一个捕光色素蛋白复合体结构域(PLN00025)和叶绿素a/b结合蛋白结构域(pfam00504)。茶树为低光效植物,而光合效率又直接影响着茶叶的品质与产量。本研究发现,CsLhcb1 蛋白与蔓花生AdLhcb1 蛋白、蒂罗花TsLhcb1 蛋白具有高度保守性,若通过分子育种来提高茶树光合效率时,蔓花生与蒂罗花或许可以作为理想的基因供体物种之一,并为分子进化研究奠定理论基础。
干旱胁迫导致茶树生理水平发生一系列变化,如根系活力、光合作用能力及叶绿素含量下降,细胞质膜透性、丙二醛(MDA)、可溶性蛋白质及可溶性糖含量增加,多酚氧化酶 (PPO)、过氧化物酶(POD)和过氧化氢酶(CAT)等保护酶呈先上升后下降的趋势[26,27]。当植物受到干旱胁迫时,为防止蒸腾作用导致更多的水分散失,气孔会呈现一定程度的关闭,使得气孔导度下降,气孔导度的下降则导致从外界进入植物叶片细胞的CO2量也会减少,这是导致光合作用下降的重要原因。除此之外,干旱胁迫还会从多个方面影响植物的光合能力,主要包括损伤光合系统的各种机构、影响光合作用中电子的传递和光合磷酸化,以及对参与暗反应有关的酶造成影响[28]。还有研究表明,在干旱胁迫下叶绿素的含量会降低,PEG 处理下的茶树Fv/Fm和Fv/Fo明显低于CK,说明干旱胁迫直接导致了叶绿素的讲解,从而导致茶树捕获光能的效率降低[27]。本研究实时荧光定量结果显示,在CK 处理下,‘龙井43’在1 h 的表达量显著高于干旱胁迫,‘白叶一号’在3 h 和6 h 显著高于干旱胁迫,本试验在上午9 时作为第一个取样的时间段,1 h、3 h 和6 h 分别对应上午10 时、12 时和下午3 时。由于该基因还受到生物钟、温度等环境因素的调节,可能在该时段较为活跃,表达量显著高于其他时段,这也与胡志航等[29]的研究结果相符。本研究中,干旱胁迫下,茶树CsLhcb1基因表达量降低。已有研究证明,在持续干旱下,细胞需要渗透调节物质积累来调节水势,合成这些物质需要的能量来源于光合作用。捕光叶绿素a/b结合蛋白基因表达量增加可能促进植物的光合作用,这也与赵彦等[30]研究结果类似。Loukehaich 等[31]发现,在干旱胁迫下,植物通用胁迫蛋白基因(SpUSP)过表达,27 个叶绿素a/b结合蛋白基因表达量上调。Guo 等[32]以大麦为试验材料,发现不同大麦品种间叶绿素a/b结合蛋白表达有差异。据推测,在干旱胁迫下,茶树CsLhcb1基因可能通过参与光合作用的循环或调控植物对干旱胁迫的适应来发挥作用,由于光合作用的减弱,导致能量的捕获和储存受限,茶树体内积累的有机物分解供能时优先供应给相关抗逆基因的表达,可能导致茶树CsLhcb1基因的表达量降低。
4 展望
本研究克隆获得茶树CsLhcb1基因,并对该基因生物信息及其在干旱胁迫下的基因表达模式进行了初步分析。但对CsLhcb1基因是依托何种分子机制来实现基因的表达调控以及它是如何响应干旱胁迫的,这些均尚不清楚,仍需要进一步的深入探究。

