秸秆腐熟菌剂用量对土壤性质及小麦产量的影响
黄媛媛 ,黄亚丽,王艳群,宋水山,贾振华,付 鑫,彭正萍
(1.河北农业大学 资源与环境科学学院/河北省农田生态环境重点实验室,河北 保定 071001;2.河北省科学院生物研究所,河北 石家庄 050081;3.河北科技大学环境科学与工程,河北 石家庄 050018;4.华北作物改良与调控国家重点实验室,河北 保定 071001)
黄淮海是我国主要粮食产区,秸秆年产量约为2.4 亿t,其中夏玉米秸秆约占总量的40%[1]。秸秆还田是目前农作物秸秆资源利用的最主要方式。秸秆还田不仅降低土壤容重、改变土壤团粒体结构、增加土壤孔隙度、还增加土壤有机质含量,提升农田土壤基础肥力,增加农作物产量[2-3]。河北省是农业大省,采用小麦-玉米轮作方式,玉米收获后秸秆粉碎还田,但因冬季寒冷且低温持续时间长,秸秆腐解缓慢,秸秆还田效果不明显。加速土壤中玉米秸秆的腐解成为秸秆还田技术中的关键。秸秆腐熟剂是一种能够使秸秆等有机废弃物快速腐熟,并转化其中所含有机质及磷、钾等营养元素的一类微生物菌剂,主要包括真菌、放线菌及细菌[4]。有资料报道,秸秆还田施加秸秆腐熟剂加快秸秆腐熟,改变土壤微生物数量,促进土壤肥力,影响植物生长[5-7]。Han[8]等表明将外源纤维素酶加入到土壤中可提高土壤肥力并促进作物生长。魏蔚[9]等发现施入复合纤维素降解菌改善土壤生物学特性,并增加土壤养分。秸秆腐熟剂是由多种微生物菌群构成,腐熟剂菌株组成、施用量等决定了应用效果[10-11]。近年来许多学者从不同角度对秸秆还田条件下秸秆腐熟剂的菌群组成及其复配进行了一系列研究[12-13],但对秸秆还田后秸秆腐熟剂用量的研究较少。
作者前期筛选得到一株在16℃具有较强纤维素降解能力的真菌,将该真菌接入液体秸秆培养基15 d 时,秸秆降解率为40.45%(菌株保藏编号为CGMCC No.16280)[14],并将该菌制成秸秆腐熟菌剂。通过连续3 年的田间定位试验,探究秸秆腐熟菌剂用量对土壤微生物、特性及小麦产量的影响,以期在秸秆还田条件下大面积推广高效利用的腐熟剂提供科学依据。
1 材料与方法
1.1 供试材料
本试验于2017 年11 月至2020 年6 月在河北省宁晋县凤凰镇孟村原种场(E114.5°,N37.4°)进行,年均气温12.8 ℃,平均降水量449.1 mm,日照时数2 538.1 h,无霜期198 d。供试冬小麦为‘济麦22’,供试秸秆腐熟菌剂由河北省科学院生物研究所研制(肥料登记证号:微生物肥(2019)准字(7232)号),功能菌株为长枝木霉、地衣芽孢杆菌,颗粒剂,有效活菌数≥0.5 亿/g。0~20 cm 土壤基本理化性状:有机质25.35 g/kg,全氮3.91 g/kg,碱解氮80.38 mg/kg,有效磷50.89 mg/kg,速效钾132.52 mg/kg。
1.2 试验设计
在秸秆全量还田(30 000 kg/hm2)的基础上,共设4 个处理,分别为:不施用菌剂(CK),施加22.5 kg/hm2秸秆腐熟菌剂(T1)、45.0 kg/hm2秸秆腐熟菌剂(T2)、67.5 kg/hm2秸秆腐熟菌剂(T3),施用时向秸秆腐熟菌剂中加入75.0 kg/hm2尿素,与适量土充分混合后进行地表撒施,旋耕。每个处理重复3 次,共12 个小区,面积50 m2。各小区除了菌剂用量不同外,其他管理措施按照常规管理模式进行。
1.3 测定指标及方法
1.3.1 土壤样品采集和产量测定 于收获期,采集2018—2020 年土壤及小麦样品。各处理0~20 cm土壤样品,每小区采集5 钻,剔除土壤样品中可见根系,混合后装入无菌袋中密封。采集的土样一部分储于4 ℃,用于耕层土壤可培养微生物数量测定;一部分-80 ℃超低温冰箱保存用于微生物多样性测定;一部分自然风干,磨碎过1 mm 筛,用于土壤酶活性、理化性状测定。各小区取2 m 行长 6 行的小麦穗头测定产量。
1.3.2 测定方法 土壤物理指标测定:采用环刀法测定容重;采用环刀原状土吸水法测定最大持水量。土壤化学指标测定[15]:有机质采用重铬酸钾法;全氮采用重铬酸钾-硫酸消化法;有效磷采用钼蓝比色法测定;速效钾采用醋酸铵浸提火焰光度法测定。土壤酶活性测定:采用南京建成生物工程研究所试剂盒进行碱性磷酸酶、纤维素酶活性测定。土壤可培养微生物数量测定[16]:细菌和真菌分别使用LB 培养基和PDA+200 U/mL 庆大霉素培养基。
土壤微生物多样性分析:将采集样品送至上海派森诺生物科技有限公司,利用Illumina Miseq 高通量测序平台进行测序。
测产:小麦穗头风干后脱粒,称取籽粒重,采用谷物水分测定仪(PM-8188)测定其含水量,最终折合为标准含水量为12.5%的籽粒产量。
1.4 数据统计及分析
采用 Microsoft Excel 2016 软件进行数据处理和相关图表绘制,使用 IBM SPSS 22.0(Duncan)进行显著性检验,显著水平为0.05。利用QIIME 2 分析流程对土壤微生物多样性数据进行统计分析。
2 结果与分析
2.1 秸秆腐熟菌剂用量对土壤物理性质的影响
连续3 年3 种用量秸秆腐熟菌剂的土壤容重与对照相比均未达显著差异(P> 0.05)(图1A),其中第1 年施用秸秆腐熟菌剂的处理较未施用菌剂增高5%左右。随着施用年限的延长,施用秸秆腐熟菌剂处理的土壤容重呈下降趋势。第3 年时,CK 的容重高于3 个菌剂处理0.60%~1.17%。土壤最大持水量随腐熟菌剂施用年限增长呈增长趋势(图1B),第3 年时,T3 的土壤最大持水量最高为31.28%。表明施用秸秆腐熟菌剂可在一定程度上降低土壤容重,提高土壤最大持水量。
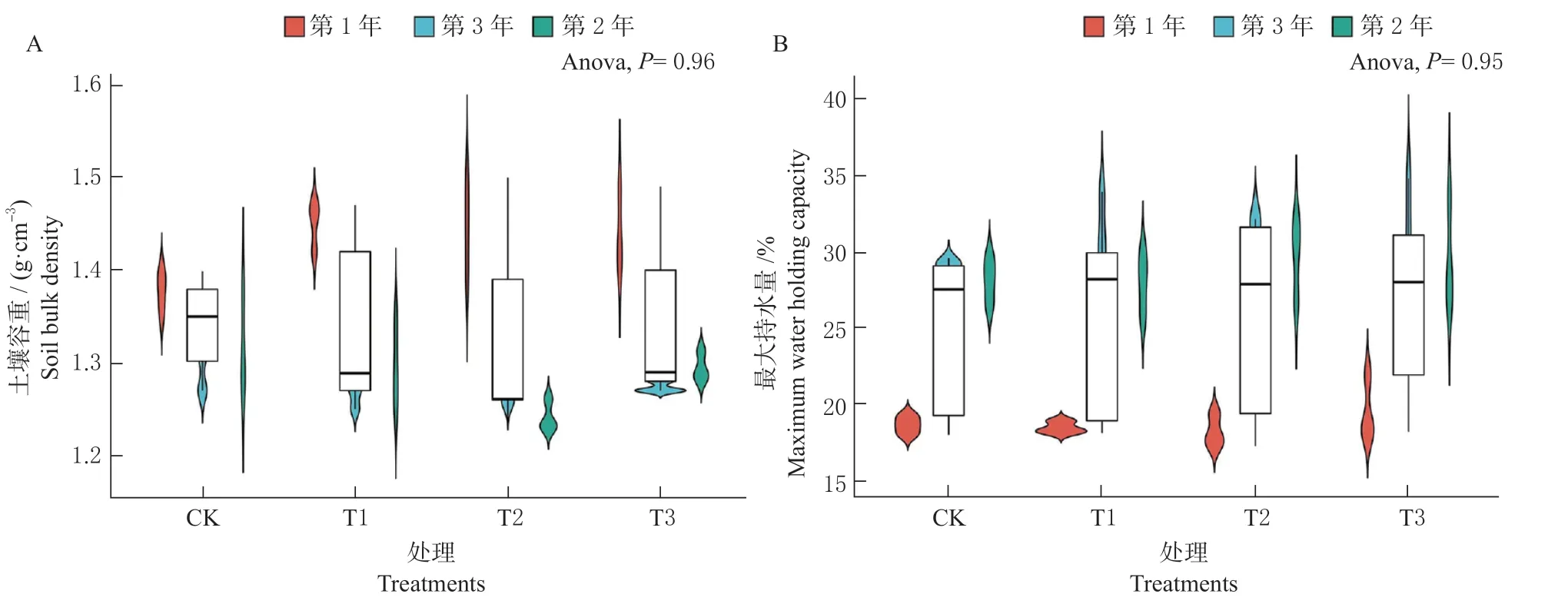
图1 秸秆腐熟菌剂用量对土壤容重(A)和最大持水量(B)的影响Fig. 1 Effects of different dosages of straw decomposition treatments on soil bulk density (A) and maximum water holding capacity (B)
2.2 秸秆腐熟菌剂用量对土壤化学性质的影响
施用菌剂第1、2 年未显著改善土壤有机质含量,第3 年时土壤有机质含量随秸秆腐熟菌剂用量增加而增加,T3 处理的土壤有机质含量最高达到26.6 g/kg(图2A)。秸秆腐熟菌剂对全氮的影响在不同施用年际间存在差异,第1 和第2 年施用秸秆腐熟菌剂的土壤全氮低于对照;第3 年T2、T3 处理的土壤全氮含量高于对照和T1(图2B)。添加秸秆腐熟菌剂对土壤有效磷有增加作用,第1 年T3 的土壤有效磷最高,且显著高于对照、T1 和T2 处理。T3 的土壤有效磷随施用年限增加而增加,第3 年土壤有效磷显著高于其他处理(图2C)。施用秸秆腐熟菌剂还增加土壤速效钾含量,秸秆腐熟菌剂处理第3年时土壤速效钾显著高于对照,以T3 的土壤速效钾最高(图2D)。说明施用秸秆腐熟菌剂可提高土壤有机质,显著提高土壤有效磷和速效钾含量。

图2 秸秆腐熟菌剂用量对土壤化学性质的影响Fig. 2 Effects of different dosages of straw decomposition treatments on soil chemical properties
2.3 秸秆腐熟菌剂用量对土壤酶活性的影响
T3 的土壤纤维素酶活性随施用年限的增加而增强,到第3 年T3 的土壤纤维素酶活性显著高出CK、T1 和T2 处理8.42%~19.34%(图3A)。施用秸秆腐熟菌剂第1 年和第2 年,对照的土壤碱性磷酸酶活性最高,而到第3 年T2、T3 的土壤碱性磷酸酶活性显著高于CK 和T1 处理(图3B)。

图3 秸秆腐熟菌剂用量对土壤酶活性的影响Fig. 3 Effects of different dosages of straw decomposition agent treatments on soil enzyme activities
2.4 秸秆腐熟菌剂用量对土壤可培养微生物菌群数量的影响
施用秸秆腐熟菌剂增加土壤细菌数量,第1年,秸秆腐熟菌剂处理的细菌数量较对照增加1.69%~5.08%。第3 年时T3 的土壤细菌数量显著高于CK、T1 和T2 处理53.89%~81.05%(表1)。随施肥年限增加CK 的真菌数量显现增加趋势,第三年时CK 的真菌数量显著高于施用秸秆腐熟菌剂处理组。土壤微生物的数量和种类受多种因素影响,施用秸秆腐熟菌剂改变土壤营养成分,使土壤微生物由真菌型向细菌型转变,使土壤微生物变得更合理。

表1 秸秆腐熟菌剂用量对土壤可培养微生物菌群数量的影响Table 1 Effects of different dosages of straw decomposition agent on the number of cultivable microorganisms in the slil
2.5 秸秆腐熟菌剂用量对土壤微生物多样性分析
2.5.1 秸秆腐熟菌剂用量对土壤细菌群落丰度的影响 稀释性曲线可以用来比较测序数量不同的样本物种的丰富度,也可以反映样品的取样大小是否合理。如图4 所示,当测序量超过50 000 条时,曲线趋于平缓,说明获得新物种的量较少测序文库已饱和。这也反映出取样数量的合理性。
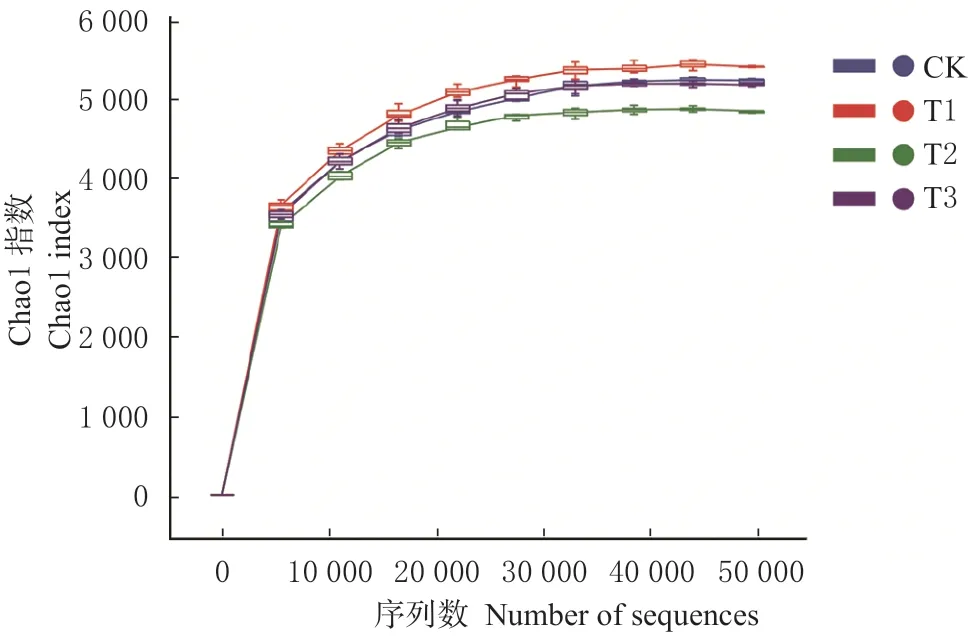
图4 样品稀释曲线Fig. 4 Rarefaction curves for samples
2.5.2 秸秆腐熟菌剂用量对土壤微生物种群分布的影响 采用Illumina 技术分析和鉴定了施用秸秆腐熟菌剂第3 年冬小麦收获期耕层土壤中的微生物菌群组成,如图5 所示。在目水平上,不同腐熟菌剂用量下相对丰度较高的菌目有根瘤菌 目(Rhizobiales)6.22%~6.56%、黏球菌 目(Myxococcales)5.83%~6.83%、小群(Subgroup_6)4.90%~5.44%、β-变形菌目(Betaproteobateriales)4.81%~5.20%,相对丰度低于5%的有微球菌目(Micrococcales)、嗜纤维菌目(Cytophagales)、Microtrichales、小单胞菌目(Micromonosporales)、芽单胞菌目(Gemmatimonadales)、黄色单 胞菌目(Xanthomonadales)。从排名前四位的优势菌群所占的百分比来看,T3 处理的粘球菌目(Myxococcales)、小 群(Subgroup_6)、β-变形菌目丰度最高。CK、T1、T2、T3 处理优势菌群所占百分比分别为26.63%、26.81%、26.33%、27.29%,说明T3 处理能更好的平衡优势菌群含量。
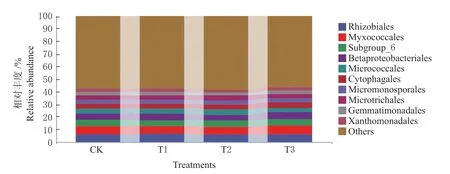
图5 秸秆腐熟菌剂用量对土壤微生物在目水平上的菌群分布图Fig. 5 Distribution barplot in order of soil microorganism under straw decomposition agent treatments
2.6 秸秆腐熟菌剂用量对小麦产量的影响
秸秆腐熟菌剂用量及施用年限对小麦产量影响不同(图 6),秸秆腐熟菌剂施用第1、2 年,小麦产量随菌剂用量增加而增加,第1 年T2、T3 分别较CK 增加5.35%和11.67%。第2 年3 种菌剂用量小麦产量增幅为6.06%~11.61%。第3 年施加腐熟菌剂处理间的小麦产量无显著差异,均显著高于对照8.23%~9.49%。3 年间施加腐熟菌剂T1、T2 和T3 处理的小麦产量分别与CK 增产5.50%、7.36%和10.44%,T3 增产明显。
3 讨论
秸秆腐熟菌剂作为一种含有纤维素降解菌群的活性微生物制剂,已成为提升秸秆还田效果的活性增效剂,其用量影响应用效果,接种量多少会影响微生物添加剂功能的有效发挥[17]。Duan 等[18]报道,在牛粪和麦秸混合物中,接种0.5%枯草芽孢杆菌制剂降低碳代谢基因丰度,减少CO2产生,而接种量增到2%后,导致CO2排放量增加。本研究发现,不同处理间的土壤容重和最大持水量年际间无显著差异,但随施用腐熟菌剂时间延长,土壤容重呈下降趋势,第3 年时土壤容重降幅7.00%~13.38%(图1A),而土壤最大持水量则呈增长趋势,第3年时施加67.5 kg/hm2秸秆腐熟菌剂处理的最大持水量最高(图1B)。这主要可能是因为秸秆还田具有增温作用,腐熟菌剂在适宜的温度下加快秸秆腐解并释放养分,促进土壤微粒的团聚,使土壤孔隙度增加,变松散,改变土壤结构,降低土壤容重,增强吸水能力[19]。本研究还发现,连续施用秸秆腐熟菌剂可改善土壤化学性质。CK 处理土壤有机质含量随施用年限增长而呈下降趋势,而施用3 种秸秆腐熟菌剂的土壤有机质含量随施用年限呈增长趋势,这可能是由于秸秆腐熟菌剂降解玉米秸秆后产生低分子量化合物,或是秸秆腐熟菌剂中微生物细胞壁残留物的积累从而使土壤有机质增长[20];第3 年时67.5 kg/hm2秸秆腐熟菌剂处理土壤有效磷、速效钾含量最大,且显著高于其他处理(图2C、2D)。秸秆在腐熟菌剂作用下,所含的磷和钾以及部分氮都释放出来供给土壤,使土壤养分含量提高[21]。
土壤酶是由土壤微生物的相互作用产生的,它参与了物质循环和能量流动,是评价土壤肥力和土壤微生物活动的一项重要指标。酶活力与植物、微生物、土壤养分有密切联系。本试验发现,连续施用秸秆腐熟菌剂提高土壤酶活性,丰富土壤可培养微生物,并提高小麦产量。T3 处理,土壤纤维素酶活性随施用年限增长而提高,第3 年时酶活最高(图3A);小麦3 年总产量为24 866 kg/hm2,显著高于其他处理2.87%~10.44%(图6)。这是因为施加的腐熟菌中长枝木霉在低温条件下具有较高的纤维素降解能力,而地衣芽孢杆菌能产生抗活性物质,抑制致病菌的生长繁殖;受此影响,土壤酶活性和微生物数量也相应增多。微生物数量增多可以进一步加速土壤养分循环,进而促进小麦生长。

图6 秸秆腐熟菌剂用量对冬小麦产量的影响Fig. 6 Effects of different dosages of straw decomposition agent treatments on winter wheat yield
此外,分析了秸秆腐熟菌剂对土壤微生物物种组成的影响。T3 处理,土壤优势菌群所占百分比最高为27.29%(图5)。优势菌群中黏球菌目多存在于有机质较丰富的环境中,分泌多种代谢物质,具有较好的抑菌效果;β-变形菌目含有丰富的固氮细菌[22],这些优势菌群的增多可提高土壤固氮能力,并提升土壤抑菌性能,进而提升土壤养分含量,有利于植株生长。
4 结论
秸秆还田配施腐熟菌剂不同程度地提高土壤氮、磷和钾养分含量、提升土壤酶活性,丰富土壤微生物细菌含量,提高土壤微生物多样性丰度,增加小麦产量,但秸秆腐熟菌剂不同施用量配施效果存在差异。综合土壤理化性质、酶活性、小麦产量,小麦-玉米轮作体系下秸秆全量还田配施67.5 kg/hm2秸秆腐熟菌剂效果较佳。

