环状RNA hsa_circ_0006834可作为肝细胞癌患者预后的潜在生物标志物
张 铃,赵春雨,许瑶瑶,陈炎森,蔡志雄,林浩伟,蔡巧燕
1 福建中医药大学中西医结合研究院,福建 福州 350122;2福建省中西医结合老年性疾病重点实验室,福建福州 350122;3福建中医药大学中西医结合学院,福建 福州 350122;4福建医科大学孟超肝胆医院,福建 福州350000
肝细胞癌(HCC)死亡率位列癌症相关死亡的第4 位,尤其在中国,年发病率约占世界总发病率的55%[1,2]。尽管近年来HCC的治疗取得了不断的进展,但由于HCC的复发和转移率高,HCC患者的预后仍然很差,5年生存率不超过25%[3]。早诊早治是提高HCC预后的关键手段。在过去的肝癌临床诊疗中,许多生物标志物,如甲胎蛋白(AFP)、甲胎蛋白晶状体凝集素3(AFP-L3)、脱-γ-羧基凝血酶原(DCP)等已被广泛应用[4];也有对手术中切除的HCC组织标本进行p53等分子的免疫组织化学检测,以期判断预后[5]。但这些分子的敏感度、特异度不高,预后判断效果并不理想。因此,挖掘高灵敏和高特异性的新型的生物分子标志物对提高HCC治疗效果的诊断率和改善患者预后具有重要意义。
环状RNA(circRNAs)一直被认为是mRNA错误剪接而形成的副产物,不具有生物学功能[6]。随着高通量测序技术和生物信息学的发展,circRNAs作为新兴分子,近年来越来越受关注,其生物学功能和分子机制被逐渐揭示[7-9]。circRNAs是一类在生物学功能上具有重要作用的新型非编码RNA,具有共价闭合的环状结构,没有5'端帽子和3'端多聚A尾,因此具有很高的稳定性和抗外切酶的能力[10]。与miRNAs和长链非编码RNA相比,circRNAs在哺乳动物细胞中表现出更高的稳定性、组织特异性和序列保守性,且广泛存在于肿瘤组织、血液及其他体液中[11]。因此,可作为理想的全新的生物学标记物应用于恶性肿瘤的早期诊断及预后评估。目前越来越多的研究表明circRNAs参与调控HCC的发生发展,包括细胞生长、转移、凋亡等[12-14]。例如,环状RNA-ABCB10通过吸附海绵miR-340-5p/miR-452-5p 来上调NRP1/ABL2,从而抑制HCC 进展[15]。circ-BACH1(hsa_circ_0061395)通过调控HuR来抑制p27,从而促进HCC 的生长[16]。有研究证实,circRNA SMARCA5通过与miR-17-3p 和miR-181b-5p 相互作用抑制HCC 细胞的增殖和迁移,而且circRNA SMARCA5下调与HCC患者的侵袭性肿瘤特征以及不良生存状况显著相关[17,18]。circ_0008450可通过调节miR-548p促进HCC细胞的增殖、侵袭和迁移,抑制细胞凋亡[19]。然而,大部分circRNAs 在HCC中的功能及与临床特征、预后相关性仍未见报道。本研究首先对56例HCC组织和其配对的癌旁组织进行高通量测序,发现了一个新的环状RNA hsa_circ_0006834 在HCC组织中表达显著降低,目前在HCC中的功能尚未见报道。本研究进而探讨其表达与HCC临床特征及预后的相关性,分析其在诊断和预后评估中的临床应用价值,为HCC预后新型临床标志物的筛选提供研究基础,为HCC的转移预测和预后判断提供理论依据。
1 资料和方法
1.1 临床样本
本项目中原发性HCC样本及其所对应匹配的癌旁样本的收集均来自本医院。本研究患者在手术前均没有接受化疗或放射治疗。本项目中用到的组织样本已获得医院伦理委员会的批准(批准号:2022-014-01),且已取得患者书面的知情同意书。研究方法符合《赫尔辛基宣言》规定的标准。
1.2 差异circRNAs的筛选及鉴定
对56对HCC组织及其癌旁组织的RNA转录组数据(illumina测序平台)进行circRNAs预测及表达情况分析。本研究相关原始测序数据已存入Genome Sequencing Achieve数据库(GSA,https://hgdc.cncb.ac.cn/gsa),登录号为HRA000464。相关测序数据采用R语言的limma包[20],基于HCC组织及其癌旁组织中的改变倍数变化(改变倍数≥2,P<0.05)筛选差异表达的circRNAs,并通过火山图鉴定出在HCC组织和其配对的癌旁组织中表达差异具有统计学意义的circRNAs。
1.3 总RNA提取
使用TransZol Up Plus RNA Kit试剂盒(北京全式金,ER501),按照说明书进行操作,50~100 mg组织加入1 mL的TransZol Up,混匀、室温静置5 min。每使用1 mL TransZol Up加入200 μL的氯仿,剧烈震荡30 s后室温放置3 min,4 ℃,10 000g离心15 min,样品分成3层,取500 μL上层水相至新的离心管,加入500 μL无水乙醇混匀。转移至RNASpin Column离心柱中,12 000g离心1 min后弃掉收集管中的废液。用500 μL CB9和WB9各洗2遍,12 000g室温离心2 min,去掉残余的乙醇。将离心柱放入新的离心管中,加入30 μLRNAse-free水溶液室温静置1 min,12 000g离心2 min洗脱RNA,测定RNA的浓度及纯度。
1.4 RNA逆转录
使用逆转录试剂盒(Roche)进行逆转录,步骤如下,第1步:取1 μg总RNA加入2 μL Random Hexamer Primer,再用ddH2O 补齐至13 μL。于PCR 仪上反应65 ℃,10 min,立即置于冰上冷却。第2步:上步13 μL体系加 入4 μL Transcriptor Reverse Transcriptase Reaction Buffer(5×),2 μL Deoxynucleotide Mix,0.5 μL Protector Ranse Inhibitor(40 U/μL),0.5 μL Transcriptor Reverse Transcriptase(20 U/μL),总体积为20 μL,再置于PCR仪中,25 ℃10 min,50 ℃1 h,85 ℃5 min,4 ℃放置1 h。
1.5 实时定量聚合酶链反应(RT-qPCR)
使用SYBR Green PCR试剂盒(Takara)在ABI StepOne Software v 2.3热循环系统中进行RT-qPCR。设置扩增和溶解曲线反应条件,扩增条件:95 ℃预变性1 min,然后95 ℃5 s;56 ℃30 s;72 ℃30 s,共40个循环。溶解曲线条件:95 ℃15 s;60 ℃,1 min;95 ℃15 s;60 ℃15 s。根据RT-qPCR测得的Ct值,相对RNA表达量计算采用2-ΔCt方法,18 s rRNA 作为内参对照。18s rRNA 引物序列为:5'-AGAAACGGCTACCACATCCA-3'(正义);5'-CACCAGACTTGCCCTCCA-3'(反义),由上海生工生物工程有限公司合成。
1.6 引物设计
将hsa_circ_0006834 的序列从剪接位点(backsplice)处打开为线性序列,截取3'端100~200 bp长度序列置于5'端头部,形成一个新的序列。将新的序列复制到primer 5.0 软件中,然后按照常规PCR引物设计原理,跨剪接位点上下游进行设计,最终扩增产物必须包含剪接位点。
1.7 一代测序验证
采用Sanger 测序法测定hsa_circ_0006834 的RTqPCR 扩增产物。hsa_circ_0006834 引物序列为:5'-ATATGTTGGATTCAGGAGCTTGTC-3'(正 义);5'-GTCATTCAGTGCTTGGGATGT-3'(反义),由上海生工生物工程有限公司合成。
1.8 统计学分析
采用SPSS 19.0进行统计分析,数据以均数±标准差表示,采用t检验进行两组间的差异分析,采用卡方分析检验hsa_circ_0006834 与患者临床特征的相关性。单因素分析和多因素分析采用Cox比例风险模型进行,计算风险比(HR)和95%置信区间(95%CI)。生存分析比较利用Kaplan-Meier法绘制,并采用log-rank法进行假设检验。AUC面积基于受试者工作特征曲线(ROC曲线)进行计算。P<0.05时认为差异具有统计学意义。
2 结果
2.1 筛选在HCC 组织及其癌旁组织中差异表达的circRNAs
基于56 对HCC 组织及其癌旁组织进行RNA 测序,筛选circRNAs差异表达谱,结果显示:从火山图鉴定出,在HCC组织及其癌旁组织中具有显著差异表达的circRNAs有62个,其中在HCC组织中显著上调的circRNAs有17个,显著下调的circRNAs有45个(改变倍数≥2,P<0.05,图1A)。进一步分析显示这些circRNAs在HCC组织及其癌旁组织中存在显著性差异表达(图1B)。
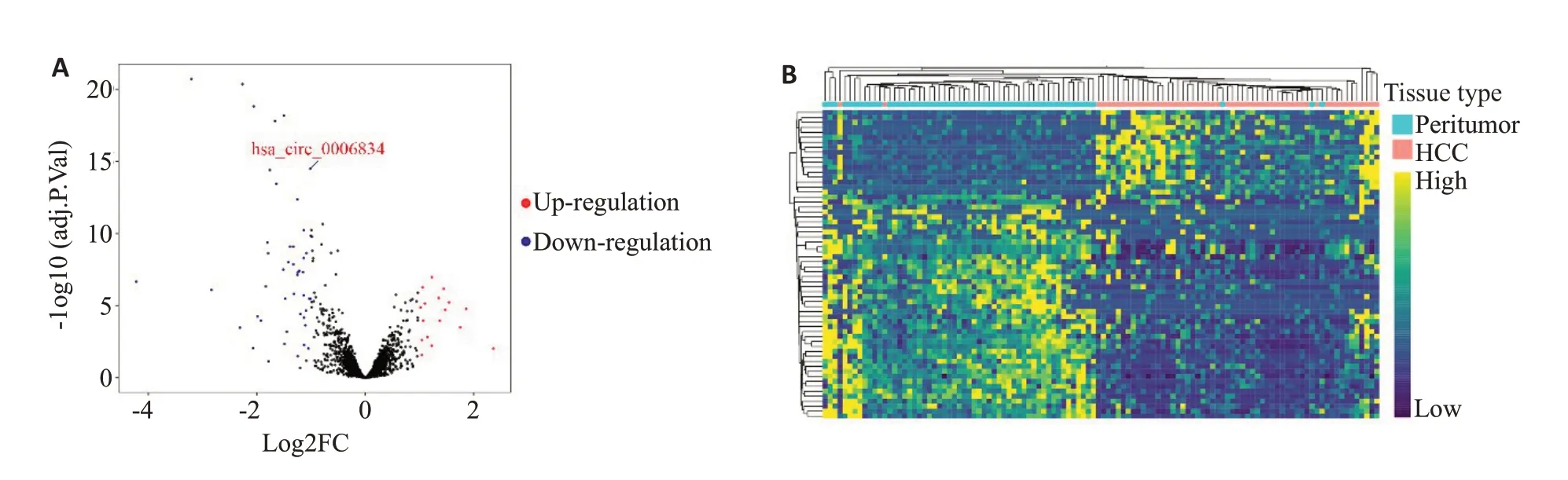
图1 筛选在HCC组织及其癌旁组织中差异表达的circRNAsFig.1 Screening of differentially expressed circRNAs in HCC tissues compared with the paired adjacent tissues.A:Volcano plot of the significantly up-regulated and down-regulated circRNAs in HCC tissues.B:Heat map of the circRNAs with significantly different expression patterns in HCC tissues and adjacent tissues.
2.2 hsa_circ_0006834在HCC组织及其癌旁组织中的表达情况
hsa_circ_0006834 在HCC 组织中表达显著下调(P<0.001,图2A)。通过RT-qPCR在另外15对HCC患者的HCC组织和配对的癌旁组织中进行验证,结果表明,与癌旁组织相比,hsa_circ_0006834在HCC组织中显著低表达(P<0.001,图2B)。基于此,通过一代测序确认在HCC样本中hsa_circ_0006834的存在。通过使用hsa_circ_0006834的背向引物扩增其特有的环化位点,其一代测序序列与二代数据库中的测序数据一致(图2C)。
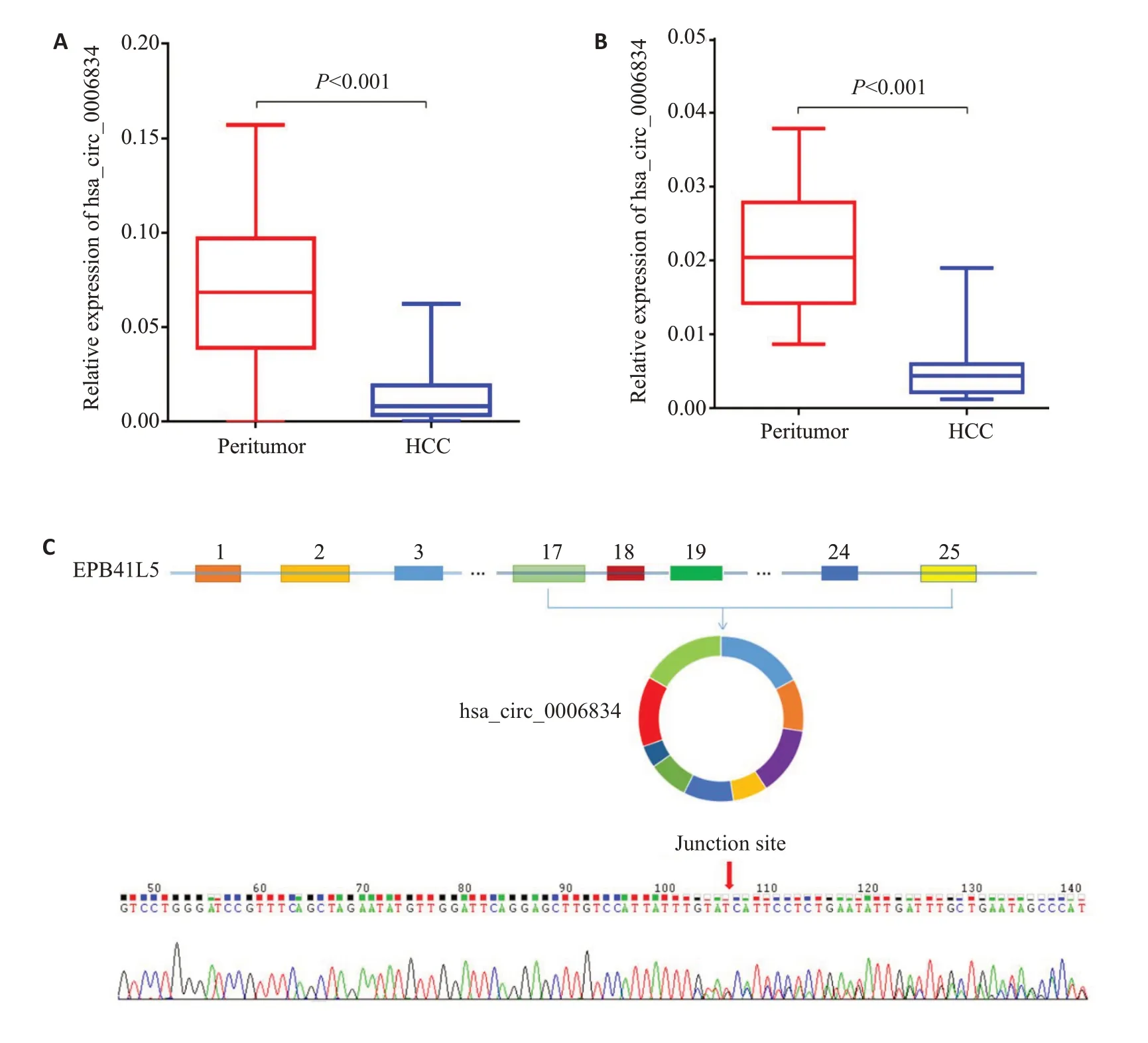
图2 hsa_circ_0006834在HCC组织及其癌旁组织中的表达情况Fig.2 Expression of hsa_circ_0006834 in HCC and adjacent tissues.A:hsa_circ_0006834 expression in 56 pairs of HCC and adjacent tissues.B: Expression of hsa_circ_0006834 in another 15 pairs of HCC and adjacent tissues.C: One-generation sequencing to verify the expression of hsa_circ_0006834 in HCC samples.
2.3 hsa_circ_0006834的表达与HCC患者临床特征的相关性
基于hsa_circ_0006834在HCC组织中表达量的四分位数将56例HCC患者分为高表达组(3/4)和低表达组(1/4),结果显示:HCC 中hsa_circ_0006834 的低表达与血管侵犯(P=0.029)和巴塞罗那(BCLC)分期(P=0.010)等异常状态呈显著负相关,而与其他临床特征没有显著相关性(表1)。
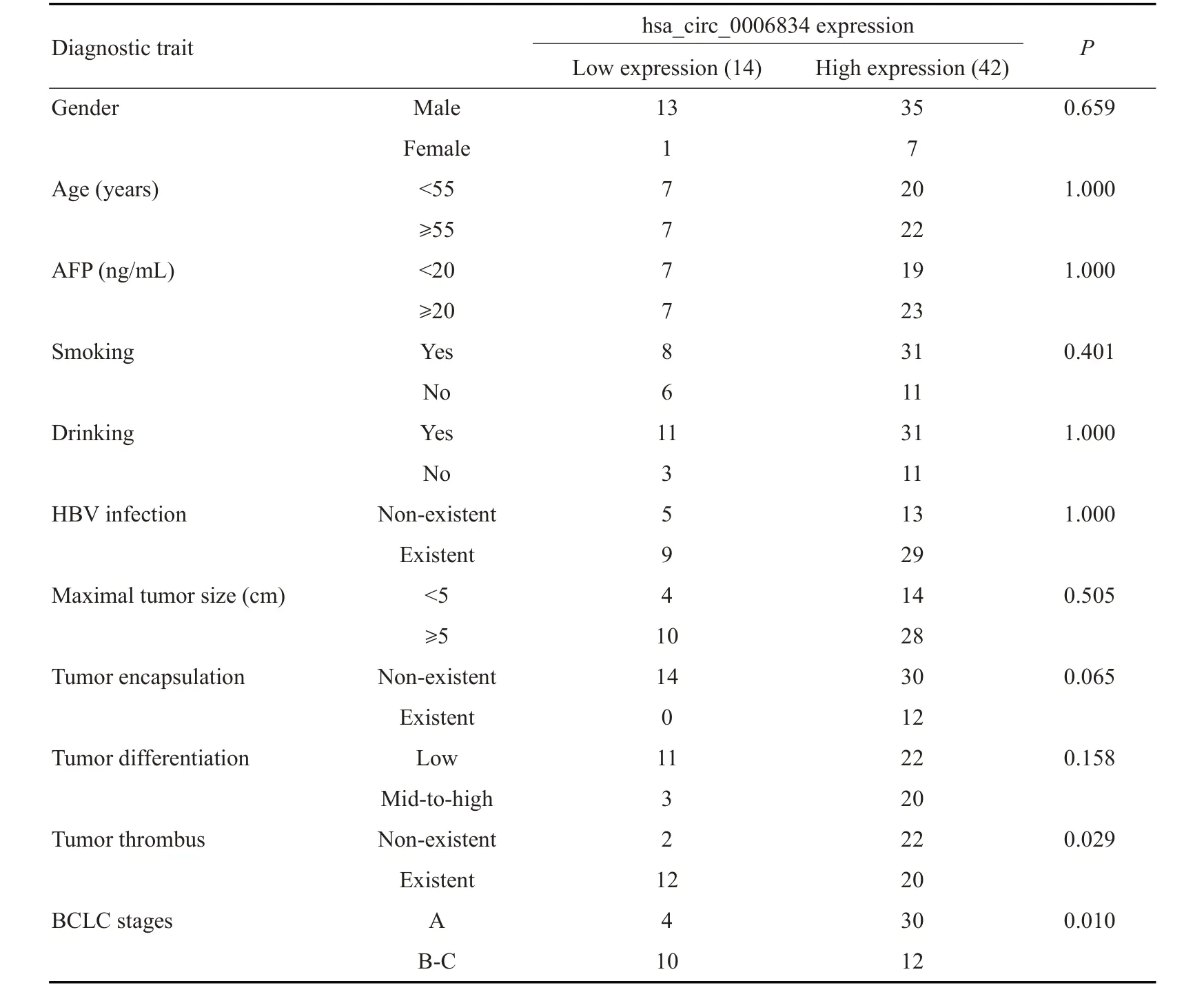
表1 hsa_circ_0006834的表达与HCC患者临床特征的相关性Tab.1 Correlation of hsa_circ_0006834 expression with clinical features of HCC patients
2.4 hsa_circ_0006834的表达与HCC患者预后的相关性
Cox多因素比例风险模型显示,hsa_circ_0006834的低表达是HCC 患者根治性切除后无复发生存期(P=0.014)和总体生存期(P=0.031)的独立不良预后因素(表2)。Kaplan-Meier 分析显示,在HCC 组织中hsa_circ_0006834表达高的患者具有较高的无复发生存期(P=0.0066)和总体生存期(P=0.0021),而hsa_circ_0006834表达低的HCC患者无复发生存期及总体生存期均显著下降(图3A、B)。进一步分析hsa_circ_0006834的表达预测肝癌病人2年无复发生存期和2年总体生存期的时间依赖性ROC曲线,结果显示,其预测无复发生存期和总体生存期的AUC 面积分别达到了0.750 和0.7601(图3C、D),具有良好的预后评估效能。
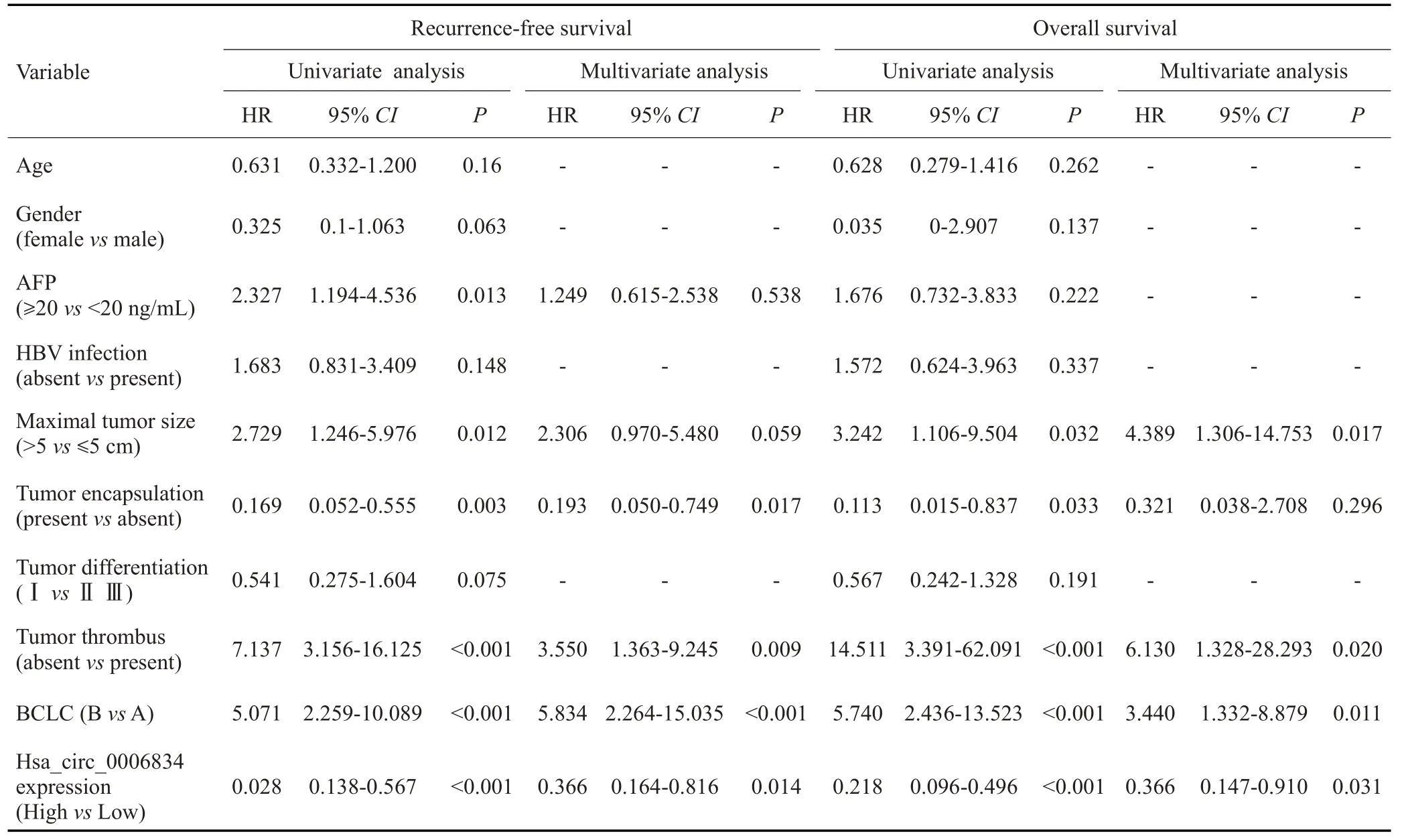
表2 56例HCC患者生存相关因素的单因素和多因素分析Tab.2 Univariate and multivariate analyses of survival associated factors in 56 HCC patients
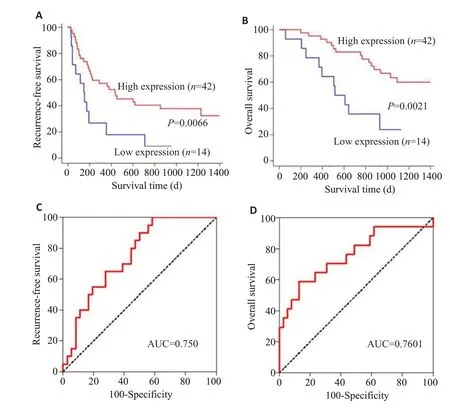
图3 hsa_circ_0006834的表达与HCC患者预后的相关性Fig.3 Correlation of hsa_circ_0006834 expression with prognosis of HCC patients.A: Correlation of hsa_circ_0006834 expression with recurrence-free survival in HCC patients.B:Correlation between hsa_circ_0006834 expression and overall survival of HCC patients.C:ROC curve of hsa_circ_0006834 expression for predicting 2-year recurrence-free survival in HCC patients.D: ROC curve of hsa_circ_0006834 expression for predicting 2-year overall survival in HCC patients.
3 讨论
越来越多的研究表明,circRNAs可能以不同的表达方式参与HCC的发生发展,且在肿瘤组织中表达异常的circRNAs通常与肿瘤患者的临床结果具有密切相关性[10]。同时,circRNAs由于稳定性高、表达特异性、功能多样等优点,具有成为肿瘤早期诊断和预后评估的新型分子标志物的潜力[21,22]。已有报道circC3P1在HCC组织中表达水平显著下调,且与HCC的TNM分期,肿瘤大小和血管侵袭呈负相关[23];hsa_circ_0091579的表达量与HCC患者的较差总体存活期密切相关[24]。然而,大部分circRNAs 在HCC中的功能及与临床特征、预后相关性仍未见报道。为了筛选出可能作为HCC患者预后评估的新型生物标志物,我们利用RNA测序技术分析56对HCC组织及其癌旁组织的circRNA表达谱,筛选出在HCC中异常低表达的hsa_circ_0006834,并进一步在另外15对HCC组织和配对的癌旁组织中进行了验证,结果仍表明hsa_circ_0006834在HCC组织中显著低表达,可以有效区分HCC患者的肿瘤组织与癌旁组织。
hsa_circ_0006834 是由位于2 号染色体上EPB41L5基因的第17~25个外显子反向拼接而成,全长为958个核苷酸。有研究发现hsa_circ_0006834在非小细胞肺癌(NSCLC)组织中低表达,这与本研究的结果一致。而且NSCLC中的hsa_circ_0006834表达水平与淋巴结转移、TNM分期呈负相关[25]。然而hsa_circ_0006834在HCC中的功能及与肝癌发生发展、预后的关系尚未见报道。因此,本研究进一步探讨了hsa_circ_0006834与HCC患者临床特征的相关性,结果表明其表达与HCC的血管侵犯、BCLC分期等异常状态呈显著负相关。
HCC由于具有高发病率和高转移率,且其5年生存率仍然很低的特点[26,27],迫切需要潜在的生物标志物来预测预后。因此,我们进一步分析了hsa_circ_0006834与HCC患者的预后的相关性。通过Cox比例风险模型和Kaplan-Meier分析评估hsa_circ_0006834对无复发生存期和总体生存期的影响,结果发现hsa_circ_0006834的表达与HCC患者的无复发生存期和总体生存期呈显著正相关,是影响患者预后不良的独立危险因素。ROC曲线分析结果显示,hsa_circ_0006834预测无复发生存期和总体生存期的AUC 面积分别达到了0.750和0.7601,具有良好的预后评估效能。提示其作为HCC患者生物标记物有良好的准确性、特异性和敏感性,可能具有较好的临床应用价值。本研究还显示,肿瘤包膜和肿瘤大小也可分别作为HCC患者根治性切除后无复发生存期(P=0.017)和总体生存期(P=0.017)的独立不良预后因素。已有报道显示肿瘤包膜和肿瘤大小对肝癌预后密切相关,当病灶较大时会增加机体损伤与术后并发症风险,影响患者预后[28,29]。因此,现代影像学技术和hsa_circ_0006834 检测的联用,有望提高HCC患者预后的判断。
目前,circRNAs的研究正处于起步阶段,主要侧重于表达和诊断,在HCC 中的具体机制并不十分清楚。已有研究表明circRNAs能作为亲本基因的转录调控因子,与RNA聚合酶Ⅱ相互作用,从而影响亲本基因的转录水平[30];circRNAs 通过招募相关蛋白,可作为lncRNA、mRNA等RNA稳定性的调节剂[31];circRNAs能够特异性吸附miRNA,调控其下游靶基因的活性[32];circRNAs还与RNA结合蛋白(RBP)相互作用,调节其功能或充当复合物组装的支架分子等[33]。已有研究表明,hsa_circ_0006834 通过与miR-873-5p 结合发挥ceRNA 作用,以及结合AHNAK 蛋白抑制非小细胞肺癌的恶性进展[25]。然而对于hsa_circ_0006834是否能与miR-873-5p 或其他miRNA结合发挥ceRNA 作用,亦或是结合相关的RBP等,进而抑制HCC的发生发展目前并未被报道,后续将进一步深入探讨。
综上所述,hsa_circ_0006834在HCC中表达降低,其低表达水平是患者预后不良的独立危险因素。但由于本研究的样本量有限,研究的相关结果仍需在多中心、大样本的临床实验中验证。后续我们还将进一步探讨hsa_circ_0006834 是否通过ceRNA 作用或其他机制,进而在调控HCC细胞增殖、凋亡、迁移、侵袭和血管新生等方面发挥作用的具体分子机制,以明确其在HCC发病过程中的作用,使其成为患者良好的预后预测指标和潜在的治疗靶点。
- 南方医科大学学报的其它文章
- 尿路上皮癌抗原1促进滋养细胞功能及对上皮-间质转化转化的调控作用
- Brain iron deposition increases in the bilateral substantia nigra of patients with medication-overuse headache: a quantitative susceptibility mapping analysis
- 益肺散结丸缓解小鼠癌因性骨骼肌萎缩的作用
- 慢性间歇性低氧大鼠肾组织差异蛋白的定量分析:基于TMTPRM技术
- 不同滴度MOG-IgG 抗体在MOG 抗体相关疾病中的诊断和临床意义:一项单中心回顾性研究
- 粪便蛋白Luminex液相芯片检测系统构建及其对结直肠肿瘤早期诊断的价值