益肺散结丸缓解小鼠癌因性骨骼肌萎缩的作用
吴迎朝,左谦,罗薇1,,王慧,皮大锦,陈前军,陈利国,林丽珠,欧阳明子
1广州中医药大学第二临床医学院,广东 广州 510405;2广州中医药大学第二附属医院中医证候全国重点实验室,广东 广州 510120;3广东省中医院乳腺科,广东 广州 510120;4广东省中医药科学院,广东 广州 510120;5暨南大学中医学院,广东 广州 510632;6广州中医药大学第一附属医院肿瘤中心,广东 广州510405
2020年全球新发癌症数高达1930万例[1]。癌症往往伴随着多种不良症状,如疼痛、消瘦、疲乏等[2-4],严重影响癌症患者的生活质量。消瘦是癌症患者最常见的症状之一,据统计,69%的癌症患者早期可见明显的体质量下降[3],骨骼肌萎缩是导致癌症患者消瘦的主要原因[5]。然而,其病因至今尚未完全阐明,这可能与炎症、能量代谢、心理因素等有密切关系[6-8]。有研究表明,持续的炎症微环境浸润会导致组织出现胰岛素抵抗,进而影响组织对葡萄糖的吸收利用,最终导致组织出现代谢障碍性损伤[9]。持续的炎症微环境对肿瘤的发生发展起着重要的作用,但炎症性胰岛素抵抗是否导致骨骼肌萎缩,及其具体的作用机制尚未被揭示和报道。
基于“益气除痰法”组建的益肺散结丸,是广州中医药大学第一附属医院肿瘤中心主任林丽珠教授在肺癌“痰、瘀、毒、虚”中医基本理论指导下创制的治疗肺癌的基本经验方[10],该方由猫爪草、炒僵蚕、肿节风、山慈菇、浙贝母、法半夏、灵芝、西洋参八味中药组成;全方体现了标本兼治的思想,诸药共奏益气除痰、解毒散结之功。前期临床观察性研究显示,以益气除痰法为组方指导的中医药对改善晚期非小细胞肺癌(NSCLC)患者的生存质量、体力状况、体质量等方面均有较好的临床效果[11]。此外,在前期的实验性研究中,已经证实益肺散结丸可以降低荷瘤小鼠血清促炎因子的水平和缓解荷瘤小鼠肌肉的损伤[4,12],但肿瘤性炎症与肌肉损伤两者之间的内在联系尚未被报道以及益肺散结丸在其中的保护机制暂未有研究,因此有必要深入探讨益肺散结丸防治癌因性骨骼肌损伤的作用机制,为进一步应用中医药手段防治癌症及其不良反应提供理论依据。
1 材料和方法
1.1 实验动物
1.2 药物
益肺散结丸(YFSJ),药物组成比例:猫爪草15 g、炒僵蚕10 g、肿节风10 g、山慈菇10 g、浙贝母10 g、法半夏10 g、灵芝10 g、西洋参10 g,剂型为中药丸剂(水丸),规格为8 g/袋,每袋相当于饮片16.84 g,购于广州中医药大学第一附属医院,备案号为粤药制备字Z20190015000,产品批号为20200101。
1.3 细胞培养
小鼠Lewis肺癌细胞由广州中医药大学林丽珠教授课题组提供,细胞在含10%胎牛血清、100 U/mL青霉素和100µg/mL链霉素的DMEM培养基中培养,置于含5%CO2的三气培养箱中,在37 ℃潮湿环境下恒温培养。每72 h更换1次培养基,待细胞生长密度达到90%时进行常规传代培养,采用对数生长期的细胞进行后续实验。
1.4 动物模型的建立、分组与给药
动物建模方法参照既往文献报道[13]和团队前期研究[12]。将24只ICR小鼠适应性喂养1周,按体质量随机取8只设为正常组,其余16只小鼠分别给予腹腔注射小鼠1×106个Lewis肺腺癌细胞建立荷瘤小鼠模型,注射肺腺癌细胞3 d后,将16只荷瘤小鼠随机均分为2组:模型组和益肺散结丸治疗组(YFSJ组)。分组后开始干预治疗,益肺散结丸治疗剂量参考团队前期研究确定的最佳给药剂量[4,12,14],正常组和模型组予以生理盐水灌胃处理(20 mL·kg-1·d-1),益肺散结丸治疗组予以益肺散结丸生理盐水溶液灌胃处理(4 g·kg-1·d-1,20 mL/kg),共治疗3周。从治疗开始后,每周测量并记录小鼠体质量。
1.5 小鼠前肢握力试验
治疗开始后,每周通过大小鼠抓力测试仪对小鼠前肢力量进行测定,每次测试单只小鼠重复进行3次,结果取平均值。
1.6 小鼠处死和样品收集
在小鼠给药治疗和前肢握力试验全部完成后,用戊巴比妥钠(50 mg/kg,腹腔注射)麻醉小鼠,收集全血后颈椎脱臼处死,立即切除双侧腓肠肌称重,并合理保存样品进行后续实验。
1.7 Q-Orbitrap高分辨液质联用
收集全血后置于4 ℃静置过夜,离心收集血清后立即置于-80 ℃保存,干冰运输,基于Q-Orbitrap高分辨液质联用对血清中化学成分的鉴定及数据分析过程由武汉赛维尔生物科技有限公司完成,并结合课题组前期研究结果[12]进行后续分析。
并购后的规模:在蒙牛向雅士利发出收购要约之后,在2013年8月13日,要约截止日之前,蒙牛完成了对雅士利的收购,持股比例达到89.82%。在并购之后,依旧保持雅士利的独立运营平台。
1.8 血清血糖和胰岛素浓度测定
使用小鼠血糖ELISA试剂盒(科艾博生物)和小鼠胰岛素ELISA试剂盒(北京索莱宝),按照试剂盒说明书的检测步骤,检测小鼠血清中血糖和胰岛素的含量。
1.9 组织切片病理染色
1.9.1 HE染色 新鲜腓肠肌组织用4%多聚甲醛固定24 h,修块、脱水、石蜡包埋、连续切片机切片(4 μm厚度),制作石蜡切片。二甲苯、梯度酒精脱蜡,苏木素染色5 s,1%盐酸-酒精分色25 s,伊红染色5 s,梯度酒精、二甲苯脱水,中性树胶封片静置风干。光镜下选取同一层级组织观察结构变化。
1.9.2 透射电子显微镜(TEM)染色 新鲜腓肠肌组织用2.5%戊二醛浸泡固定4 h,然后用0.01 mol/L的PBS漂洗3次,15 min/次,1%锇酸浸泡固定2 h,0.01 mol/L的PBS漂洗干净,再经进行丙酮梯度脱水,Epon812浸脂,树脂包埋,按37 ℃(6 h)、45 ℃(12 h)和63 ℃(24 h)的顺序进行聚合,制成电子显微镜标本。70 nm超薄切片,常规醋酸双氧釉和枸橼酸铅染色,透射电子显微镜观察各组腓肠肌各层的超微结构。
1.9.3 免疫组织化学染色 使用上述方法制作石蜡切片。二甲苯、梯度酒精脱蜡,将玻片放入抗原修复液中进行抗原修复,PBS冲洗3次,5 min/次,滴加一抗:F4/80抗体(CST,1∶250稀释),CD80抗体(武汉三鹰生物技术有限公司,1∶150稀释),CD206抗体(CST,1∶400稀释),P-AKT(Ser473)抗体(CST,1∶50稀释),4 ℃冰箱过夜,次日PBS冲洗3次,5 min/次,滴加二抗,37 ℃温箱孵育40 min,取出使用PBS 冲洗3 次,5 min/次,DAB 染色1 min,自来水冲洗3 min,苏木精复染10 s,自来水冲洗,进行梯度酒精及二甲苯浸泡各5 min,中性树胶封片。光镜下选取同一层级组织观察结构染色变化。
1.9.4 过碘酸雪夫(PAS)染色 使用上述方法制作石蜡切片。1%过碘酸氧化15 min,冲洗4 min;PAS 染色30 min,注意避光,水洗;氨水处理后流水冲洗;梯度乙醇脱水,中性树胶封片静置风干。光镜下选取同一层级组织观察结构染色变化。
1.9.5 油红O 染色 新鲜腓肠肌组织置于-80 ℃快速冰冻,冰冻切片机切片(厚度15 μm),制作冰冻切片。滴加50%油红O染色液0.5 mL,染色10 min后弃去染液,用0.01 mol/L的PBS溶液清洗10次,5 min/次;苏木精复染1 min后弃去染色液,再次用0.01 mol/L的PBS溶液清洗10次;最后使用65%甘油封片。光镜下选取同一层级组织观察结构染色变化。
1.9.6 腺苷三磷酸(ATP)酶染色 使用上述方法制作冰冻切片。使用ATPase染色液(钙钴法)(尚宝生物),按照试剂盒说明书的检测步骤,对小鼠腓肠肌进行染色,酶所在阳性部位显示出黑色硫化钴沉淀。
1.10 转录组学测序分析
新鲜腓肠肌组织立即置于液氮中冷冻保存,干冰运输,转录组学测序由北京诺禾致源科技股份有限公司负责完成,后续数据分析及绘图均在诺禾云平台进行。
1.11 生化指标检测
1.11.1 炎症因子检测 使用小鼠IL-6 ELISA试剂盒(联科生物)和小鼠TNF-α ELISA试剂盒(联科生物),按照试剂盒说明书的检测步骤,检测小鼠血清和腓肠肌中IL-6和TNF-α的含量。
1.11.2 肌肉损伤指标检测 使用肌酸激酶(CK)活性检测试剂盒(北京索莱宝)、乳酸脱氢酶(LDH)活性检测试剂盒(北京索莱宝)和小鼠肌红蛋白(MYO/MB)ELISA检测试剂盒(江莱生物),按照试剂盒说明书的检测步骤,检测小鼠腓肠肌中CK、LDH和MYO/MB的含量。
1.12 统计学方法
利用SPSS 13.0 版本软件进行数据分析,利用GraphPad Prism 9软件进行数据的图像化。结果以均数±标准差表示,重复观察的实验数据组间比较采用重复测量方差分析进行分析,其余数据采用单因素方差分析进行分析;P<0.05为差异有统计学意义。
2 结果
2.1 益肺散结丸入血成分分析
模型组和益肺散结丸治疗组小鼠血清样本的化学成分鉴定总离子流图(图1A、B)。模型组小鼠血清在mzCloud数据库中共匹配到233个化合物,去除重复化合物后确定227种化合物;益肺散结丸治疗组小鼠血清在mzCloud数据库中共匹配到235个化合物,去除重复化合物后确定227种化合物。通过对比模型组和益肺散结丸治疗组小鼠血清的化学成分,发现有62种成分只存在于益肺散结丸治疗组小鼠血清中(图1C)。结合课题组前期研究结果,发现62种只存在于益肺散结丸治疗组小鼠血清中的成分中,11种为益肺散结丸的成分,分别是己内酰胺、5-羟基吲哚-3-乙酸、N-羟乙酰神经氨酸、十二烷基硫酸盐、6-羟基己酸、3-苯基乳酸、D-(+)-麦芽糖、诺卡酮、5-(十四烷基氧)-2-糠酸(TOFA)、去氧苯巴比妥和美沙比妥。
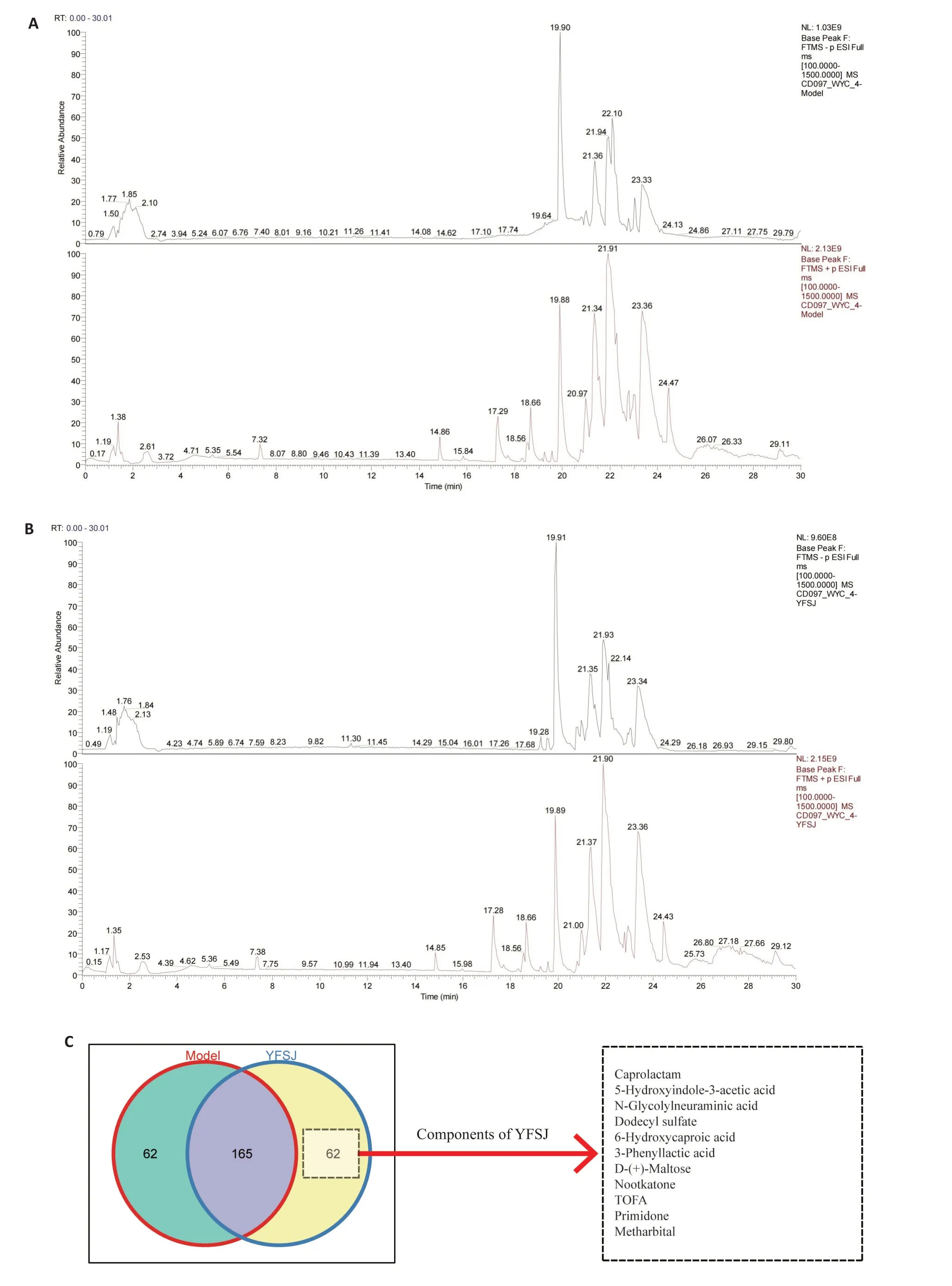
图1 益肺散结丸入血成分鉴定Fig.1 Identification of the components of YFSJ entering the blood using liquid chromatography-mass spectrometry(LC-MS).A:Serum total ion current chromatogram in the model group.B:Serum total ion current chromatogram in YFSJ group.C:Results of Venn diagram difference analysis of chemical composition between the serum of the model mice and YFSJ-treated mice and the results of cross-linking analysis with the components of YFSJ.
2.2 益肺散结丸对荷瘤小鼠一般状况的影响
实验结果显示,肿瘤负荷及益肺散结丸的治疗对小鼠的体质量均没有显著影响(P>0.05,图2A)。前肢握力试验结果显示,模型组小鼠的前肢握力较正常组明显降低,益肺散结丸治疗后,小鼠前肢握力得到了显著恢复(P<0.01,图2B)。正常组、模型组和益肺散结丸治疗组之间小鼠血清血糖和血清胰岛素浓度差异无统计学意义(图2C、D)。
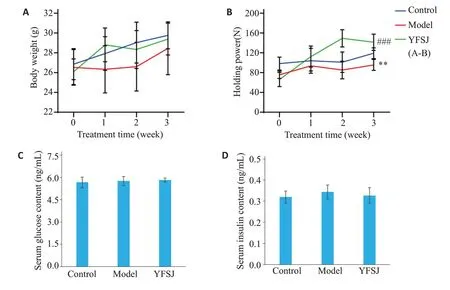
图2 益肺散结丸对荷瘤小鼠一般状况的影响Fig.2 Effect of YFSJ on general condition of tumor-bearing mice.A:Body weight of the mice measured once a week.B:Holding power of the mice measured once a week.C:Serum glucose content in the mice.D:Serum insulin content in the mice.**P<0.01 vs control group;###P<0.001 vs model group.
2.3 益肺散结丸对荷瘤小鼠腓肠肌重量和结构的影响
干预3周后,与正常组比较,模型组小鼠腓肠肌湿重明显降低;与模型组比较,益肺散结丸治疗组小鼠腓肠肌湿重显著升高(P<0.01,图3A)。模型组小鼠腓肠肌的湿重与体质量的比值降低,益肺散结丸治疗后升高(P<0.05,图3B)。HE 染色和透射电子显微镜结果显示,正常组小鼠腓肠肌肌纤维排列整齐,形态规则致密;模型组小鼠腓肠肌肌纤维间空隙变大变多,肌纤维内部出现萎缩;益肺散结丸治疗组小鼠腓肠肌肌纤维排列较为整齐,肌纤维间空隙较模型组减少,形态规则致密,肌纤维萎缩程度较低(图3C、D)。
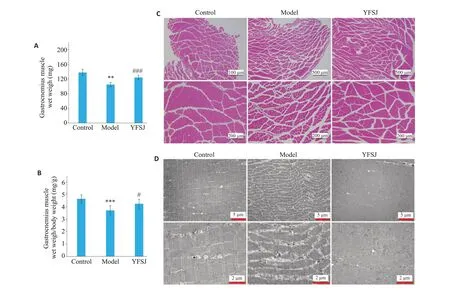
图3 益肺散结丸对荷瘤小鼠腓肠肌重量和结构的影响Fig.3 Effect of YFSJ on weight and structure of the gastrocnemius muscle in tumor-bearing mice.A: Wet weight of gastrocnemius muscle in mice.B:Ratio of gastrocnemius muscle wet weight to body weight of the mice(mg/g).C:HE staining of the gastrocnemius muscle(scale bar=500 μm or 200 μm).D:TEM results of the gastrocnemius muscle(scale bar=5μm or 2μm).**P<0.01,***P<0.001 vs control group;#P<0.05,###P<0.001 vs model group.
2.4 转录组学测序提示荷瘤小鼠腓肠肌的改变可能与炎症浸润、胰岛素抵抗和脂质代谢密切相关
结果显示,正常组与模型组之间共有1037个差异表达转录本(DEGs),模型组与益肺散结丸治疗组之间共有1850个差异表达转录本,两两之间共有274个差异表达转录本相同(图4A);这274个相同的差异表达转录本表达量双向聚类热图显示(图4B),正常组和益肺散结丸治疗组基因表达趋势较为统一,而模型组基因表达趋势则与之相反。
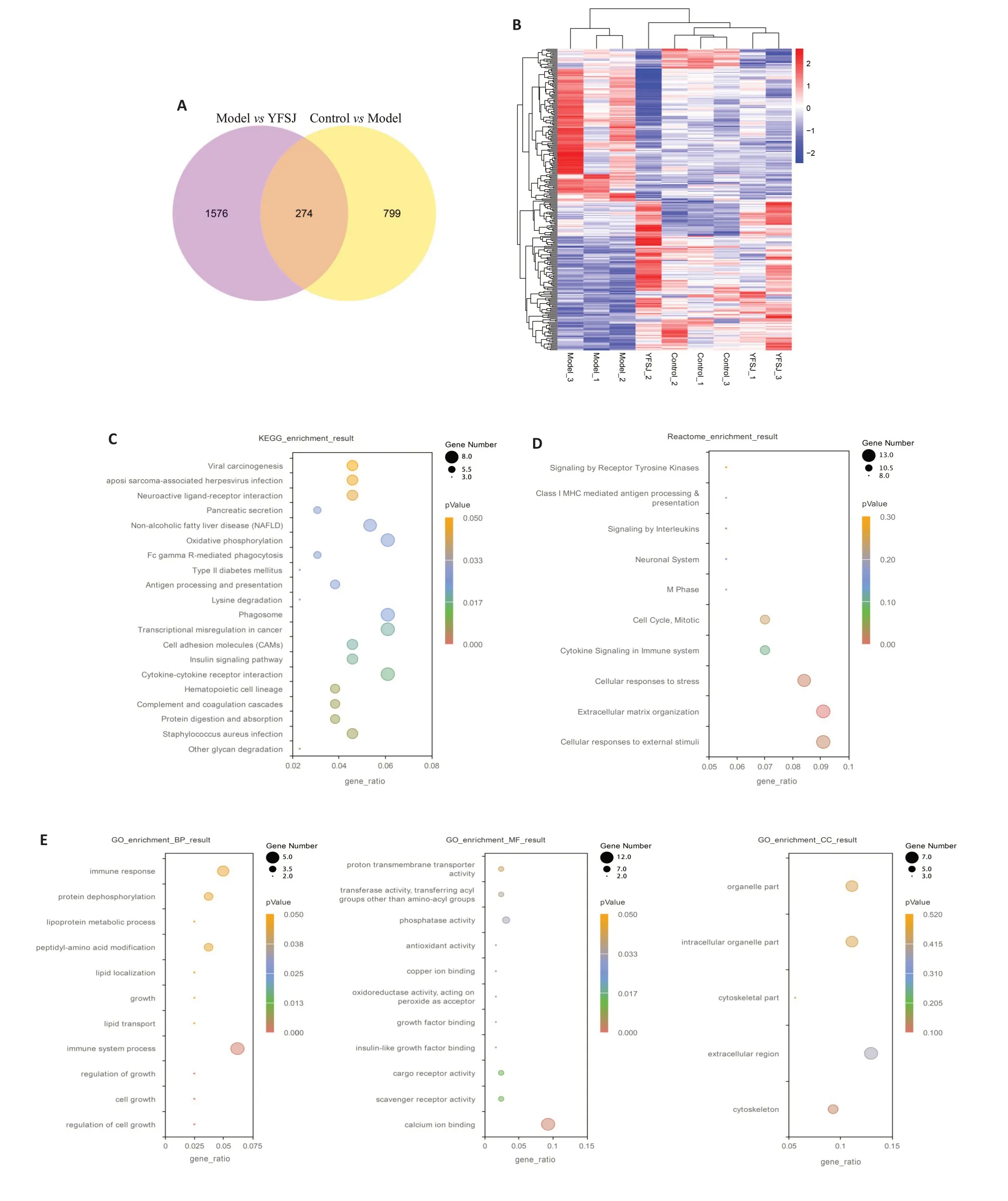
图4 益肺散结丸治疗荷瘤小鼠的腓肠肌转录组学测序分析Fig.4 RNA-seq analysis of the gastrocnemius muscle of the tumor-bearing mice treated with YFSJ.A:Venn diagram of differentially expressed genes(DGEs)between the control group and model group and between the model group and YFSJ group.B: Two-way cluster heatmap of common DGEs between the control group and model group and between the model group and YFSJ group.C:KEGG pathway enrichment analysis of common DGEs.D:Reactome enrichment analysis of the common DGEs.E:GO enrichment analysis of common DGEs.From left to right:biological process(BP),molecular function(MF),and cellular component(CC).
对274个相同的差异表达转录本进行富集分析,京都基因和KEGG通路富集分析结果显示,氧化磷酸化、II 型糖尿病、胰岛素信号通路、细胞因子受体相互作用、蛋白质消化吸收和其他聚糖降解等通路被富集(图4C);Reactome富集分析结果显示,白介素信号传导、免疫系统细胞因子信号传导、细胞对压力的反应和细胞对外部刺激的反应等反应被富集(图4D);基因本体论(GO)富集分析结果显示,免疫反应、蛋白磷酸酶、脂蛋白代谢过程、脂质定位、脂质转运和免疫系统过程等生物过程被富集,磷酸酶、抗氧化活性、氧化还原酶活性和胰岛素样生长因子结合等分子功能被富集,细胞外区域和细胞骨架等细胞成分被富集。
2.5 益肺散结丸对荷瘤小鼠血清和腓肠肌炎症因子以及腓肠肌P-AKT的影响
结果显示,模型组中小鼠血清和腓肠肌的IL-6和TNF-α水平均明显升高,益肺散结丸治疗后,促炎因子的水平均较模型组显著降低(P<0.01,图5A、D)。免疫组织化学染色结果显示,与正常组相较,标记巨噬细胞的F4/80在模型组和益肺散结丸治疗组中染色阳性面积均明显增加;模型组中,标记促炎M1型巨噬细胞的CD80阳性面积明显增加,而标记抗炎的M2型巨噬细胞的CD206染色阳性面积则没有明显增加;与模型组相较,益肺散结丸治疗组的CD80阳性染色不明显,而CD206阳性面积显著增加(图5E)。此外,模型组小鼠腓肠肌的胰岛素敏感性的标志物P-AKT染色阳性程度较正常组明显降低,益肺散结丸治疗后,P-AKT染色阳性程度得到恢复(图5E)。
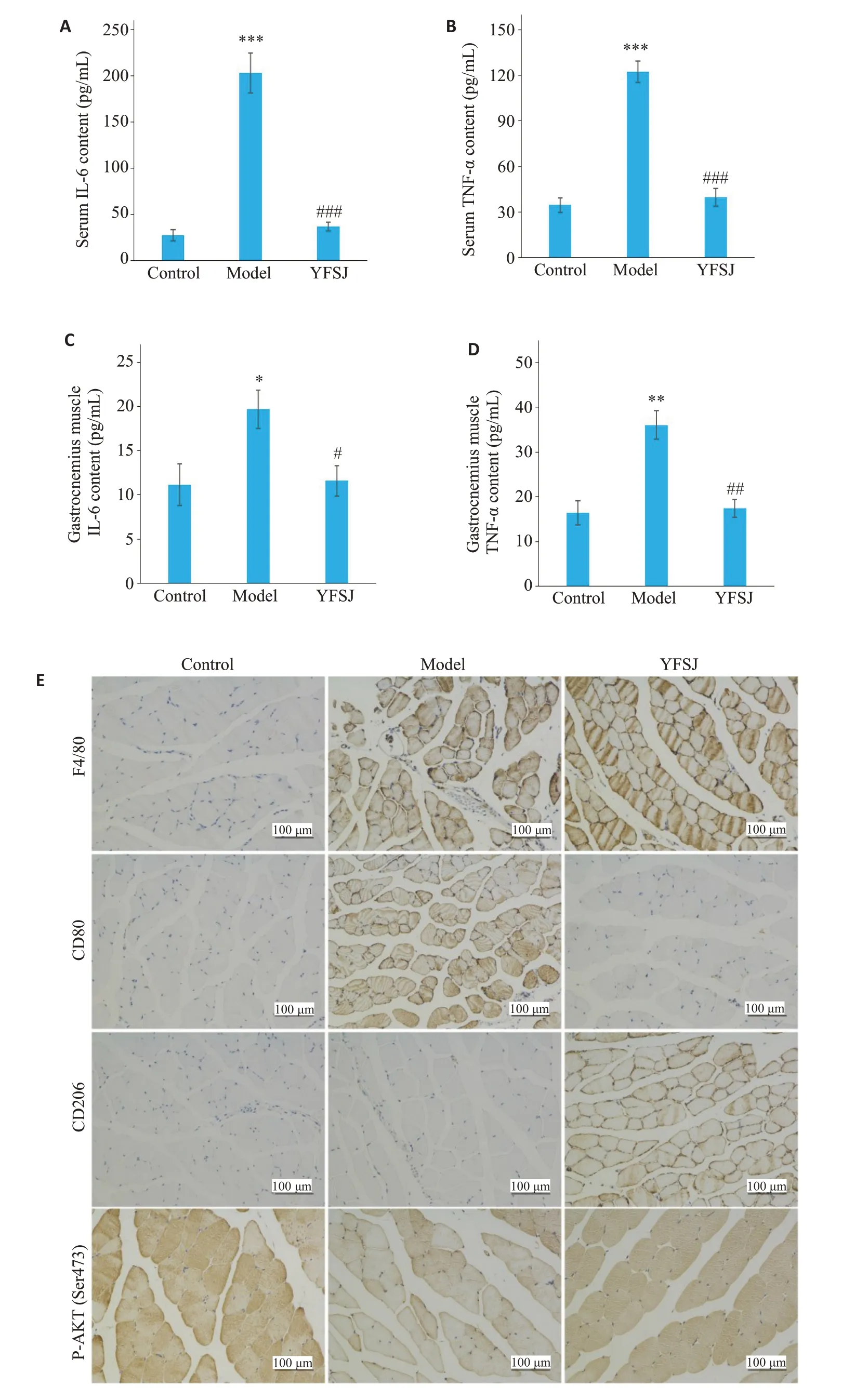
图5 益肺散结丸对荷瘤小鼠血清和腓肠肌炎症因子以及腓肠肌P-AKT的影响Fig.5 Effects of YFSJ on inflammatory cytokines in the serum and gastrocnemius muscle and P-AKT in the gastrocnemius muscle of the tumor-bearing mice.A: Serum IL-6 content.B: Serum TNF-α content.C: Gastrocnemius muscle IL-6 content.D: Gastrocnemius muscle TNF-α content.E: IHC staining results of inflammatory factors and P-AKT in gastrocnemius muscle.*P<0.05,**P<0.01,***P<0.001 vs control group;#P<0.05,##P<0.01,###P<0.001 vs model group.
2.6 益肺散结丸对荷瘤小鼠腓肠肌肌内糖原和肌内脂肪以及能量代谢的影响
PAS染色结果显示,模型组小鼠腓肠肌PAS染色阳性程度较正常组明显降低,益肺散结丸治疗后,PAS染色阳性程度较模型组明显升高(图6A)。油红O染色结果显示,模型组腓肠肌肌内脂肪含量明显低于正常组,益肺散结丸治疗后,腓肠肌肌内脂肪含量得到恢复(图6B)。能量代谢关键酶ATP酶染色结果显示,模型组腓肠肌ATP酶含量降低,在益肺散结丸治疗后,腓肠肌ATP酶含量显著得到恢复(图6C)。
2.7 益肺散结丸对荷瘤小鼠腓肠肌CK、LDH和MYO/MB的影响
实验结果显示,肌肉损伤的指标CK、LDH 和MYO/MB水平在模型组中均升高,益肺散结丸治疗后均有不同程度的下降(P<0.01,P<0.001,图7)。
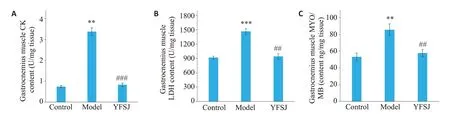
图7 益肺散结丸对荷瘤小鼠腓肠肌CK、LDH和MYO/MB的影响Fig.7 Effect of YFSJ on CK,LDH and MYO/MB in the gastrocnemius muscle of the tumor-bearing mice.A: Gastrocnemius muscle CK content.B:Gastrocnemius muscle LDH content.C:Gastrocnemius muscle MYO/MB content.**P<0.01,***P<0.001 vs control group;##P<0.01,###P<0.001 vs model group.
3 讨论
中医将肿瘤归类于“石瘕”“癥瘕”“积聚”等范畴,认为“痰、瘀、毒、虚”为肿瘤的主要发病机制;此外,中医将骨骼肌萎缩归类于“痿证”范畴,“痰、瘀、毒、虚”同样是“痿证”重要的发病机制,癌病日久,易生痰致虚,因此,肿瘤的发生发展与骨骼肌萎缩在病因病机上关系密切。现代药理学研究表明,益肺散结丸入血成分中3-苯基乳酸可以通过影响肠道菌群下调TNF-α等促炎因子的水平[15]且可以增强细胞的葡萄糖摄取,具有预防II型糖尿病和治疗胰岛素抵抗的潜力[16,17];诺卡酮可以通过多种途径发挥抗癌和抗炎等作用[18];5-(十四烷基氧)-2-糠酸可以降低促炎信号分子RhoA的表达减轻炎症[19]、降低Th17细胞百分比并减轻哮喘小鼠肺组织炎性细胞浸润[20]和预防肌肉细胞胰岛素抵抗[21];去氧苯巴比妥可以缓解炎症性热痛觉过敏[22]。这些研究说明益肺散结丸的有效成分在抗炎和治疗组织胰岛素抵抗中具有潜力,但其缓解肿瘤炎症微环境与其缓解骨骼肌损伤两者间是否有直接关系,及其作用机制尚未被完全揭示。
研究发现,肿瘤发生发展过程中,会产生大量的促炎因子和促炎细胞[12],这些炎症因子和炎症细胞随着循环系统分布全身,导致其他组织的炎症浸润。当组织长期处于高炎症浸润的状态下,容易出现炎症性胰岛素抵抗[23,24],导致吸收和利用葡萄糖的能力下降,进而引发代谢水平不足产生组织损伤[25]。本研究结果显示,与正常组比较,模型组荷瘤小鼠骨骼肌微结构被破坏、肌肉萎缩、肌肉强度下降,而益肺散结丸治疗能显著逆转肿瘤负荷所致的骨骼肌的破坏和骨骼肌强度下降。转录组学提示,上述病理变化与免疫、炎症、胰岛素通路、II型糖尿病等相关通路有密切关系;通过对相关生化指标的检测,我们发现尽管血清葡萄糖和胰岛素在3组之间没有显著差异,但模型组中骨骼肌肌内糖原和肌内脂质含量相较其他2组均有明显降低;此外,血清及骨骼肌促炎因子水平以及促炎细胞浸润水平在模型组中均较其他2组显著升高,益肺散结丸治疗组抗炎细胞的水平远高于模型组;AKT磷酸化参与了大多数胰岛素信号传导途径,P-AKT通常被视为判断胰岛素敏感性的标志之一[26,27],而结果显示P-AKT表达量以及ATP酶含量水平与肿瘤导致的高炎症环境呈负相关。以上研究结果表明肿瘤产生的炎症长期浸润骨骼肌,可能导致骨骼肌出现炎症性胰岛素抵抗,影响骨骼肌对葡萄糖的吸收及代谢,影响骨骼肌的能量供给。
骨骼肌是能量代谢的重要场所,当骨骼肌短时间内缺乏能量代谢时,会启动保护性自噬应对能量的缺乏[28]。当骨骼肌长期缺乏足够的能量代谢,会触发过度的自噬,进而导致骨骼肌的损伤和萎缩[29]。荷瘤3周后,模型组小鼠骨骼肌损伤标志物升高,提示骨骼肌出现损伤,益肺散结丸治疗显著逆转了小鼠骨骼肌损伤,显示出保护骨骼肌的作用,这进一步说明了益肺散结丸可能是通过改善骨骼肌能量代谢进而保护骨骼肌,缓解癌因性骨骼肌萎缩。
综上所述,益肺散结能够改善荷瘤模型小鼠骨骼肌微结构,提高小鼠骨骼肌强度,预防肿瘤所致的小鼠骨骼肌萎缩,其机制可能与降低肿瘤所致的全身炎症导致的骨骼肌组织炎症性胰岛素抵抗有关。本研究为防治癌因性骨骼肌萎缩提供了一种可靠的方法,并进一步揭示了肿瘤发展导致骨骼肌损伤的机制,为研究防治癌因性骨骼肌萎缩提供一种新思路。后续将基于入血成分对益肺散结丸进行进一步的药理学验证。
益肺散结丸可能通过降低肿瘤所致的全身炎症,进而减轻骨骼肌长期受炎症浸润导致的炎症性胰岛素抵抗,恢复骨骼肌对葡萄糖的吸收和利用,最终缓解癌因性骨骼肌萎缩。
- 南方医科大学学报的其它文章
- 尿路上皮癌抗原1促进滋养细胞功能及对上皮-间质转化转化的调控作用
- Brain iron deposition increases in the bilateral substantia nigra of patients with medication-overuse headache: a quantitative susceptibility mapping analysis
- 环状RNA hsa_circ_0006834可作为肝细胞癌患者预后的潜在生物标志物
- 慢性间歇性低氧大鼠肾组织差异蛋白的定量分析:基于TMTPRM技术
- 不同滴度MOG-IgG 抗体在MOG 抗体相关疾病中的诊断和临床意义:一项单中心回顾性研究
- 粪便蛋白Luminex液相芯片检测系统构建及其对结直肠肿瘤早期诊断的价值