藏红花醛对脂多糖诱导的脓毒症相关肝损伤小鼠模型的作用及其机制
陈 意, 陈羿帆, 杜毅超,2, 谭 鹏,2, 李童希, 白俊杰, 付文广,2
1 西南医科大学附属医院普通外科(肝胆胰方向), 四川 泸州 646000; 2 四川省院士(专家)工作站, 四川泸州 646000
脓毒症是一种临床常见的感染性疾病,可导致多种器官功能损伤或衰竭,其中肝脏是常见的受累器官。脂多糖(lipopolysaccharide,LPS)作为革兰阴性菌细胞壁的主要成分,能够刺激肝细胞释放多种促炎症因子(如TNF-α、IL-1、IL-6 等),引起血清凝集素的释放,并激活全身性炎症反应,从而形成内毒素血症[1-2]。研究[3-5]表明,LPS 可以模拟脓毒症诱发的急性肝损伤,因此LPS 诱导的小鼠肝损伤模型在相关研究中被广泛应用。目前,脓毒症诱导急性肝损伤的病因被认为有炎症和免疫反应、细胞缺氧、细胞凋亡和氧化应激等。在脓毒症相关肝损伤(sepsis related liver injury,SRLI)中,LPS与Toll样受体4和CD14的结合对细胞核因子-κB(NF-κB)的活化起重要作用,而NF-κB 的活化则是LPS 诱导肝损伤的主要机制,其潜在机制涉及炎症和细胞凋亡[6-7]。研究[8-10]表明,氧化应激因子通过激活核因子NF-E2 相关因子2(nuclear factor NF-E2-related factor 2,Nrf2)可上调血红素加氧酶-1(heme oxygenase-1,HO-1)的表达,通过HO-1 的抗炎、抗氧化和抗凋亡蛋白的保护作用,影响各种感染性疾病的发生和发展。藏红花醛作为藏红花的主要化学成分之一,其抗氧化、抑制氧化应激反应、抗炎和抗凋亡等功能已被重视,现有研究[11-13]指出藏红花醛可有效保护脑、心肌、骨骼肌和视网膜等组织免受氧化损伤。然而,其在SRLI 中的应用目前未见报道,深入研究其抗氧化作用效果并了解其作用机制可为脓毒症相关急性肝损伤的防治提供理论基础。
1 材料及方法
1.1 实验动物 32 只雄性C57BL/6 小鼠购于北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2019-0008。小鼠分组单笼饲养于西南医科大学实验动物中心的SPF 动物房,使用许可证号:SYXK(川)2018-065,温度控制于(25±2)℃,湿度控制为(45±5)%,自由饮食饮水饲养,环境明暗12 h/12 h循环。
1.2 试验材料 人正常肝细胞L02 细胞株购于上海中国科学院细胞库;LPS 购自美国Sigma 公司;藏红花醛购自美国Sigma 公司;RIPA 裂解液和苯甲基磺酰氟(PMSF)购自Solarbio 公司;苏木精-伊红(HE)染液试剂盒购自碧云天生物科技有限公司;BCA 蛋白定量试剂盒和TUNEL 检测试剂盒购自碧云天生物技术有限公司;聚偏氟乙烯(PVDF)膜购自Merck Millipore 公司。试剂:Nrf-2(批号:16396-1-AP)、HO-1(批号:66743-1-Ig)和β-actin(批号:81115-1-RR)抗体均购自Proteintech 公司(中国,武汉);活性氧(ROS)检测试剂盒购自碧云天生物技术有限公司。
1.3 方法
1.3.1 动物饲养、分组与给药 采用简单随机法将32 只雄性C57BL/6 小鼠分为4 组,每组8 只:适应性饲养1 周,分为对照组(生理盐水)、单药组(藏红花醛60 mg/kg)、模型组(LPS 10 mg/kg)、治疗组(藏红花醛60 mg/kg+LPS 10 mg/kg),对照组给予生理盐水1 次,单药组和治疗组每天给予藏红花醛1次,连续给药7天。为诱导小鼠急性肝损伤,在最后一次给药2 h 后将模型组和治疗组的小鼠分别经腹腔注射LPS(10 mg/kg)。12 h 后,给予戊巴比妥(40 mg/kg)腹腔注射麻醉,从而取得小鼠肝脏样本和血液样本。下腔静脉血室温下放置2 h,血清分层后低温4 000 r/min 离心10 min,随后提取上层血清放入4 ℃冰箱中备用。取部分小鼠肝组织置于4%多聚甲醛中固定,用于行HE、免疫组化染色及TUNEL检测,剩余部分肝脏在液氮速冻后放入-80 ℃冰箱中备用。
1.3.2 细胞培养、分组与给药 取人正常肝细胞L02细胞,加入10%胎牛血清,培养于含5%青霉素和链霉素的培养基中,置于37 ℃、5% CO2培养箱内静置培养至对数生长期,将其接种于6 孔板,设置对照组、单药组、模型组、治疗组。接种12 h 后,细胞完全贴壁,用新鲜培养基替换原有培养基。向对照组(生理盐水)、单药组(藏红花醛100 μmol/L)、模型组(生理盐水)、治疗组(藏红花醛100 μmol/L)分别加入相应的药物,药物加入后,置于37 ℃、5% CO2培养箱内培养2 h。向模型组和治疗组中加入LPS(100 ng/mL),继续置于37 ℃、5% CO2培养箱内培养4 h。
1.3.3 血清转氨酶检测 使用全自动生化分析仪(BIOBASE,BK-200),对上述步骤获取的小鼠血清行AST及ALT活性测定。
1.3.4 HE 染色 使用4%多聚甲醛固定肝组织,凝固后包埋于石蜡中,并使用切片机将石蜡切成4 μm厚的切片,最后进行HE 染色。首先使用二甲苯将石蜡切片进行脱蜡,然后使用梯度乙醇进行复水处理,以恢复其原来的形态和结构。使用新鲜配制的苏木素染色时间3 min,分化时在显微镜下观察细胞核染色情况,细胞核变蓝后可立即将切片放置于自来水中冲洗。新鲜的伊红染色1 min,伊红染色后需经过从低浓度到无水的各级乙醇脱水。将脱水好的切片用二甲苯透明处理以后,再用中性树脂封片并进行光镜检查,对比病变的严重程度,依据水肿、炎症反应和坏死(点状、条状、带状)情况进行评估。
1.3.5 免疫组化 将获取的肝组织切片在二甲苯和梯度乙醇中进行脱蜡,然后将其放入缓冲液中,保持2 h 以使抗原决定簇获得充分暴露。再将其浸泡于3%过氧化氢溶液中,在室温下孵育10 min,然后将其封闭,并用PBS 冲洗3 次,加入1∶200 稀释的HO-1 工作液4 ℃孵育过夜,次日冲洗干净,滴加对应种属的二抗工作液(HRP 标记)室温孵育30 min,清洗,DAB 显色2~5 min 至显微镜观察到棕黄色颗粒,使用去离子水终止反应。使用苏木素染液轻度复染1.5~2 min,再清洗,采取梯度乙醇脱水,浸泡于二甲苯,烘干,以中性树胶封片,送入显微镜观察、记录并分析图像。
1.3.6 Western Blot 检测 从少量冻存的肝组织中提取样本,通过检测氧化应激及炎症相关蛋白的表达水平研究肝脏状态。首先,将RIPA 细胞裂解液(含1%PMSF)加入样本并使用匀浆机对其进行匀浆,然后将其放置于冰上约30 min,并以4 ℃、12 000 r/min 的速度进行离心20 min,最后吸取上清液,然后行蛋白质浓度测定、变性、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离以及转印。待蛋白转印至PVDF膜上后,用5%脱脂奶粉(溶于TBST)在室温下封闭1 h;然后加入一抗(HO-1,1∶2 000 稀释;Nrf-2,1∶2 000 稀释;β-actin,1∶4 000 稀释),在4 ℃摇床条件下孵育过夜;次日洗膜后,加入1∶5 000 稀释的HRP 标记的二抗工作液,在室温下孵育1 h;洗膜后使用ECL 发光液对蛋白条带进行显色,并在成像系统中进行检测,利用ImageJ 软件对检测到的条带进行灰度分析,以β-acting 作为内参进行校正,对目标蛋白表达水平进行半定量分析。
1.3.7 TUNEL标记检测 小鼠肝组织行常规石蜡切片,采用TUNEL 标记检测肝细胞凋亡及其变化[14]。使用碧云天(中国)的TUNEL 凋亡试剂盒,按照产品使用说明书进行染色。
1.3.8 ROS 活性检测 按照碧云天生物技术有限公司提供的ROS检测试剂盒说明书进行操作,并在荧光显微镜下观察和拍照记录。
1.4 统计学方法 采用SPSS 22.0 软件和Graphpad Prism9 软件对数据进行统计分析和制图,计量数据以xˉ±s表示,组间比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 肝生化指标比较 对照组与单药组相比较,给药后两者ALT 水平相当,两者变化无统计学意义(P>0.05)。与对照组相比,模型组小鼠注射LPS 之后,ALT 水平明显升高(P<0.001);与模型组比较,治疗组ALT 水平较模型组明显降低(P<0.001)。与模型组比较,治疗组AST 水平较模型组明显降低(P<0.01)(图1)。
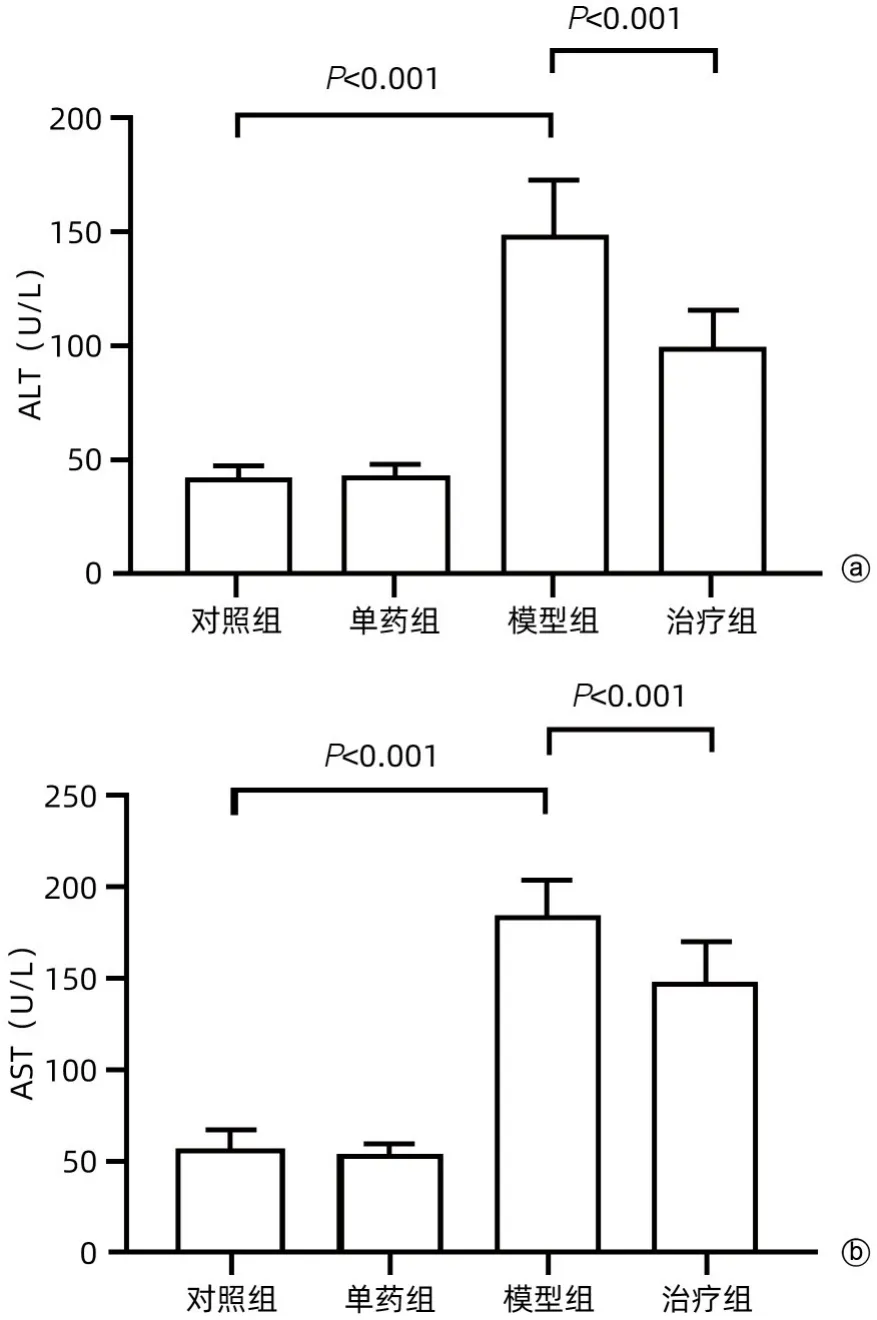
图1 小鼠血清中转氨酶水平的差异Figure 1 The differences of transaminase levels in mice serum
2.2 HE 染色结果比较 HE 染色显示,对照组和单药组肝组织细胞结构完整,界限清楚,肝小叶轮廓清晰,以中央静脉为中心,肝细胞有序排列呈放射状,相互连接成肝细胞条索,表现出良好的结构完整性,未见明显的细胞变性、坏死及脂肪变性。模型组肝组织细胞排列不规律,肝细胞肿胀,存在大量的血管破裂和红细胞弥散,细胞形态异常;治疗组肝组织HE 染色,可见有部分肝细胞明显收缩变性,肝小叶轮廓不规则、细胞排列紊乱,界限大致清楚,部分肝小叶间隔增大,可见肝细胞肿胀,可见少量血管破裂和红细胞弥散(图2)。
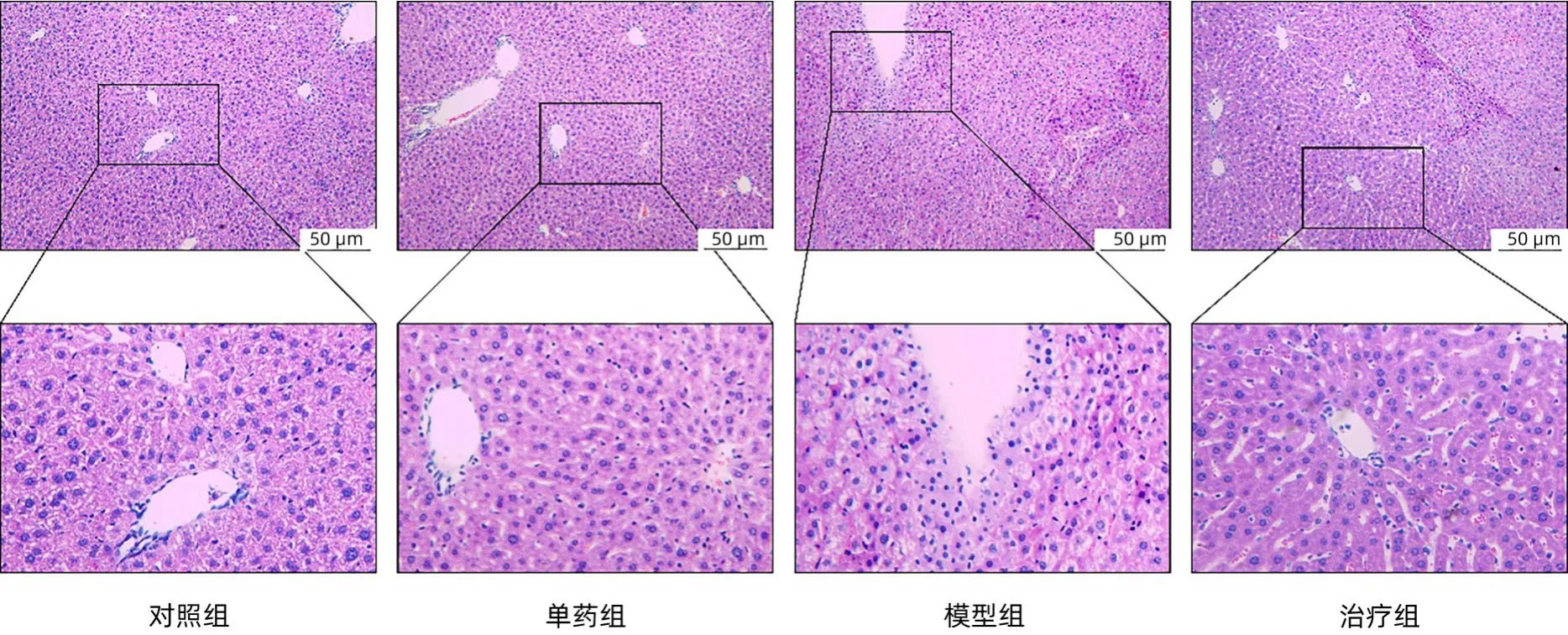
图2 各组小鼠肝组织HE染色结果比较(×200)Figure 2 The difference of liver tissue after HE staining in each group(×200)
2.3 免疫组化结果比较 通过免疫组化实验检测各组小鼠肝脏中HO-1 的表达情况,结果显示,对照组和单药组小鼠肝组织HO-1 的表达维持在正常水平,只可见轻微的阳性细胞。在模型组中,HO-1 的表达出现轻度升高,而在治疗组则表现出明显的升高(图3)。

图3 各组小鼠肝组织免疫组化检测HO-1蛋白水平比较(×200)Figure 3 The protein levels of HO-1 detected by immunohistochemical staining(×200)
2.4 Western Blot结果比较 通过Western Blot分析各组小鼠肝组织样本中Nrf2 和HO-1 的表达水平。对照组中Nrf2 的表达量很低,单药组中同样可见Nrf2 少量表达,模型组与对照组和模型组比较可见Nrf2 表达水平略微高于前两组,在给予LPS 后模型组Nrf2 升高更加明显,模型组与对照组比较差异有统计学意义(P<0.001)。经藏红花醛+LPS 处理后的治疗组中Nrf2 表达量相较于模型组明显升高(P<0.001)。在对肝组织HO-1 检测中发现,对照组中仅见极低量的HO-1 表达,单药组中可见微量HO-1 表达。经LPS 诱导后,模型组小鼠肝组织HO-1 表达有所上升,而治疗组小鼠经藏红花醛+LPS 处理后肝组织HO-1 表达水平相较于模型组明显升高(P<0.001)(图4)。

图4 各组小鼠肝组织Nrf2和HO-1表达量比较Figure 4 The expression levels of Nrf2 and HO-1 in liver tissue of mice in each group
2.5 TUNEL 检测结果比较 TUNEL 检测结果显示,模型组小鼠肝组织细胞凋亡率明显高于对照组。与模型组相比,给予藏红花醛药物干预后,治疗组小鼠肝组织细胞凋亡率明显降低,对照组和单药组无明显异常(图5)。

图5 TUNEL检测各组小鼠肝组织中细胞凋亡情况(×200)Figure 5 Cell apoptosis in liver tissue of mice were detected by TUNEL assay(×200)
2.6 ROS 检测结果比较 通过使用荧光显微镜观察发现,发现ROS 的产生量在对照组和单药组中均低,而在模型组中明显升高。与模型组相比,治疗组中ROS的产生量明显减少(图6)。

图6 各组L02细胞中ROS产生量的比较(×200)Figure 6 Comparison of ROS production in L02 cells in each group(×200)
3 讨论
对脓毒症病理生理学的研究至关重要,有助于深入了解免疫反应失调如何导致器官功能障碍,从而优化患者的管理和治疗,并发现新的潜在治疗方法。脓毒症可对心血管系统(包括微循环系统)、呼吸系统[15]、肾脏系统[16]、神经系统、血液系统和消化系统[17]造成损害,其中肝脏是脓毒症常常累及的器官。早期出现的肝功能障碍是脓毒症患者死亡的重要预警信号,其重要性高于呼吸、循环、中枢神经症状,且现有治疗措施无法有效缓解肝损伤。近年研究发现,氧化应激是SRLI 过程中重要因素[18],如何抑制氧化应激是该病治疗研究的重要方向。藏红花醛具有强抗氧化作用[19],本研究通过Nrf-2/HO-1信号通路探索藏红花醛抗氧化作用的分子机制,为抗氧化途径治疗SRLI提供理论基础。
本研究团队通过既往文献[20-23]明确藏花醛对肝损伤保护作用的使用技术方法:在动物实验中,藏红花醛的有效剂量为20~200 mg/kg,经腹膜内或静脉内途径给药,因此本研究选择藏红花醛60 mg/kg 作为治疗组,并通过腹膜内途径给药。在细胞实验中,浓度范围为1~800 μmol/L 的藏红花醛对细胞无明显毒性作用,因此本研究实验浓度定为100 μmol/L。
本研究建立藏红花醛预处理的SRLI 小鼠模型,结果显示,藏红花醛预处理后小鼠血清AST、ALT 水平降低,小鼠肝组织病理学损伤减轻,提示藏红花醛可有效减轻肝损伤,对小鼠肝功能有一定的保护作用,与既往相关研究[20,24-25]结论一致。本研究发现,LPS 处理后肝组织蛋白中Nrf-2/HO-1 表达量明显增加,肝组织中细胞凋亡加重,免疫组化结果一致。LPS处理后ROS产生量明显增加,提示ROS参与氧化应激过程。脂肪氧化可产生过量的ROS,ROS 与细胞结构发生反应,导致脂质过氧化和DNA 氧化损伤。氧化应激与细胞凋亡是序贯发生的,与本研究TUNEL 实验模型组中观察到的结果一致。氧化应激性疾病发生发展过程中,当ROS的异常产生强于细胞和组织的抗氧化防御系统时,即发生氧化应激,导致抗氧化防御系统受损,过量的ROS 可导致细胞损伤、脂质过氧化和细胞凋亡。目前已知Nrf2-ARE(抗氧化反应元件)是十分重要的抗氧化应激信号通路之一,该通路在肝脏疾病的发生、发展及预防过程中发挥重要作用[26]。Nrf2 能够在ROS 刺激下转位进入细胞核,并与ARE相互作用,启动下游抗氧化保护性基因和Ⅱ相解毒酶基因的转录,其中包括HO-1,达到保护细胞免受氧化应激损伤的作用[27]。HO-1是机体对抗氧化应激过程中重要的成员之一。完整的Nrf2/HO-1 信号通路是其发挥抗氧化、抗炎、调节细胞死亡等多种效应的基础,最终对疾病的转归产生重大影响[28]。藏红花醛具有明确的抗氧化作用,其对Nrf-2/HO-1 通路的影响亟需深入研究。本研究显示,藏红花醛处理后肝组织蛋白中Nrf-2/HO-1 表达量明显增加,L02 细胞中ROS 产生量明显减少。细胞凋亡实验显示,藏红花醛处理后细胞凋亡减轻。笔者团队推测,藏红花醛处理后,肝组织中Nrf-2/HO-1 的表达量升高与ROS 的减少存在一定联系。现有研究[29-32]表明,藏红花醛在骨关节炎、结肠癌、缺血心肌疾病、哮喘、精神分裂症等疾病中表现出治疗作用,主要机制为减少ROS产生。本研究发现,藏红花醛处理后再使用LPS 刺激能够使Nrf2/HO-1 信号通路被激活,蛋白表达量增加,Nrf2/HO-1 发挥抗氧化作用,对ROS 的清除作用增强,从而减少ROS对细胞的凋亡作用,与本研究治疗组中观察到的结果一致。
综上所述,经藏红花醛预处理后,当机体遭遇氧化应激因素时,Nrf2/HO-1 信号通路的激活可以提高细胞内抗氧化剂水平,减少肝细胞中ROS 的产生,从而抑制LPS 诱导的SRLI 中的氧化应激和细胞凋亡。因此,藏红花醛有望成为预防急性肝损伤的潜在药物。
伦理学声明:本研究方案于2021 年11 月19 日经由西南医科大学实验动物伦理委员会审批,批号:20211119-047,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在任何利益冲突。
作者贡献声明:陈意负责课题设计,资料分析,撰写论文;陈意、陈羿帆参与动物造模及实验;李童希、白俊杰、杜毅超、谭鹏负责数据分析和细胞实验;付文广负责实验设计,拟定写作思路,指导撰写文章并最后定稿。

